正常牛肉與DFD牛肉成熟過程中保水性和水分狀態變化
孫文彬,羅 欣,毛衍偉,張一敏,朱立賢,梁榮蓉,左惠心,明丹丹,牛樂寶*
(山東農業大學食品科學與工程學院,山東 泰安 271018)
肉的保水性是指肌肉受到外力作用時保持自身水和外加水分的能力。牲畜屠宰后,肌肉組織自身的纖維結構和鮮肉受到的不同冷卻、包裝、加工處理會對肉中水分分布產生影響,并最終影響鮮肉的保水性,低保水性會導致胴體質量降低,使生產商蒙受損失;此外,在商超出售時,肉表面滲出的汁液會降低消費者的購買欲望。因此鮮肉保水性的相關研究一直為企業和肉類科學家的關注重點。
牲畜屠宰后,肌肉內的酶受到肌糖原無氧酵解產生的乳酸的抑制作用,使肌糖原不能繼續分解,pH值不再下降,此時肌肉的pH值稱為極限pH值。DFD(dark, firm and dry)牛肉是由于肉牛宰前受到應激導致體內肌糖原含量降低,因此產生的乳酸不能使肌肉極限pH值下降到正常范圍內的一種異質肉[1]。相比于正常牛肉,DFD牛肉極限pH值高、肉色紫黑、風味差且適宜微生物生長,貨架期短[2]。雖然如此,DFD牛肉卻具有良好的保水性,因此研究DFD牛肉成熟過程中水分狀態的變化并闡明DFD牛肉保水性好的原因,可為改善正常肉與肉制品的保水性提供新的思路。
肉在成熟過程中,結合水、不易流動水和自由水的狀態和比例會發生變化,并因此影響生鮮肉的保水性[3]。低場核磁共振(low-field nuclear magnetic resonance,LF-NMR)技術可以通過檢測肉中氫質子的存在狀態反映肉中不同狀態水分的自由度和相對含量[4],此外核磁共振成像也可通過亮度來表征肉中氫質子密度,直觀反映水分的變化。目前已有基于LF-NMR技術測定正常豬肉在成熟過程中水分狀態和遷移的研究,但DFD牛肉成熟過程中的水分狀態變化研究仍鮮見報道。
因此,本研究選取不同極限pH值的牛背最長肌為研究對象,分別測定成熟3、7、14 d和21 d的保水性變化,并通過LF-NMR技術探究其水分狀態和遷移規律,同時測定成熟過程中肌節長度和細胞外空間的變化,以期從水分狀態和肌肉組織角度解釋DFD牛肉保水性較好的原因,并為提高正常牛肉制品的保水性提供理論指導和技術參考。
1 材料與方法
1.1 材料與試劑
本實驗材料選取來自同一育肥場的魯西黃牛×西門塔爾雜交牛(24 月齡)。
蔗糖、無水乙醇、二甲苯、氨水、中性樹膠(均為分析純) 國藥集團化學試劑有限公司;蘇木精染液套裝 武漢谷歌生物科技有限公司。
1.2 儀器與設備
DM-6801A數字溫度計 深圳勝利高電子科技有限公司;SenvenGo pH計 瑞士梅特勒-托利多儀器有限公司;C200真空包裝機 德國Multivac公司;DK-S28電熱恒溫水浴鍋 上海精宏實驗設備有限公司;T18高速分散機 德國IKA公司;BX41生物顯微鏡 日本奧林巴斯公司;ToledoAB-104N分析天平 瑞士梅特勒-托利多儀器有限公司;NMI20-015V-1核磁共振成像分析儀上海紐邁電子科技有限公司;JJ-12J脫水機、JB-P5包埋機、JB-L5凍臺 武漢俊杰電子有限公司;RM2016病理切片機 德國徠卡儀器有限公司;KD-P組織攤片機浙江省金華市科迪儀器設備有限公司;GFL-230烤箱天津市萊玻瑞儀器設備有限公司;Eclipse E100正置光學顯微鏡、DS-U3成像系統 日本尼康公司。
1.3 方法
1.3.1 原料處理與分組
在重慶某商業屠宰廠按照標準屠宰工藝屠宰后,監測宰后胴體背最長肌pH值變化,根據監測的pH值選定DFD牛肉與正常牛肉背最長肌各6 條(當牛肉極限pH值大于6.09時,品質會產生較大差異[5],因此本實驗以宰后24 h時pH值在5.4~5.6范圍內的牛肉確定為正常牛肉,pH值不低于6.10的牛肉確定為DFD牛肉),0~4 ℃黑暗冷庫冷卻成熟48 h后進行分割,取左半胴體背最長肌真空包裝后在24 h內0~4 ℃低溫環境運往實驗室,分切為2.54 cm厚的牛排后,真空包裝置于0~4 ℃黑暗冷庫中繼續成熟,分別在各個時間點隨機取出牛排分割為小塊進行后續指標測定。
1.3.2 指標測定
1.3.2.1 pH值的測定
使用SenvenGo pH計分別對宰后24 h,成熟3、7、14 d及21 d的牛背最長肌pH值進行測定,其中宰后24 h的pH值測定位置為牛背最長肌12~13肋骨間,pH計探頭插入肉中深度約3 cm;成熟3、7、14、21 d則對分割好的牛排進行測定,均連續測定3 次取平均值。
1.3.2.2 汁液損失率的測定
汁液損失率參考Honikel等[6]的方法測定,分別對成熟3、7、14 d和21 d的牛排進行取樣,將樣品切割成5 cm×3 cm×2 cm的肉塊,樣品避免脂肪和筋腱,稱質量(m1/g)后,用鐵絲鉤住肉塊一端,懸掛于聚乙烯塑料袋中(樣品不得與塑料袋接觸),扎緊袋口后置于0~4 ℃黑暗冷庫中,懸掛24 h后取出肉樣,用濾紙擦干肉樣表面水分后稱質量(m2/g),重復3 次取平均值。汁液損失率按公式(1)計算。
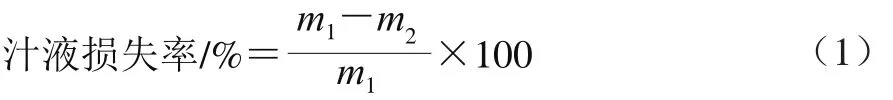
1.3.2.3 貯藏損失率的測定
貯藏損失率的測定參考Liu Yuqing等[7]的方法,在成熟3 d時,將背最長肌分割為2.54 cm厚的牛排,稱質量(m3/g)并記錄,真空包裝后置于環境溫度為0~4 ℃的冷庫中避光貯藏,分別在成熟7、14 d及21 d取出牛排,用濾紙吸干肉塊表面汁液,再次稱質量(m4/g),重復3 次取平均值。貯藏損失率按公式(2)計算。
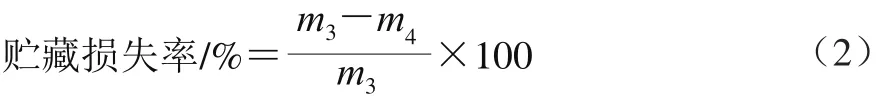
1.3.2.4 蒸煮損失率的測定
蒸煮損失率的測定參考Liu Yuqing等[7]的方法,取用成熟3、7、14 d及21 d的牛排,稱質量(m5/g),然后在牛排中心處插入數字溫度計,封口包裝后在80 ℃水浴條件下加熱至肉塊中心溫度至70 ℃,室溫冷卻2 h,將真空袋中的汁液倒掉,用濾紙吸干肉塊表面汁液,稱質量(m6/g),重復2 次取平均值。蒸煮損失率按公式(3)計算。

1.3.2.5 水分分布的測定
使用NMI20-015V-1核磁共振成像分析儀進行橫向弛豫特性分析,測定前將儀器預熱40 min。測試溫度為32 ℃,測定樣品前使用FID序列對儀器進行校準,所用FID參數:TD=1 024、PRG=2、TW=1 500 ms、NS=4、SW=100、RFD=0.08、RG1=20、DRG1=3。肉樣制取參照王志永[8]和黃子信[9]等的方法,沿肌纖維方向分切2 cm×1 cm×1 cm的肉條,稱質量后輕緩放入核磁測定專用試管底部,于32 ℃中水浴至恒溫,擦干管壁后重復測定3 組平行,樣品測定使用CPMG序列,具體參數為:PRG=2、TW=2 500、P2=22、TE=0.6、NECH=12 000、SW=250、RFD=0.002、RG1=20、DRG1=3、NS=8。樣品核磁成像同樣通過NMI20-015V-1核磁共振成像分析儀進行測定,測試溫度為32 ℃,在測試樣品前,使用標準油樣進行校準,并對樣品進行預掃描后進行正式成像。所用成像參數為:TR=500、TE=20、AVERAGES=3、FOV Read=80、FOV Phase=80,肉樣成像厚度為3 mm,同一樣品進行5 層成像。
1.3.2.6 肌節長度的測定
肌節長度的測定參考Li Ke等[10]的方法并稍加修改。剪取修整后牛肉樣品2 g,放于25 mL燒杯中,加入4 ℃預冷的0.25 mol/L蔗糖溶液18 mL,低速(6 000 r/min)勻漿1 min,然后取懸浮液制作載玻片,在BX41生物顯微鏡下放大1 000 倍觀察并拍照。使用Image-Pro Plus version 6.0軟件測量肌節長度。每個樣品取5 個平行樣(載玻片),總共測量150 次。150 次測量結果的平均值即為該樣品的肌節長度。
1.3.2.7 肌細胞橫截面顯微結構觀察
在成熟3、7、14 d和21 d時延肌纖維方向取0.5 cm×0.2 cm×0.2 cm肉樣,每個樣品取3 個平行樣,置于servicebio專用固定液固定24 h以上,修整樣品后進行梯度乙醇脫水并進行石蠟包埋和切片,處理條件如下:75%(體積分數,下同)乙醇溶液4 h,85%乙醇溶液2 h,90%乙醇溶液2 h,95%乙醇溶液1 h,無水乙醇I 30 min,無水乙醇II 30 min,醇苯5~10 min,二甲苯I 5~10 min,二甲苯II 5~10 min,蠟I 1 h,蠟II 1 h,蠟III 1 h。將浸好蠟的組織于包埋機內進行包埋,之后于-20 ℃冷卻,蠟凝固后將蠟塊從包埋框中取出并修整蠟塊。修整好的蠟塊置于石蠟切片機切片,厚3 μm。切片漂浮于攤片機40 ℃溫水上將組織展平,載玻片將組織撈起,60 ℃烘箱內烤片。將水烤干、蠟烤化后取出常溫保存,用于后續蘇木精-伊紅染色處理。將處理好的石蠟切片放入二甲苯I 20 min,二甲苯II 20 min,無水乙醇I 5 min,無水乙醇II 5 min,75%乙醇溶液5 min,自來水洗后進行蘇木精染色(蘇木精染色3~5 min,1%鹽酸溶液分化,1%氨水溶液返藍,水洗)和伊紅染色(切片依次用85%、95%的梯度乙醇溶液脫水,放入伊紅染液中染色5 min),將切片依次放入無水乙醇I 5 min,無水乙醇II 5 min,無水乙醇Ⅲ 5 min,二甲苯I 5 min,二甲苯II 5 min,然后置于中性樹膠封片后進行顯微鏡鏡檢。并對顯微圖像進行掃描保存。顯微圖像經過Photoshop 7.0軟件處理去除細胞間雜亂組織后,通過Image-Pro Plus 6.0軟件測量獲得細胞外空間面積,細胞外空間面積比按式(4)計算。

1.4 數據處理與分析
數據采用SPSS Statistics 22軟件進行統計分析,對不同pH值牛肉的不同指標進行單變量一般線性模型和皮爾遜相關性分析。通過SigmaPlot 10.0和Excel 2013軟件作圖。
2 結果與分析
2.1 不同極限pH值牛肉成熟過程中pH值變化
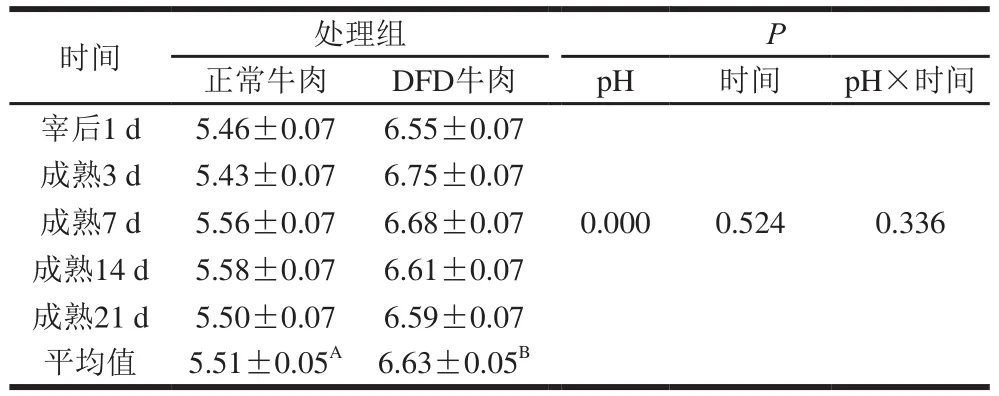
表1 宰后及成熟過程中正常和DFD牛肉pH值變化Table 1 Changes in pH in normal and DFD beef during postmortem aging
由表1可知,在宰后1 d和成熟3~21 d的過程中,正常牛肉pH值保持在5.43~5.58,而DFD牛肉pH值保持在6.55~6.75,DFD組宰后及成熟過程中平均pH值顯著高于正常牛肉(P<0.05)。秦麗波[11]研究同樣表明真空包裝的DFD和正常牛肉在成熟20 d內,其pH值分別保持在6.60~6.67和5.48~5.52范圍內,該結果與本研究類似。
2.2 不同極限pH值牛肉成熟過程中保水性變化
評價肉的保水性的指標有很多,通常選用某個指標來衡量肉的保水性,但通過不同指標評估成熟過程中牛肉的保水性,其趨勢往往有差異。因此為了模擬牛肉在吊掛、成熟和烹飪過程中完整的保水性變化,本實驗通過成熟過程中牛肉的汁液損失率、貯藏損失率、蒸煮損失率之和作為總水分損失來衡量。
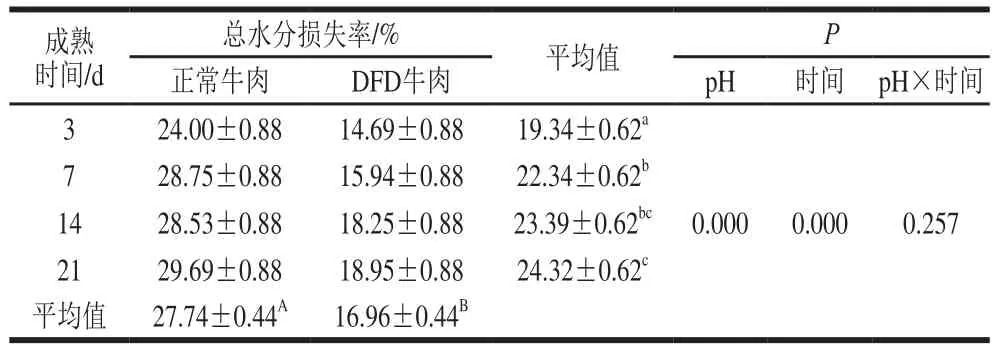
表2 成熟過程中正常和DFD牛肉總水分損失率變化Table 2 Changes in percent water loss in normal and DFD beef during postmortem aging
由表2可知,pH值與成熟時間對成熟過程中正常和DFD牛肉總水分損失率變化無交互作用,pH值和成熟時間均具有主效應。隨著成熟時間的延長,正常牛肉的總水分損失率從24.00%升高到29.69%,而DFD牛肉的總水分損失率則從14.69%升高到18.95%,這意味著不同極限pH值的牛肉保水性在成熟過程中呈現持續穩定的下降。且在成熟過程中,DFD牛肉的總水分損失率平均值顯著低于正常牛肉(P<0.05)。Hughes等[12]研究表明隨著成熟的進行,細胞骨架蛋白的降解會減少肌原纖維收縮力的傳遞,使水分在肉中保留,且成熟過程中肌原纖維會發生腫脹,容納更多的水分,因此在成熟后期保水性會有所改善[13],這與本實驗的研究結果相悖,其原因可能是該學者測定保水性所使用的離心損失法、汁液損失法檢測的是肉中部分水分的損失,不能充分反映保水性趨勢的變化。除此之外,成熟過程中正常牛肉肌細胞的腫脹伴隨著細胞破裂,使水分更容易溢出,因此牛肉保水性降低。
2.3 不同極限pH值牛肉成熟過程中橫向弛豫特性變化
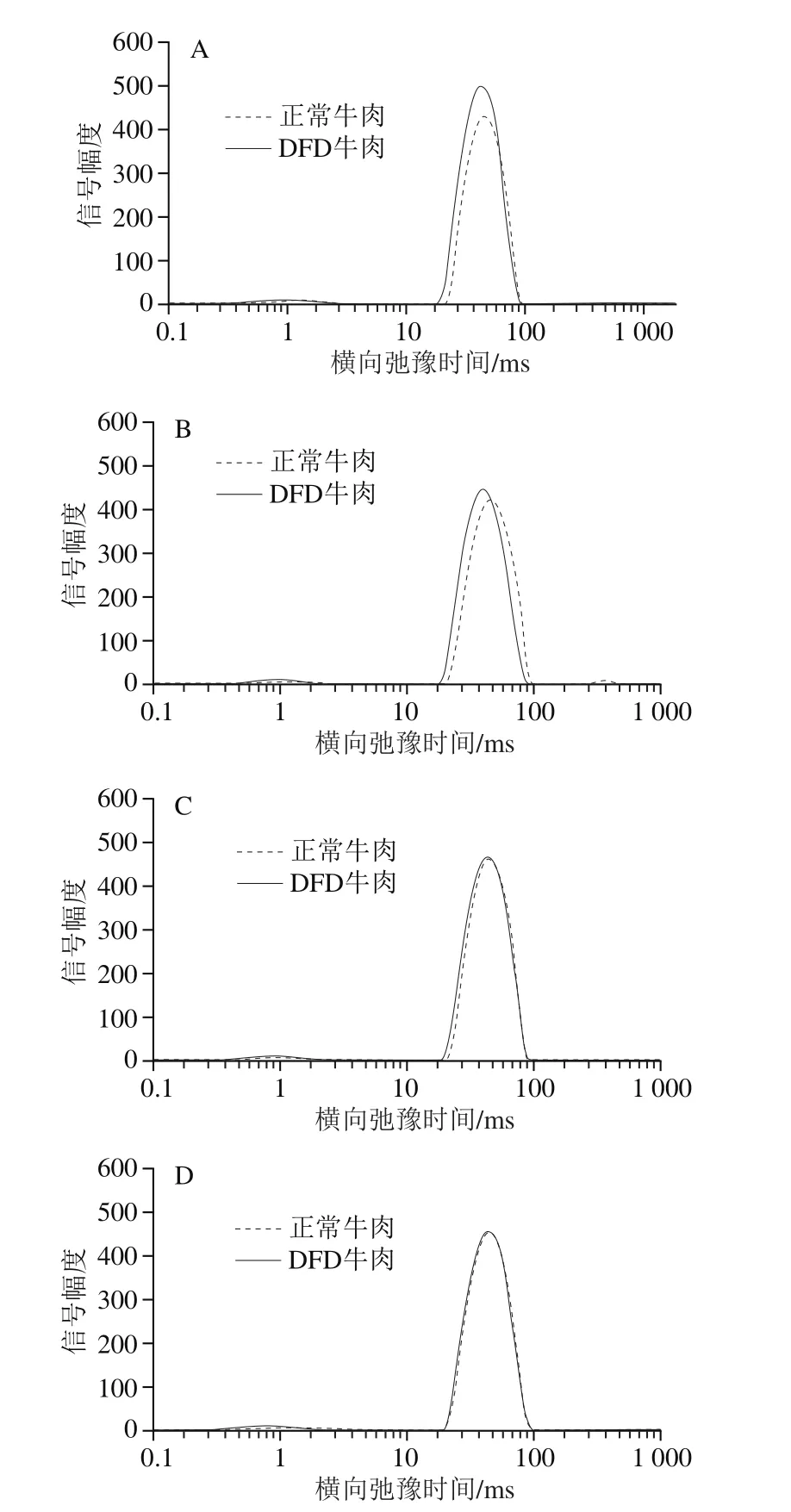
圖1 成熟過程中正常與DFD牛肉橫向弛豫特性變化Fig. 1 Transverse relaxation characteristics of normal and DFD beef during postmortem aging
圖1展示了不同成熟時間的正常牛肉與DFD牛肉弛豫特性的變化。由表3可知,T2b代表結合水的自由度,其中pH值對T2b具有主效應,在成熟過程中不同極限pH值牛肉T2b均無顯著變化,這主要是由于結合水與蛋白質緊密結合,不易受外界環境的影響[14]。但是DFD牛肉的平均T2b顯著低于正常牛肉(P<0.05),Bertram等[15]在通過LF-NMR測定不同pH值肌原纖維蛋白也得到同樣結果。反映不易流動水自由度的T21則受pH值和成熟時間交互作用的影響,在DFD牛肉組中,T21在成熟過程中并無顯著變化,但正常牛肉的T21則隨著成熟時間的延長逐漸降低,其原因可能是肉中自由度比較高的那部分不易流動水在成熟過程中逐漸轉變為貯藏損失,而剩余的那部分不易流動水自由度較低。反映自由水自由度的T22受pH值主效應的影響,且隨著成熟的進行逐漸延長,這說明肉中自由水在成熟過程中越來越活躍,因此更容易散失。且在本實驗中,隨著成熟的進行,除個別時間點外,DFD牛肉的T2b、T21、T22始終低于正常牛肉,這意味著DFD牛肉各部分水分活躍度更低,這可能是DFD牛肉保水性較好的原因。

表3 成熟過程中正常和DFD牛肉橫向弛豫時間T2變化Table 3 Transverse relaxation time T2 of normal and DFD beef during postmortem aging
弛豫峰面積比P2代表著不同狀態水分占總水分含量的比例,本實驗中pH值和成熟時間對P2b、P21、P22均具有交互作用。其中P2b代表著結合水的相對含量,由于外力條件無法改變結合水與蛋白質分子緊密結合的狀態;因此,在探究肉的保水性時,通常不考慮結合水的變化對保水性的影響。但在本研究中,DFD牛肉中的結合水不但具有較低的自由度,其相對含量也顯著高于正常牛肉(P<0.05)(表4),這可能是DFD牛肉具有較好保水性卻表面干燥的原因。相應地,成熟過程中DFD牛肉中不易流動水的相對含量(P21)始終略低于正常牛肉。P22則是代表自由水的相對含量,成熟過程中DFD牛肉的自由水相對含量不穩定,成熟7 d的正常牛肉中的自由水相對含量顯著上升(P<0.05),隨后下降;許倩等[16]在冰溫條件下真空貯藏的牛肉中也發現在貯藏1~5 d內自由水相對含量上升的類似趨勢,其原因可能是成熟初期肌肉完全解僵水分自由度提高,其他狀態的水分轉化為自由水。但是在本實驗中,LF-NMR測定的自由水相對含量比文獻[16]的研究結果相對較低,其原因可能是樣品在從工廠到實驗室的運輸過程中,已經損失了部分汁液,這部分汁液損失主要來自于自由水。
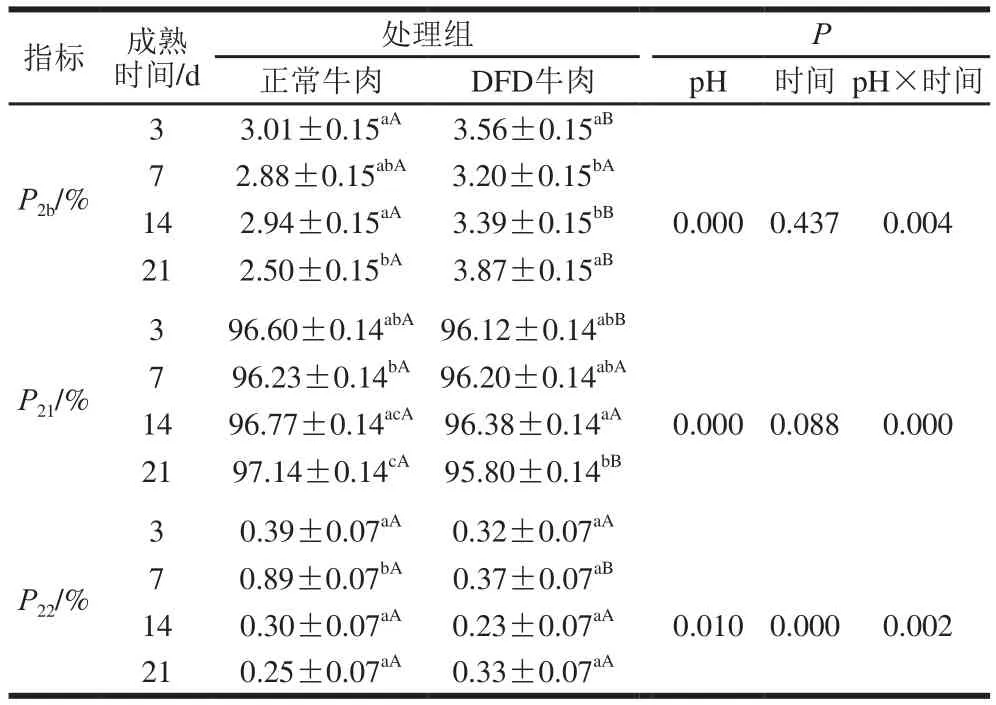
表4 成熟過程中正常和DFD牛肉弛豫峰面積比P2變化Table 4 Change in relaxation peak area ratio in normal and DFD beef during postmortem aging

圖2 成熟過程中正常和DFD牛肉LF-NNR圖Fig. 2 LF-NNR images of normal and DFD beef during postmortem aging
圖2是通過LF-NMR成像技術獲得的正常牛肉與DFD牛肉在成熟3、7、14 d和21 d所取樣品的質子密度加權圖像。圖像亮度越高,說明肉樣中氫質子密度越高,即水分含量更高[17]。相比正常牛肉,DFD牛肉的核磁成像亮度更高,說明DFD牛肉中有較高的水分含量。但在成熟過程中,不同pH值組的牛肉核磁圖像亮度變化不大。甄少波等[3]研究則表明宰后24 h內隨著成熟時間的延長,豬肉核磁圖像的亮度逐漸提高。另外,正常牛肉從成熟7 d開始,肉中出現明顯的亮帶并持續到成熟21 d,已有研究表明,這些亮帶主要由結締組織、脂肪和水構成,且與汁液損失通道的形成有關[18]。
2.4 不同極限pH值牛肉成熟過程中肌節長度變化

表5 成熟過程中正常和DFD牛肉肌節長度變化Table 5 Changes in sarcomere length of normal and DFD beef during postmortem aging
肌節的收縮狀態影響著肌球蛋白與肌動蛋白之間儲水空間的大小,受到pH值、肌纖維長度、離子強度、滲透壓以及尸僵的影響[19]。有研究認為肌節長度越短,肌肉的保水性越低。主要原因是較短肌節導致肌動球蛋白橫橋增多,會增加肌纖維的橫向拉力,縮小肌原纖維內的儲水空間[19]。但由表5可知,本研究中牛肉肌節長度的變化受pH值主效應的影響,在成熟過程中,DFD牛肉的平均肌節長度為1.47 μm,顯著短于正常牛肉的1.91 μm(P<0.05)。祝超智[20]和侯旭[21]等在不同保水性的雞肉和牛肉中也得到了同樣結果。其原因一方面是,雖然DFD牛肉肌節橫向收縮,但粗細絲之間的縱向空間擴張,肌細胞中儲水空間變化對保水性影響較小[22];另一方面,DFD牛肉肌節的收縮阻礙了蛋白水解酶與肌原纖維的接觸,減緩了肌原纖維蛋白的降解[23],DFD牛肉較高的肌原纖維完整性有利于將水分保持在肉的組織內,提高了保水性。祝超智等[20]的研究同樣表明高汁液損失的雞肉其肌球蛋白更容易變性。且DFD牛肉與正常牛肉主要是水分自由度的差異,因而DFD牛肉相比于正常牛肉肌節較短,但保水性較好。
2.5 不同極限pH值牛肉成熟過程中細胞外空間面積比變化
細胞外空間所占肌肉橫截面的比例反映肌細胞的收縮腫脹狀態,并影響肉中水分的遷移變化,Bertram等[24]研究表明,隨著成熟時間的延長,豬肉內肌細胞逐漸發生腫脹。本實驗中,牛肉細胞外空間面積受pH值和成熟時間交互作用的影響,由圖3、4可知,成熟初期的DFD牛肉與正常牛肉的細胞外空間面積比差異不顯著,但在成熟14 d后,正常牛肉肌細胞發生明顯的腫脹,使得細胞間隙減小;而DFD牛肉在整個成熟過程中細胞外空間無顯著性差異。細胞膜的完整程度對肌肉的保水性有重要影響[14],DFD牛肉宰后pH值下降速度慢,宰后初期細胞膜更加完整[24],且較短的肌節能夠降低蛋白水解的速率[13],因此DFD牛肉具有更好的保水性。另外,DFD牛肉的pH值更多地偏離肌球蛋白等電點5.1,較高的靜電斥力使得纖維結構疏松,并且大量水分起到“增塑劑”的作用[12],使肌肉結構更加穩固,因而DFD牛肉的肌細胞在成熟過程中始終保持良好的形態,減少了水分的散失,這與顯微照片呈現的結果一致。

圖3 成熟過程中正常和DFD牛肉細胞外空間面積比變化Fig. 3 Changes in the percentage of extracellular space in normal and DFD beef during postmortem aging

圖4 成熟過程中正常和DFD牛肉顯微照片Fig. 4 Images of normal and DFD beef during postmortem aging
2.6 相關性分析結果
表6顯示的是不同極限pH值牛肉保水性與橫向弛豫特性、組織學指標之間的相關性。衡量保水性的總水分損失率與pH值呈極顯著負相關(r=-0.888,P<0.01),與T2b、T21、P21呈極顯著正相關(P<0.01),相關系數分別為0.402、0.531、0.568,與T2b呈極顯著正相關(r=0.402,P<0.01),這說明橫向弛豫特性與傳統方式測定的保水性具有良好的相關性,因此有學者通過橫向弛豫特性對肉品保水性進行檢測或預測[25-26]。
pH值與T2b、T21呈極顯著負相關(P<0.01),相關系數分別為-0.469、-0.624,這可能是較高的pH值使肉中主要蛋白質偏離等電點,增強了對水分子的束縛,降低了水分自由度,提高了肉的保水性[27]。另外,pH值與肌節長度呈極顯著負相關(r=-0.699,P<0.01),通常認為肌節長度與剪切力呈負相關關系[28],但肌肉pH值與肌節長度的關系還缺乏相關研究。
肌節作為肌肉組織的最小收縮單位,其收縮狀態會對保水性產生影響。本實驗中肌節長度與總水分損失率呈現極顯著正相關(r=0.671,P<0.01),肌節長度與P21、T21呈極顯著正相關(P<0.01),說明雖然較短的肌節長度可能使DFD牛肉中不易流動水的相對含量降低,但同時也降低了其自由度,Bertram等[29]的研究同樣表明肌節長度與T2有良好的相關性。依據相關性分析,較短的肌節可能會加強對肌絲內部水分的束縛,降低水分的自由度,并在烹飪過程中減少肌肉的收縮,減少水分散失。
細胞外空間面積比與總水分損失率呈現極顯著負相關(r=-0.503,P<0.01),通常認為成熟后期隨著肌細胞腫脹,細胞外空間縮小,生鮮肉的保水性提高。Huff-Lonergan等[27]曾針對該理論提出需要更多的研究來證實肌肉細胞腫脹是否伴隨著個體肌細胞的分解,是否與特定的纖維類型有關。本實驗通過顯微觀察發現正常牛肉肌細胞腫脹的同時確實發生了裂解。

表6 成熟過程中不同極限pH值牛肉水分變化與組織學指標相關性分析Table 6 Correlation coefficients between moisture variation and histological indexes of normal and DFD beef during postmortem aging
3 結 論
成熟過程中DFD牛肉與正常牛肉保水性均呈逐漸下降趨勢,且DFD牛肉保水性顯著高于正常牛肉。相比于正常牛肉,成熟過程中DFD牛肉中結合水、不易流動水和結合水自由度較低,且DFD牛肉中的結合水相對含量更高,這可能是DFD牛肉雖然保水性好但表面干燥的原因。此外,DFD牛肉肌節較短,可能因此降低了其不易流動水的相對含量,但肌節內狹窄的儲水空間降低了肉中水分的自由度,并因此提高保水性。在成熟過程中,正常牛肉肌細胞逐漸發生腫脹,細胞外空間比下降但并未提高其保水性,可能是成熟過程中正常牛肉細胞破裂嚴重,而DFD牛肉肌細胞則仍保持良好形態,因此產生保水性差異。

