加熱溫度對麻鴨肌原纖維蛋白結構與凝膠特性的影響
王正雯,田宏偉,周富裕,張志芳,何 俊,孫楊贏,曹錦軒,潘道東,*
(1.寧波大學 浙江省動物蛋白食品精深加工技術重點實驗室,浙江 寧波 315800;2.寧波大學食品與藥學學院,浙江 寧波 315800;3.湖北周黑鴨企業發展有限公司,湖北 武漢 430040)
骨骼肌蛋白主要包括肌原纖維蛋白和肌漿蛋白[1],其中肌原纖維蛋白占總蛋白質量分數的52%~56%[2],是肌肉蛋白的重要組成部分。肌原纖維蛋白是一種動態蛋白復合體系,其中不同蛋白的相互作用為蛋白復合物和肌肉結構提供穩定性[3]。肌原纖維蛋白具有良好的凝膠能力和水結合能力,加熱可誘導形成凝膠[4]。熱凝膠化過程涉及蛋白受熱變性展開,包括蛋白的構象變化、疏水相互作用以及氫鍵、二硫鍵等相互作用,隨后蛋白之間發生聚集,形成有序的三維網狀結構[5-6],因此溫度是肌纖維蛋白凝膠特性的最重要影響因素之一。凝膠性能會直接影響肉制品的嫩度、咀嚼性、保水性和顏色等品質,這些變化最終決定了產品的品質和口感。柔軟多汁的質地是影響消費者對熟肉制品選擇和接受的主要因素[7],因此肉類加工業的目標是在確保并增強理想感官屬性的同時,改進加工工藝生產安全的消費產品[8]。
肌肉的來源和類型也影響其凝膠特性。目前,肌原纖維蛋白的熱凝膠特性也已在不同物種中被廣泛研究,包括雞、牛、豬、兔、火雞、魚類、蝦類和魷魚[5],盡管大多數肉類產品具有相似的蛋白組分,但肌原纖維蛋白的膠凝特性卻有所不同,而關于鴨肉肌原纖維蛋白凝膠特性尚需進行深入研究。麻鴨品種優良,具有肉質細嫩、味道鮮美的特點,其蛋白含量高于雞肉、羊肉等禽畜肉,宜加工為既營養又易于消化吸收的鴨肉制品,具有廣闊的發展前景。因此,研究不同加熱溫度對麻鴨肌原纖維蛋白凝膠特性及其結構的影響,闡明二者變化之間的內在聯系,有助于優化麻鴨肌原纖維蛋白凝膠工藝條件、補充和完善麻鴨肌原纖維蛋白凝膠理論。
本實驗以麻鴨胸脯肉為研究材料,利用拉曼光譜、質構分析儀、掃描電子顯微鏡等研究不同加熱溫度下肌原纖維蛋白二級結構、凝膠質構特性和微觀結構的變化;探討加熱溫度對麻鴨肌原纖維蛋白二級結構和凝膠特性的影響,并分析蛋白結構與凝膠特性之間相關性,以期為拓展鴨肉制品的工業應用提供理論依據。
1 材料與方法
1.1 材料與試劑
麻鴨 浙江省寧波市鎮海江南家禽育種有限責任公司;戊二醛、乙醇、叔丁醇等(均為分析純) 國藥集團化學試劑有限公司。
1.2 儀器與設備
TA-XT2i質構分析儀 英國Stable Micro Systems公司;inVia-Reflex拉曼光譜儀 法國Renishaw公司;Allerga高速冷凍離心機 貝克曼庫爾特有限公司;M200全波長酶標儀 瑞士Tecan公司;S3400N掃描電子顯微鏡 日本日立公司。
1.3 方法
1.3.1 原料預處理
選取360 日齡、體質量2 kg麻鴨,于當地屠宰場宰后,放血、去毛,取鴨胸脯肉,剔除可見脂肪和結締組織后切碎,真空包裝于-40 ℃冰箱存放。
1.3.2 肌原纖維蛋白的提取
參照曹錦軒等[9]的方法,并作適當修改。取2 g樣品剪碎加入到15 mL的焦磷酸鹽飽和緩沖液(含100 mmol/L KCl、2 mmol/L MgCl2、2 mmol/L乙二胺四乙酸二鈉、1 mmol/L二硫蘇糖醇、2 mmol/L Na4P2O7、10 mmol/L馬來酸,pH 6.8)中,10 000 r/min勻漿30 s,每10 s間歇1 次。勻漿液于1 000×g冷凍離心10 min收集沉淀。將沉淀物重新分散于15 mL肌原纖維蛋白提取液(含100 mmol/L KCl、2 mmol/L MgCl2、2 mmol/L乙二胺四乙酸二鈉、1 mmol/L二硫蘇糖醇、10 mmol/L馬來酸,pH 6.8)中,再次以1 000×g冷凍離心10 min收集沉淀,重復3 次。將多次提取所得沉淀用15 mmol/L pH 8.0的Tris-HCl緩沖液洗滌3 次,用紗布過濾即得純化的肌原纖維蛋白。蛋白質量濃度采用雙縮脲法測定,用牛血清白蛋白作蛋白質量濃度標準曲線,測得所提取肌原纖維蛋白質量濃度為5.29 mg/mL,并將其置于4 ℃保存,48 h內用于制備蛋白凝膠。
1.3.3 肌原纖維蛋白熱誘導凝膠的制備
用pH 7.0、30 mmol/L Na2HPO4緩沖液(含0.6 mol/L NaCl)將蛋白質量濃度調至40 mg/mL,加入到25 mm×25 mm稱量瓶中,水浴加熱,從25 ℃分別線性升溫到50、60、70、80、90、100 ℃,保溫30 min,隨后取出冰浴30 min,4 ℃靜置過夜。
1.3.4 肌原纖維蛋白凝膠保水性測定
參照Kocher等[10]的方法,肌原纖維蛋白形成熱誘導凝膠后,8 000 r/min條件下冷凍離心10 min。保水性按式(1)計算。
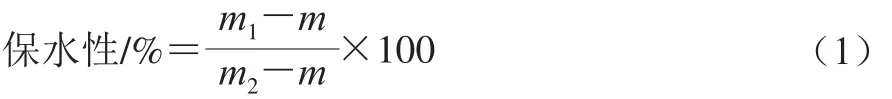
式中:m1為離心后試管與凝膠總質量/g;m2為離心前試管和凝膠總質量/g;m為離心管質量/g。
1.3.5 肌原纖維蛋白凝膠質構分析
參照Dondero等[11]的方法略作改動,采用質構分析儀測定肌原纖維蛋白熱誘導凝膠硬度、黏性、彈性。參數設置為:測試探頭P/5、測前速率l.0 mm/s、測試速率l.0 mm/s、穿刺距離3 mm、感應力5 g、停留時間5 s。
1.3.6 掃描電子顯微鏡觀察肌原纖維蛋白凝膠微觀結構
參照Nishimura等[12]的方法制備觀察所用樣品,將制備好的蛋白凝膠切成0.5 cm×0.4 cm×0.3 cm的長方體,用體積分數2.5%戊二醛固定2 d后,用磷酸鹽緩沖液(pH 7.2)清洗3 次,每次20 min;依次用體積分數為50%、60%、70%、80%、90%的乙醇溶液梯度洗脫各20 min,再用無水乙醇洗脫3 次,每次30 min;最后用叔丁醇置換3 次,每次30 min;將置換后樣品冷凍干燥,噴金,用掃描電子顯微鏡在15.0 kV電壓下放大1 000 倍觀察蛋白凝膠的微觀結構變化。
1.3.7 肌原纖維蛋白表面疏水性的測定
參考Chelh等[13]的方法,用15 mmol/L Tris-HCl緩沖液配制質量濃度10 mg/mL肌原纖維蛋白溶液。取1 mL蛋白溶液加入40 μL 1 mg/mL的溴酚藍溶液,漩渦混勻,冷凍離心20 min。取上清液,于595 nm波長處測定樣品溶液光密度值(OD595nm)。空白對照用15 mmol/L的Tris-HCl緩沖溶液代替蛋白溶液。表面疏水性以溴酚藍結合量表示,按式(2)計算。

式中:OD0為空白對照組溶液OD595nm;OD為樣品溶液OD595nm。
1.3.8 肌原纖維蛋白凝膠的拉曼光譜分析
用20 倍長聚焦鏡頭將激光聚焦于載玻片上冷凍干燥后的肌原纖維蛋白凝膠樣品。具體條件為:532 nm氬離子激光器,功率12 mW,分辨率1 cm-1,每個樣品掃描10 次,掃描范圍500~4 000 cm-1。用Labspcc軟件對光譜進行基線校正去除熒光背景,以苯丙氨酸的單基取代苯基環在1 003 cm-1處的伸縮振動強度作為內標進行歸一化。用Peakfit軟件對拉曼光譜進行傅里葉去卷積處理,用Origin 2017軟件繪制圖譜。參考Alix等[14]的方法計算肌原纖維蛋白二級結構相對含量。
1.4 數據處理及分析
本實驗每個數據處理設5 個重復,采用SAS 8.01軟件進行單因素方差分析,并用Duncan multiple-range test進行多重比較,當P<0.05時為差異顯著。
2 結果與分析
2.1 加熱溫度對麻鴨肌原纖維蛋白凝膠特性的影響
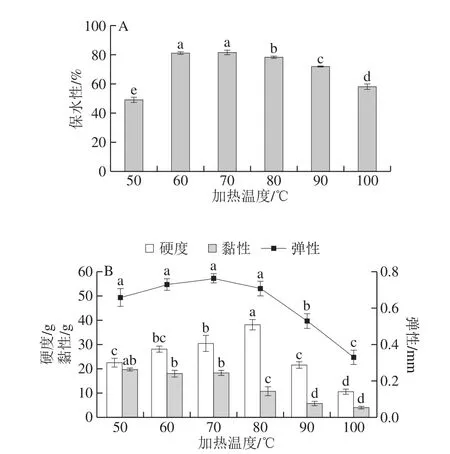
圖1 加熱溫度對麻鴨肌原纖維蛋白凝膠特性的影響Fig. 1 Effect of heating temperature on sheldrake myofibrillar protein gel properties
如圖1A所示,麻鴨肌原纖維蛋白凝膠保水性隨加熱溫度的升高呈先上升后下降趨勢。加熱溫度為50 ℃時保水性最低,由于肌球蛋白變性溫度至少為68 ℃[15],肌球蛋白重鏈及頭部尚未形成凝膠結構[16]。加熱溫度為60~70 ℃時,肌球蛋白發生尾-尾聚集,初步形成凝膠,保水性顯著升高(P<0.05),于70 ℃時達到最大,表明肌球蛋白尾部相互結合已完成,形成有序的三維網狀結構[16]鎖住水分,從而提高了凝膠保水性。加熱溫度進一步升高,麻鴨肌原纖維蛋白凝膠三維網狀結構遭到破壞,肌纖維變性收縮失水,凝膠保水性迅速降低,此結果與不同加熱溫度下雞肉和豬肉凝膠保水性的變化結果[17-18]相一致。
如圖1B所示,凝膠硬度在50~80 ℃范圍內逐漸增加,且在80 ℃時達到最大,隨后急劇降低。凝膠硬度與蛋白的變性程度有關,蛋白變性程度隨著加熱溫度的升高而加劇,暴露出更多的功能性基團,凝膠硬度隨之增大[19]。凝膠彈性于70 ℃達到最大值,有研究表明肌球蛋白尾部的結合程度與凝膠彈性相關[16],表明此時肌球蛋白尾-尾聚集完成,凝膠結構達到最佳狀態。蛋白凝膠的黏性隨著加熱溫度的升高,整體呈下降趨勢(P<0.05),說明加熱使得蛋白的變性行為加劇,其剛性變大而導致黏性降低。
2.2 加熱溫度對麻鴨肌原纖維蛋白表面疏水性的影響

圖2 加熱溫度對麻鴨肌原纖維蛋白表面疏水性的影響Fig. 2 Effect of heating temperature on surface hydrophobicity of sheldrake myofibrillar protein
疏水相互作用對蛋白構象結構穩定性以及蛋白的功能特性具有重要作用,它是維持蛋白質三級構象的主要作用力。如圖2所示,隨著加熱溫度的升高,麻鴨肌原纖維蛋白表面疏水性逐漸增強(P<0.05),在80 ℃時達到最大,隨后略有下降,但降幅不顯著。熱處理會改變肌原纖維蛋白部分疏水氨基酸的暴露狀態,導致其表面疏水性改變,而疏水相互作用是蛋白間的主要作用力,疏水基團暴露程度的增加可導致凝膠形成硬質結構[19],使得凝膠硬度與蛋白表面疏水性變化趨勢一致[20]。
2.3 不同加熱溫度下麻鴨肌原纖維蛋白凝膠的超微結構

圖3 不同加熱溫度對麻鴨肌原纖維蛋白凝膠微觀結構的影響Fig. 3 Effect of heating temperature on microstructure of sheldrake myofibrillar protein gel
由圖3可知,50 ℃時麻鴨肌原纖維蛋白凝膠尚未形成,蛋白結構分散;60 ℃形成的蛋白凝膠孔徑均勻一致但較為松軟,交聯不緊密;70 ℃時蛋白充分變性并完成交聯,形成緊湊細膩的三維網絡結構;隨著加熱溫度進一步升高,蛋白過度變性,凝膠結構逐漸被破壞,凝膠孔徑變大甚至發生斷裂,出現分離的片狀結構。Warner等[21]研究結果表明,隨著溫度升高,肌原纖維蛋白凝膠超微結構可產生肉眼可分辨的收縮變化。從凝膠微觀結構與其保水性的變化趨勢可以推測,肌原纖維蛋白凝膠保水性與其孔徑呈負相關。
2.4 不同加熱溫度下麻鴨肌原纖維蛋白凝膠的拉曼光譜分析結果
通過分析蛋白拉曼光譜圖中特征峰的峰位置、相對強度以及峰面積,可分析得到蛋白凝膠結構的變化。通過與文獻[22-23]比對,可對肽鍵骨架振動和氨基酸側鏈光譜條帶進行指認,麻鴨肌原纖維蛋白凝膠拉曼光譜中譜帶的歸屬如表1所示。
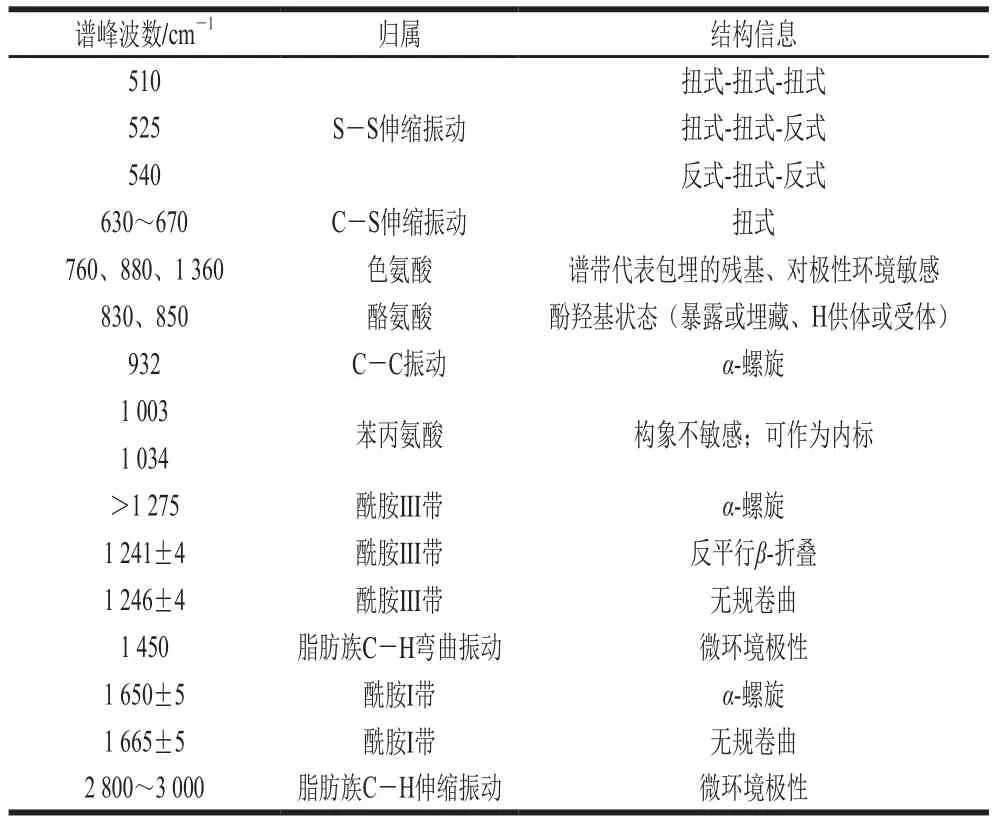
表1 麻鴨肌原纖維蛋白凝膠拉曼光譜中譜帶的歸屬Table 1 Tentative assignment of selected bands in the Raman spectra of sheldrake myofibrillar protein gel
2.4.1 熱誘導凝膠過程中麻鴨肌原纖維蛋白二級結構的變化
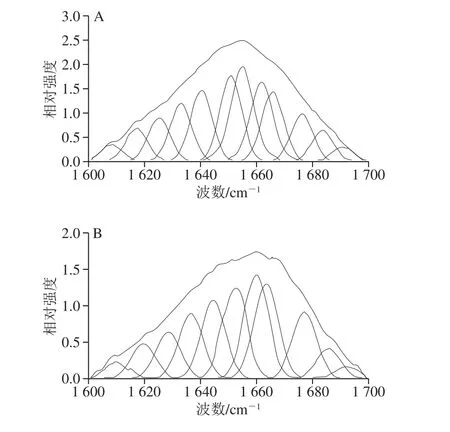
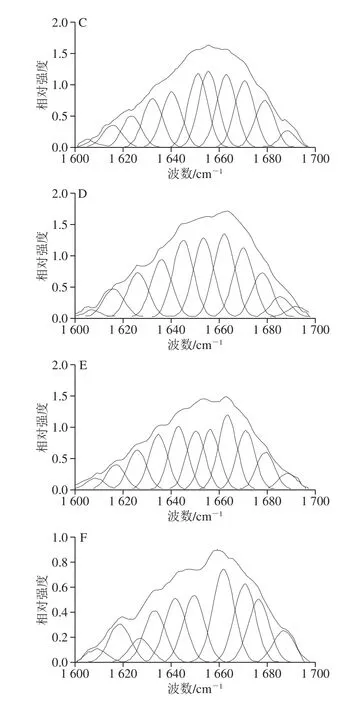
圖4 不同加熱溫度下麻鴨肌原纖維蛋白酰胺I帶拉曼光譜去卷積變化圖Fig. 4 Deconvolved and curve-fitted Raman bands of amide I of sheldrake myofibrillar protein gels obtained at different heating temperatures
對麻鴨肌原纖維蛋白在1 600~1 700 cm-1范圍內的拉曼光譜進行去卷積和曲線擬合,如圖4所示。以1 655 cm-1為中心最突出的波段(主導峰)歸屬于酰胺I帶的振動,其主要涉及C=O拉伸,其余低相對強度波譜主要涉及肽基團的C-N平面伸縮振動、Cα-C-N彎曲振動和N-H平面內彎曲振動。這些條帶的確切位置取決于多肽鏈的二級結構,因此,可用于預測蛋白質的二級結構[14]。酰胺I帶中α-螺旋含量高的峰集中在1 650~1 658 cm-1,β-折疊含量高的峰集中在1 665~1 680 cm-1,而無規卷曲與β-轉角的峰分別集中在1 660~1 665 cm-1和1 680 cm-1附近。50 ℃時,酰胺I帶主導峰出現在1 654 cm-1附近,隨著加熱溫度的升高,主導峰位置向高波數偏移;在100 ℃時,主導峰位置偏移至1 660 cm-1,表明α-螺旋逐漸展開,并向β-折疊、β-轉角和無規卷曲結構轉變。

圖5 不同加熱溫度下麻鴨肌原纖維蛋白二級結構相對含量的變化Fig. 5 Relative contents of secondary structures in sheldrake myofibrillar protein at different heating temperatures
酰胺I帶可直接定量蛋白二級結構的譜帶,因此對其進行去卷積并結合曲線擬合估算麻鴨肌原纖維蛋白中二級結構的相對含量[14]。如圖5所示,50 ℃時α-螺旋相對含量高達66.95%,β-折疊相對含量為14.27%;70 ℃時,α-螺旋相對含量顯著降低(P<0.05),β-折疊相對含量增加。研究表明α-螺旋含量的降低和β-折疊含量的增加是半透明類型蛋白凝膠的共同特征[24]。Zhuang Xinbo等[25]提出肌原纖維蛋白溶液熱誘導凝膠化過程中,蛋白分子通過疏水基團交聯聚集形成三維網絡結構,過程中伴隨著α-螺旋逐漸展開并轉變成為β-折疊和β-轉角。在100 ℃時,α-螺旋相對含量降低至19.73%,無規卷曲相對含量高達43.81%(P<0.05),表明凝膠結構已逐漸被破壞。Yuan Li等[26]發現類似結果,從50 ℃加熱到90 ℃過程中,鳙魚肌球蛋白的α-螺旋相對含量從75.27%降低至16.74%,且90 ℃下形成的肌球蛋白凝膠呈較不規則孔狀結構。
2.4.2 熱誘導凝膠過程中麻鴨肌原纖維蛋白色氨酸和酪氨酸殘基微環境的變化
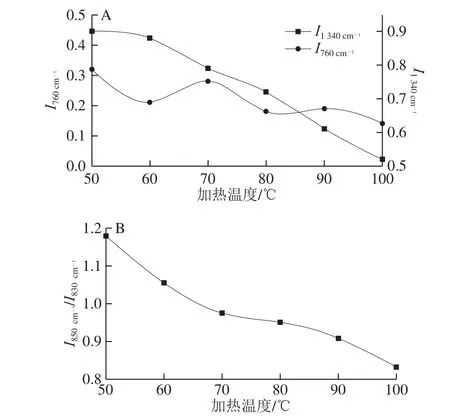
圖6 不同加熱溫度對麻鴨肌原纖維蛋白微環境的影響Fig. 6 Effects of different heating temperatures on microenvironment of sheldrake myofibrillar protein
拉曼光譜在760 cm-1()和1 340 cm-1處譜帶相對強度()可用于表征色氨酸殘基的微環境變化,即色氨酸殘基從包埋的疏水環境暴露于極性環境中時,指代譜帶相對強度會降低[22]。由圖6A可知,及總體均隨著加熱溫度的升高呈下降趨勢,說明掩埋于疏水微環境中的色氨酸殘基從包埋態逐漸暴露于極性水溶劑中[24]。熱誘導溫度由50 ℃升至60 ℃時,由于色氨酸殘基環的伸縮振動,明顯降低,證明初始階段麻鴨肌原纖維蛋白表面疏水微環境暴露于極性水溶液中,參與熱誘導凝膠化過程。當加熱溫度達70 ℃時,有所升高,表明加熱到70 ℃有效暴露了蛋白的疏水基團[27]。
830 cm-1和850 cm-1附近的雙峰帶是由酪氨酸費米共振引起的,二者的相對強度比值()可用于監測酪氨酰殘基附近的微環境變化[24]。在0.7~1.0之間時,酪氨酸殘基包埋在蛋白分子內部;當大于1時,酪氨酸殘基暴露于蛋白表面。如圖6B所示,隨著加熱溫度的升高,逐漸減小。50 ℃時為1.17,大于1;100 ℃時為0.838,小于1,說明麻鴨肌原纖維蛋白凝膠化后酪氨酸殘基從暴露態轉變為包埋態,這是由蛋白表面疏水作用導致的[28]。
2.4.3 熱誘導凝膠過程中麻鴨肌原纖維蛋白二硫鍵構象的變化
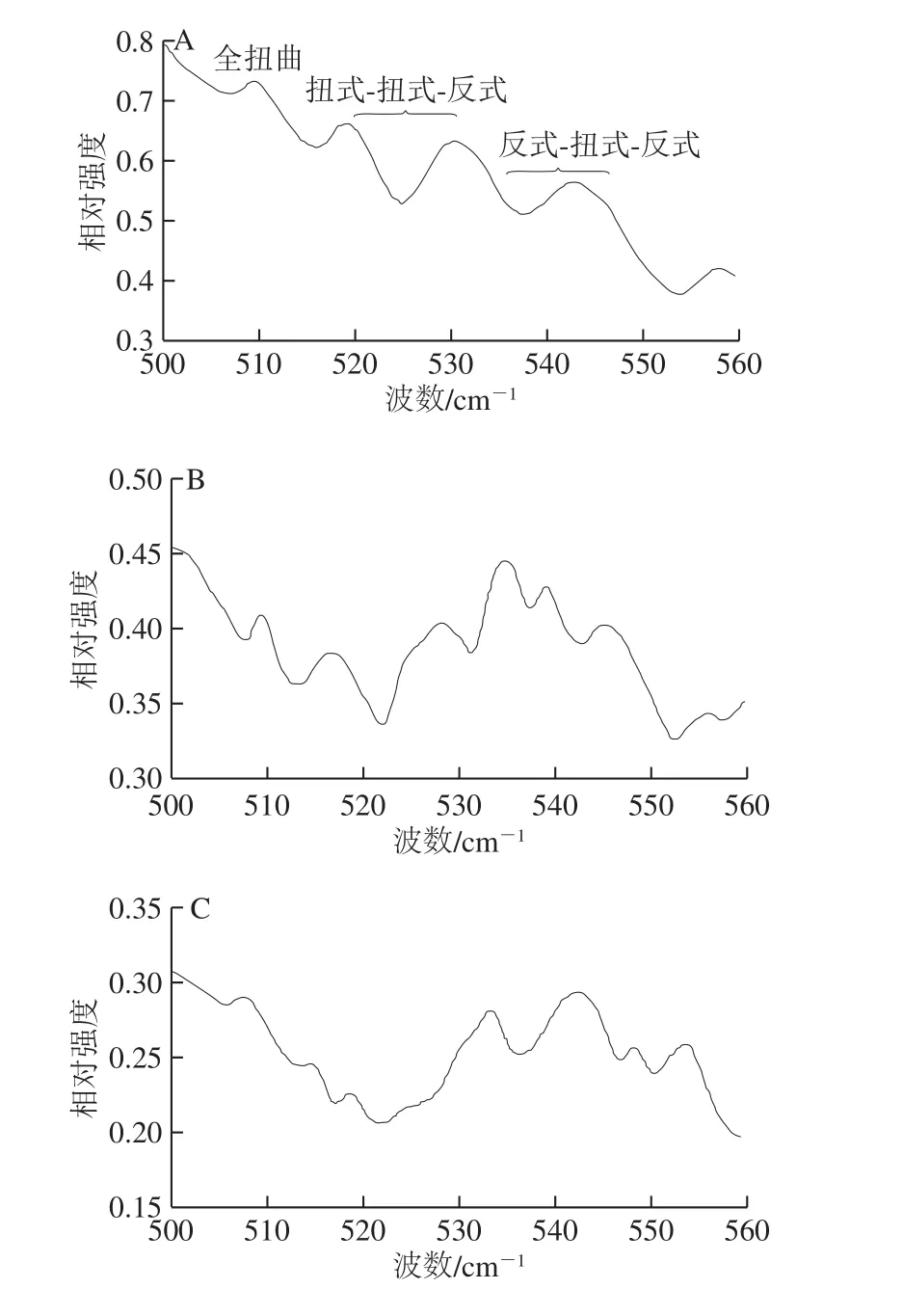
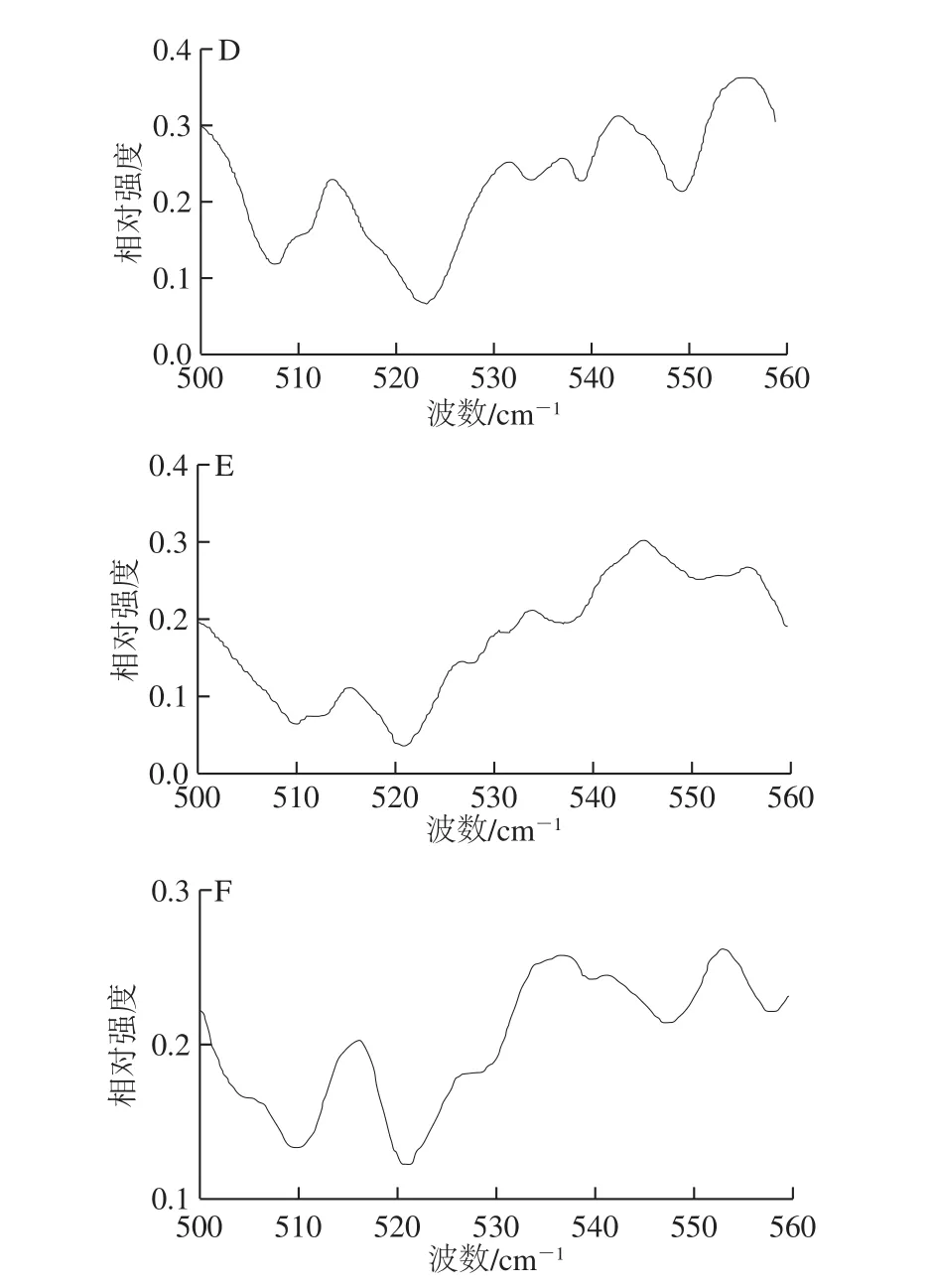
圖7 不同加熱溫度下麻鴨肌原纖維蛋白二硫鍵構象的變化Fig. 7 Effects of different heating temperatures on the conformation of disulfide bonds in sheldrake myofibrillar protein
拉曼光譜中二硫鍵譜帶位于500~550 cm-1處,其中位于510 cm-1處的譜帶歸屬于含有胱氨酸殘基的天然蛋白全扭曲構象。由圖7可知,隨著加熱溫度的升高,全扭曲構象譜帶相對強度逐漸減弱,80 ℃時510 cm-1峰幾乎消失,可能是S-S拉伸振動減小所致,這與Nonaka等[28]指出熱誘導凝膠過程中乳清蛋白在508 cm-1附近譜帶相對強度降低的結果相同。516~530 cm-1和535~545 cm-1處的譜帶分別歸屬于二硫鍵扭式-扭式-反式和反式-扭式-反式構象[24]。50 ℃時,二硫鍵的3 種構象均存在,其中全扭曲構象峰相對強度最強,扭式-扭式-反式其次,反式-扭式-反式相對較弱。綜上,二硫鍵的3 種構象均隨著溫度的升高不同程度地減少,說明二硫鍵在熱誘導凝膠過程中遭受破壞的同時,也伴隨著3 種構象間的相互轉化。
2.4.4 熱誘導凝膠過程中麻鴨肌原纖維蛋白脂肪族C-H的伸縮振動變化
2 930 cm-1附近出現的明顯譜帶是由-CH2-和-CH3的不對稱性振動引起的[29]。如圖8所示,隨著加熱溫度的升高,2 930 cm-1附近的特征峰向高波數方向遷移,50 ℃時位于2 934 cm-1處,而在100 ℃時偏移至2 940 cm-1,這是由于蛋白在解折疊過程,甲基或亞甲基基團暴露,導致拉曼光譜向高波數方向偏移[30]。Careche等[24]發現冷藏后肌球蛋白在2 933 cm-1處的特征峰會向高波數方向移動,并認為是由脂肪族氨基酸基團的暴露所導致的。本實驗中隨著加熱溫度的升高,2 933 cm-1處的特征峰強度呈先下降后上升的趨勢。70 ℃時,峰強度明顯增大,這可能是氫鍵和疏水相互作用導致的。Bouraoui等[30]研究結果表明,與生魚糜相比,蒸煮魚糜中2 930 cm-1處特征譜峰略微向高波數遷移,且此區域特征譜峰相對強度先有所減小,但隨著加熱溫度進一步升高,碳氫化合物鏈周圍環境的極性增強,峰強度又明顯增大。因此,由以上結果可以推斷,2 900~3 000 cm-1區域內譜峰位置遷移和強度變化取決于脂肪族C-H基團的微環境變化,還可能與疏水相互作用有關。
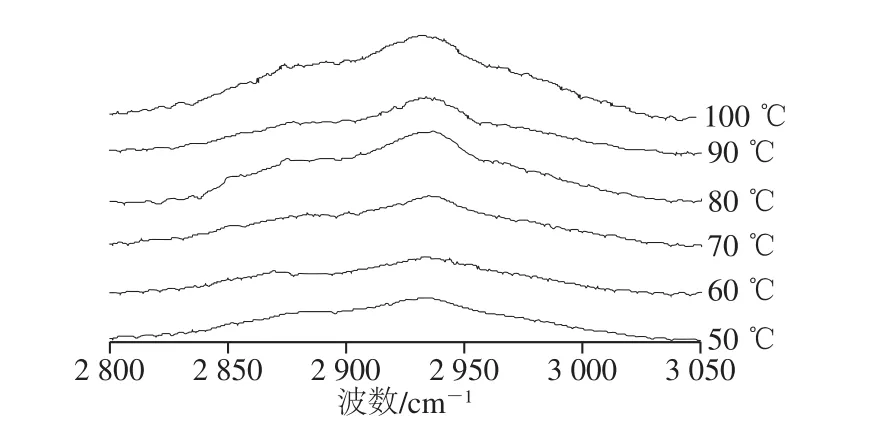
圖8 不同加熱溫度對麻鴨肌原纖維蛋白脂肪族C-H伸縮振動的影響Fig. 8 Effects of different heating temperatures on the C-H stretch vibration of sheldrake myofibrillar protein
2.5 加熱溫度、麻鴨肌原纖維蛋白結構及其凝膠特性間的相關性
對加熱溫度、麻鴨肌原纖維蛋白二級結構相對含量及特征峰相對強度、熱誘導凝膠特性進行相關性分析。由表2可知,加熱溫度與α-螺旋相對含量呈極顯著負相關(r=-0.990,P<0.01),而與無規卷曲相對含量呈極顯著正相關(r=0.961,P<0.01),其中α-螺旋與無規卷曲相對含量呈極顯著負相關(r=-0.930,P<0.01),說明隨著加熱溫度的升高,肌原纖維蛋白發生變性、結構展開,二級結構發生改變,α-螺旋結構向β-折疊、β-轉角及無規卷曲結構轉化,且最終幾乎全部轉化為無規卷曲結構。表面疏水性與α-螺旋結構相對含量呈極顯著負相關(r=-0.918,P<0.01),說明蛋白解螺旋后,表面疏水性增強。由α-螺旋結構相對含量分別與(r=0.961,P<0.01)及(r=0.906,P<0.05)呈極顯著或顯著正相關可知,隨著蛋白二級結構展開,降低,色氨酸殘基逐漸暴露于極性環境,使得表面疏水性增強,酪氨酸殘基變為包埋態。麻鴨肌原纖維蛋白凝膠彈性與(r=0.890,P<0.05)及(r=0.835,P<0.05)均呈顯著正相關,表明加熱誘導蛋白變性對凝膠質構產生了明顯影響。凝膠保水性與凝膠黏性和硬度均呈顯著正相關,且黏性與彈性呈顯著正相關。由此可知,凝膠過程是一個蛋白變性和蛋白相互聚集形成三維網狀結構的動態過程,凝膠質構的變化伴隨著凝膠持水性的改變,蛋白結構決定著凝膠的特性且相互影響。
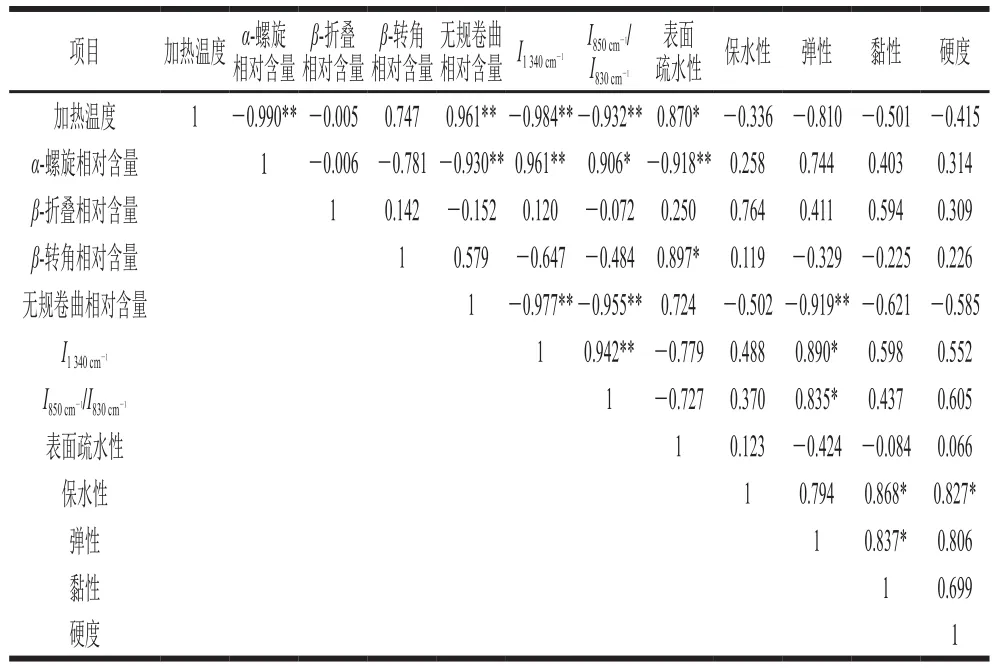
表2 加熱溫度、麻鴨肌原纖維蛋白結構及其凝膠特性之間的相關性Table 2 Correlation analysis of heating temperature, protein structures and heating-induced gel properties
3 結 論
在50~100 ℃加熱過程中,麻鴨肌原纖維蛋白結構展開,β-折疊相對含量升高,促進了凝膠的形成;在凝膠形成過程中,麻鴨肌原纖維蛋白疏水性氨基酸殘基暴露,導致蛋白表面疏水性增強;70 ℃是麻鴨肌原纖維蛋白凝膠形成的較佳溫度,此時α-螺旋相對含量降低,β-折疊、β-轉角、無規卷曲相對含量升高,蛋白形成孔徑均勻致密的三維網狀凝膠結構,且保水性最高;隨著加熱溫度的繼續升高,肌纖維直徑明顯收縮,導致凝膠結構被破壞,蛋白質無規卷曲相對含量顯著增加。

