原花青素對小鼠血脂代謝紊亂與腸道菌群干預的影響
楊昌銘,肖 瀛*,吳其國,尹志婷,周一鳴,周小理
(上海應用技術大學香料香精技術與工程學院,上海 201418)
隨著我國經濟水平的提高,居民飲食結構也發生了很大的變化,高脂膳食已成為目前大部分人的飲食習慣,由高脂膳食引起的血脂代謝紊亂成為普遍現象。脂質在維持人體內正常代謝平衡方面做出很大貢獻。血脂代謝紊亂與心腦血管、糖尿病、高血壓以及代謝綜合征等關系密切[1],有效控制血脂代謝紊亂,可改善人們的健康水平,提升幸福指數。
腸道菌群是指寄居在人體腸道內并長期與人體相互依存的各種微生物,它數量龐大、種類繁多,與人體細胞總數比例約為1∶1[2],其對維持人體生理功能具有非常重要的作用,還與許多免疫性疾病、代謝性疾病等都有著緊密的聯系[3-5]。高脂飲食會使腸道微生態發生改變[6],有研究報道高脂飲食在易肥胖鼠中造成腸桿菌增多,而在所有表型鼠中均可造成擬桿菌和梭菌目菌落的增多[7]。
原花青素是一種多酚類物質,它具有抗氧化性、降血脂和預防心血管疾病等活性[8]。原花青素的消化吸收主要發生在小腸部位,腸道菌群賴以生存的養料主要來自于未被小腸消化吸收的部分物質,原花青素及其代謝產物對腸道菌群有明顯影響,原花青素與腸道菌群的相互作用可能是原花青素發揮生物活性作用的重要原因。二代測序Illumina MiSeq是目前應用最多的技術,具有低成本、時間短、通量高等優點[9]。本研究采用Illumina高通量測序為主要技術手段,以食源性原花青素分布廣泛的二聚體B2為研究對象,探究原花青素B2干預高脂膳食模型小鼠血脂代謝紊亂及對腸道菌群結構的影響。
1 材料與方法
1.1 動物、材料與試劑
6 周齡SPF級(無特定病原體)雄性C57BL/6小鼠,體質量(16±1)g,購于上海靈暢生物科技公司,生產許可證號:SCXK(滬)2015-0014。
原花青素B2(純度≥80%) 上海同田生物技術股份有限公司;肝素鈉、無水硫酸鈉、無水乙醚、氯化鈉、濃硫酸(均為分析純) 國藥集團上海化學試劑有限公司;總膽固醇(total cholesterol,T-CHO)、甘油三酯(triglyceride,TG)、高密度脂蛋白膽固醇(highdensity lipoprotein cholesterol,HDL-C)、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)、脂蛋白脂酶、肝脂酶、總抗氧化能力(total antioxidant capacity,T-AOC)、總超氧化物歧化酶(total superoxide dismutase,T-SOD)、過氧化氫酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)測定試劑盒 南京建成生物工程研究所;Quant-iT PicoGreen dsDNA試劑盒美國Invitrogen公司;E.Z.N.A.?soil 試劑盒 美國Bio-Tek公司;DNA提取、純化和回收試劑盒 天根生化科技有限公司。
1.2 儀器與設備
AL204電子天平 梅特勒-托利多儀器(上海)有限公司;XW-80型混合器 海門其林貝爾儀器公司;K280R冷凍離心機 英國森特恩公司;TQ8040氣相色譜-質譜儀 日本島津公司;MiSeq PE300高通量測序平臺 美國Illumina公司。
1.3 方法
1.3.1 實驗分組與造模
小鼠以基礎飼料飼喂適應1 周后,根據體質量隨機分為對照組(A組:飼喂低脂低糖飼料,含有11%(質量分數,下同)脂肪、20%蛋白質和69%碳水化合物)、高脂組(B組:飼喂Paigen飼料,含有35%脂肪、20%蛋白質和45%碳水化合物)和原花青素B2組(C組:飼喂添加0.2%原花青素B2的Paigen飼料),每組7 只。小鼠自由飲食和飲水,相對濕度控制在(50±10)%,室溫(22±2)℃,12 h明暗交替,飼養時間為12 周。
1.3.2 樣品采集
在第12周,將待取樣的小鼠置于干凈的鋪有無菌濾紙的籠子里,小鼠排便后立即收集糞便樣本置于5 mL無菌EP管,-80 ℃保存,糞便采集完后,將小鼠禁食不禁水12 h,次日早晨,先將小鼠稱質量,后用無水乙醚麻醉,進行眼球取血,將血放入預先準備好后的0.1%肝素鈉生理鹽水預處理過的無菌離心管中,然后放在冰浴中靜止10 min左右,再以4 ℃、3 500 r/min離心15 min,取上清液置于離心管中,-80 ℃的冰箱保存待測。血取完頸椎脫臼處死后解剖,將小鼠的肝臟、腹脂、結腸、腦和心臟這5 個臟器稱質量,其中肝和結腸于各小鼠固定位置稱取0.1 g,置于含9 倍組織剪切質量的生理鹽水勻漿器中冰浴條件下勻漿,制成質量分數10%的組織勻漿液,4 ℃、3 500 r/min離心10 min,取上清液,-80 ℃保存待測。
1.3.3 臟器指數、血脂指標、肝組織酶活力指標和抗氧化指標的測定
用試劑盒測定1.3.2節所取樣本的T-CHO、TG、HDL-C、LDL-C、脂蛋白酶、肝脂酶、T-AOC、T-SOD、CAT、MDA水平。分別按式(1)、(2)計算臟器指數和動脈粥樣硬化指數(atherosclerosis index,AI)。

1.3.4 糞便中DNA的提取與菌群多樣性測序
小鼠糞便中DNA的提取按照試劑盒提供的說明書進行具體相關操作。按照V3~V4區域設計引物聚合酶鏈式反應擴增序列(引物名稱為:338F、806R),然后再用Illumina MiSeq PE300平臺進行測序(委托上海美吉生物醫藥科技有限公司進行測序)。
1.3.5 短鏈脂肪酸含量的測定
從收集的糞便中取0.1 g置于2 mL離心管中,加500 μL的飽和氯化鈉溶液,在冰浴條件下用打碎機打碎均勻,再加20 μL 10% H2SO4溶液,混合器振蕩混勻,到通風櫥中加500 μL無水乙醚,混合器振蕩混勻,14 000 r/min離心15 min,取上清液置于裝有0.25 g無水硫酸鈉的2 mL離心管中,再以同樣的條件離心,取上清液置于氣相瓶中待測。
氣相色譜-質譜條件:采用Rtx?-WAX色譜柱(30 m×0.25 mm,0.25 μm);進樣口溫度:250 ℃,柱溫:100 ℃,離子源溫度:220 ℃,接口溫度:250 ℃;升溫程序:100 ℃到140 ℃升溫速率為7.5 ℃/min,保持4 min,再以60 ℃/min升溫至200 ℃;樣品進樣量:1 μL;載氣:He;分流比:10∶1;流速:2 mL/min,溶劑延遲1.5 min;Q3 Scan方式采集1.5~9.5 min,質量范圍m/z20.0~300.0。
1.4 數據統計與分析
實驗獲得的數據利用Excel軟件對其進行預處理,結合SPSS Statistics 20軟件的Duncan’s單因素方差分析對預處理的數據進行顯著性分析(P<0.05)。對腸道菌群原始數據進行處理,得到優化的序列。按照操作分類單元(operational taxonomic unit,OTU)進行單元劃分(97%相似度劃分在一個單元),在OTU分類基礎上進行物種豐度和多樣性分析。
2 結果與分析
2.1 原花青素對高脂小鼠臟器指數的影響

表1 原花青素B2對高脂小鼠臟器指數的影響Table 1 Effect of proanthocyanidin B2 on visceral organ indexes of HFD-fed mice
由表1可知,與對照組相比,高脂組小鼠的肝、腹脂、結腸和心臟均存在顯著性差異(P<0.05),高脂膳食飼養的小鼠肝、腹脂和心臟指數均大于對照組和原花青素B2,且原花青素B2飲食干預后,高脂小鼠的肝、腹脂、結腸和心臟指數顯著性降低(P<0.05)。
2.2 原花青素對小鼠血脂指標和肝組織酶活力指標的影響

表2 原花青素B2對高脂小鼠血脂指標的影響Table 2 Effect of proanthocyanidin B2 on serum lipase indexes of HFD-fed mice
由表2可知,3 組小鼠中T-CHO濃度最高的是高脂組,且與對照組和原花青素B2組存在顯著性差異(P<0.05)。原花青素B2組的TG濃度相對于高脂組顯著降低(P<0.05),原花青素B2干預下HDL-C濃度增加但不顯著。高脂組和對照組AI指數存在顯著性差異(P<0.05),對照組和原花青素B2組沒有顯著性差異。表明原花青素B2可調節高脂膳食引起的血脂代謝異常。

表3 原花青素B2對高脂小鼠肝組織酶活力的影響Table 3 Effect of proanthocyanidin B2 on liver enzyme activities in HFD-fed mice
由表3可知,3 組總脂酶活力均存在顯著性差異(P<0.05),3 組中高脂組總脂酶活力最低,原花青素B2組最高,脂蛋白酶活力中高脂組和原花青素B2組存在顯著性差異(P<0.05),肝脂酶活力中對照組和高脂組有顯著性差異(P<0.05),原花青素B2組和對照組無顯著性區別。表明原花青素B2可增強小鼠肝酶活力,從而達到改善血脂異常的作用。
2.3 原花青素對小鼠抗氧化指標的影響
由表4可知,與對照組相比,高脂組小鼠肝的T-AOC、T-SOD、CAT和MDA色譜均存在顯著差異(P<0.05),在原花青素B2干預后T-SOD和CAT活力顯著增加,MDA含量顯著降低(P<0.05),T-AOC有所增加但不顯著。結腸的抗氧化活性中,高脂組的T-AOC和T-SOD活力與對照組相比差異顯著(P<0.05),原花青素B2飲食干預后,T-AOC、T-SOD和CAT水平顯著增加,MDA水平顯著減少(P<0.05),表明原花青素B2具有抑制高脂小鼠氧化損傷的作用。
2.4 原花青素B2對小鼠腸道菌群多樣性分析結果
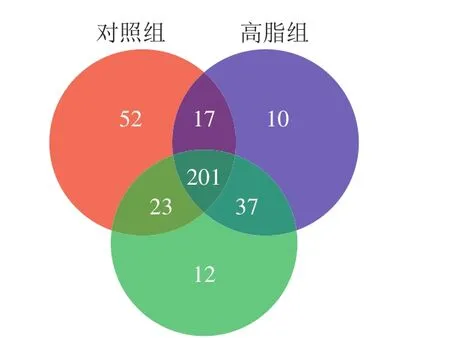
圖1 3 組小鼠糞便樣品Venn圖Fig. 1 Venn diagram of fecal microbiome in three mouse groups
如圖1所示,樣品在序列相似度97%的OTU數共有831 個,對照組有293 個,高脂組有265 個,原花青素B2組有273 個,對照組、高脂組和原花青素B2組共有201 個,另外對照組和高脂兩組共有17 個,對照組和原花青素B2組共有23 個,高脂組共有和原花青素B2組共有37 個。
如圖2A所示,橫坐標是隨機抽取的測序數據量,縱坐標是實際觀測到的多樣性指數(Shannon指數)。每條線代表一個樣本,隨著樣本量的增加,線條在逐漸趨于平緩,可見Shannon曲線平臺期。這表明測序的深度已經滿足了檢測樣品中的所有物種。如圖2B所示,運用統計學T檢驗的方法,Sobs指數中對照組和高脂組存在極顯著性差異,表明原花青素B2飲食干預后,使得高脂模型小鼠的腸道菌群豐度增加。
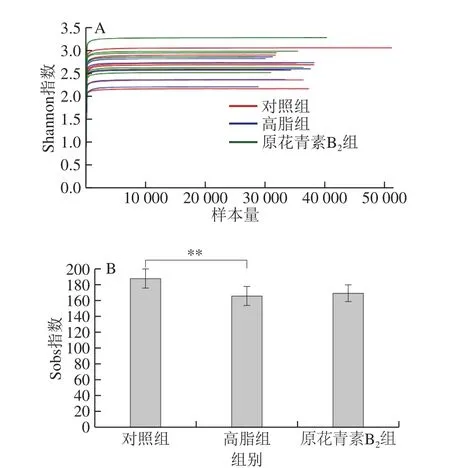
圖2 3 組小鼠糞便樣品稀釋曲線和檢驗圖Fig. 2 Rarefaction curves and test plots of fecal microbiome in three mouse groups
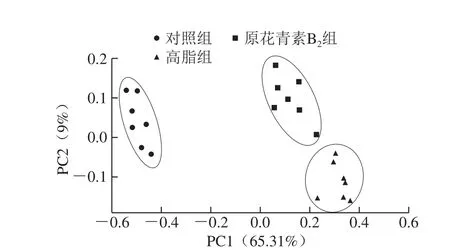
圖3 3 組小鼠糞便樣品PCoA分析圖Fig. 3 Principal co-ordinates analysis of fecal microbiome in three mouse groups
主坐標分析(principal co-ordinates analysis,PCoA)結果如圖3所示,橫縱主坐標成分的貢獻率分別是65.31%和9%,對照組、高脂組和原花青素B2組3 組樣本點區別明顯,對照組與原花青素B2組的樣本點距離小于對照組和高脂組間的距離,說明原花青素B2組的菌群結構有向對照組的菌群結構模式調節的趨勢。
2.5 原花青素對小鼠腸道菌群物種組成和差異性分析結果
基于門分類水平上原花青素對小鼠腸道菌群物種組成和差異性分析如圖4所示,對照組中厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、放線菌門(Actinobacteria)和變形菌門(Proteobacteria)在腸道菌群中相對豐度分別為51.39%、37.87%、9.42%和0.56%,與對照組比較,高脂組中厚壁菌門(Firmicutes)和變形菌門(Proteobacteria)是優勢菌,并且相對豐度分別為58.21%和37.15%,放線菌門(Actinobacteria,0.79%)和擬桿菌門(Bacteroidetes,3.70%)的數量減少,原花青素B2組與高脂組相比較,其中厚壁菌門(Firmicutes,63.97%)和擬桿菌門(Bacteroidetes,14.69%)的數量增加,變形菌門(Proteobacteria,20.90%)和放線菌門(Actinobacteria,0.27%)的數量減少。擬桿菌門/厚壁菌門比值(B/F值)發生顯著變化(P<0.05),其中高脂組B/F值顯著降低,而原花青素組較高脂組B/F值顯著升高(圖5)。

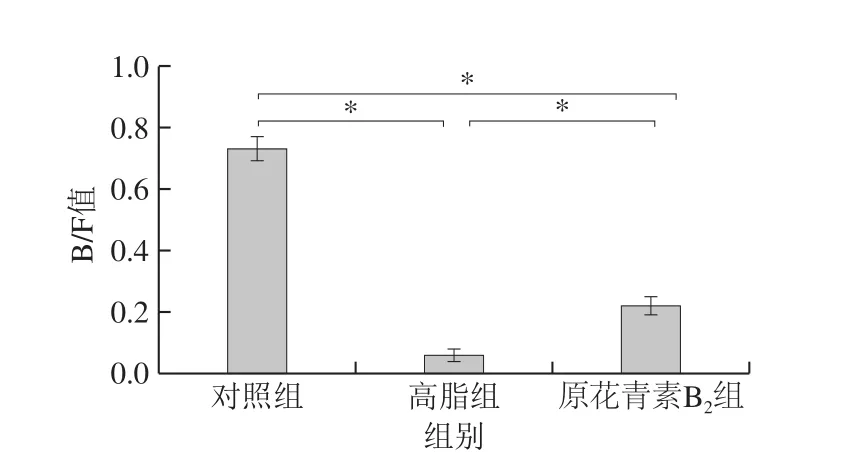
圖5 擬桿菌門/厚壁菌門比值的變化Fig. 5 Changes in Bacteroidetes/Firmicutes ratio of fecal samples from three mouse groups at the genus level
由圖6可知,基于屬水平上,3 組小鼠腸道中埃希氏菌-志賀氏菌(Escherichia-Shigella)、未分類擬桿菌(Bacteroidales_S24-7_group)、腸桿菌屬(Faecalibaculum)、Romboutsia、乳梭菌屬(Lachnoclostridium)、乳桿菌屬(Lactobacillus)、瘤胃球菌(Ruminococcaceae)、雙歧桿菌屬(Bifidobacterium)、擬桿菌(Parabacteroides)等13 種菌群有顯著性差異。3 組相比較,對照組中未分類擬桿菌(Bacteroidales_S24-7_group)、腸桿菌屬(Faecalibaculum)、乳桿菌屬(Lactobacillus)和雙歧桿菌屬(Bifidobacterium)等菌屬為優勢菌屬;高脂組中埃希氏菌-志賀氏菌(Escherichia-Shigella)、乳梭菌屬(Lachnoclostridium)、瘤胃球菌(Ruminococcaceae)和無害芽孢梭菌(Clostridium_innocuum_group)等菌屬占優勢。與高脂組相比,原花青素B2組占優勢的菌屬有未分類擬桿菌(Bacteroidales_S24-7_group)、Romboutsia、裂梭菌群(Clostridium_fissicatena_group)、毛螺旋菌屬(Lachnospiraceae)和擬桿菌(Parabacteroides)等菌屬。
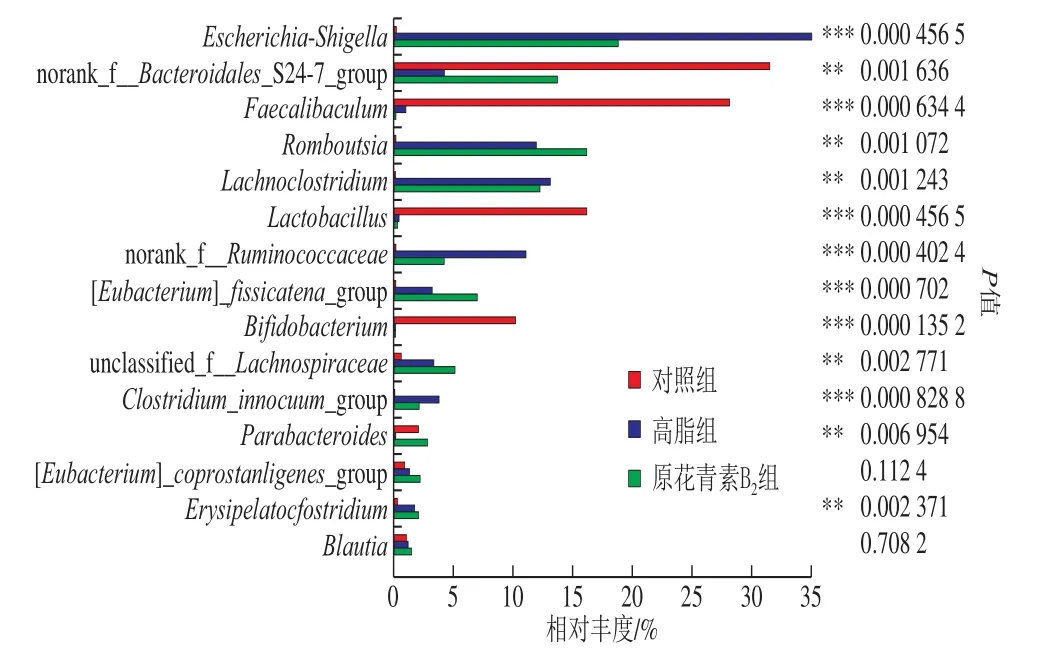
圖6 基于屬水平的3 組小鼠糞便樣品物種差異分析Fig. 6 Analysis of fecal microbial species that differed among three mouse groups at the genus level
2.6 原花青素B2對小鼠糞便中短鏈脂肪酸的影響

表5 小鼠糞便中短鏈脂肪酸的含量Table 5 Contents of fecal short chain fatty acids in three mouse groups
原花青素B2對小鼠糞便中短鏈脂肪酸的影響結果見表5,高脂組較對照組在乙酸、丙酸和總酸含量顯著增加(P<0.05),原花青素B2干預可顯著增加丁酸的含量(P<0.05),這表明原花青素B2可調節產丁酸菌群的作用。
3 討 論
本研究發現原花青素B2干預可顯著降低高脂膳食小鼠模型的T-CHO、TG和AI指數,顯著增加肝組織脂蛋白酶活力、肝脂酶活力以及機體抗氧化能力。長期高脂膳食會引起機體脂質代謝紊亂,從而導致血脂異常,如T-CHO、TG和LDL-C水平升高,HDL-C水平降低[10]。脂蛋白酶和肝脂酶是血漿脂蛋白代謝中的兩個關鍵酶,由于具有高相似度的氨基酸序列,所以具有共同的作用機制[11],肝脂酶參與LDL、HDL和極低密度脂蛋白的產生[12]。Shi Fang等[13]通過高脂血癥小鼠模型研究發現,LachnumYM226的降血脂作用部分是由于肝臟中脂蛋白酶和肝脂肪酶的調節實現的。Wang Bin等[14]研究殼聚糖對高脂飼料喂養的小鼠肝臟基因表達的影響,發現殼聚糖可降低高脂模型小鼠血脂指標和增加肝脂蛋白脂肪酶和肝脂肪酶活性,與本研究結果相似。
高脂膳食也可引起機體內自由基失衡,產生大量的自由基,導致氧化應激反應[15],在一些病理生理條件下,自由基產生和抗氧化能力之間的平衡被打破,導致氧化應激反應和組織損傷的增加[16],這些變化使機體產生動脈粥樣硬化、心腦血管疾病和糖尿病等慢性疾病風險的幾率增加[17]。原花青素B2具有較強的清除自由基,抗氧化和抑制脂質過氧化產物堆積的作用[18]。本研究發現高脂組小鼠血漿的T-CHO、TG、LDL-C水平顯著上升,HDL-C水平下降明顯,小鼠體內T-AOC和T-SOD活性均顯著下降,而MDA水平上升,表明高脂組有著明顯的脂質過氧化損傷的現象,這與Sour等[19]的研究結果一致。而高脂血癥導致的血脂異常與結直腸息肉的發病息息相關[20],自由基及其產生的鏈式反應會導致組織損傷,引發組織炎癥反應,甚至導致DNA損傷引發癌癥[21],本研究發現高脂組小鼠結腸臟器指數上升,可能與結腸組織損失引發炎癥反應有關,經過原花青素B2干預后結腸的臟器指數下降,表明原花青素B2具有抗氧化干預高脂膳食導致消化道氧化損傷的作用。
人體腸道菌群微生態失衡會引起許多人體疾病,例如代謝性疾病、消化性疾病和免疫性疾病[22]。有相關報道稱腸道相關免疫系統對細菌成分的識別可能引起低水平炎癥,該炎癥是導致動脈粥樣硬化的重要因素之一[23]。高脂膳食會致使小鼠體內B/F值降低[24-25],本研究的高脂膳食小鼠腸道B/F值顯著降低,經過原花青素B2干預后比值增加,小鼠腸道菌群的結構得到了調節。厚壁菌門和擬桿菌門與機體的脂質代謝有著密切關系,它們會形成一種相互促進的共生關系,共同促進宿主對于多糖的代謝,促進能量的吸收和儲存,而糖酵解所產生的磷酸二羥丙同酮還原后形成甘油,與丙酮酸氧化脫羧形成的乙酰輔酶A共同作用合成脂肪。一些致病菌如革蘭氏陰性桿菌的增會導致腸道內產生大量的脂多糖(lipopolysaccharide,LPS),一方面,LPS會破壞腸道上皮細胞之間的緊密連接,導致腸道通透性的增加,隨后LPS通過上皮細胞間的間隙進入體內血液循環,使機體產生炎癥反應,從而對肝臟的功能產生顯著影響,導致肝臟的脂代謝能力下降,引起脂肪積累在體內[26];另一方面,LPS和革蘭氏陰性菌的鞭毛會使腸道上皮細胞對脂肪的吸收增加,血液內的游離脂肪酸含量增加,機體內的脂肪不斷積累,最終導致肥胖等脂代謝紊亂[27]。
Cheng Mei等[28]建立小白鼠高脂血癥動物模型,給小鼠服用乳酸制劑和他汀藥物(降血脂藥),比較發現它們都顯著降低T-CHO、TG、HDL-C的含量,達到降血脂的功能,而灌胃乳酸菌的小鼠腸道中乳酸菌的數量顯著增加,大腸桿菌和腸球桿菌的數量顯著降低,表明調節腸道菌群與降血脂有顯著的關聯性。本研究發現原花青素B2干預高脂模型小鼠的腸道中埃希氏菌-志賀氏菌(Escherichia-Shigella)顯著性降低,未分類擬桿菌(Bacteroidales_S24-7_group)顯著性增加。埃希氏菌-志賀氏菌(Escherichia-Shigella)為革蘭氏陰性菌,趙梅等[29]從一名重度肥胖患者腸道內分離出19 種不同的ERIC類型的分離物,進行16S rRNA基因分子鑒定,發現19 種代表菌株的16S rRNA基因和埃希氏菌屬和志賀氏菌屬相似度高達99%。表明高脂膳食可通過增加埃希氏菌-志賀氏菌的豐度從而改變腸道菌群結構。未分類擬桿菌(Bacteroidales_S24-7_group)屬于丁酸鹽產生菌,有研究顯示高脂膳食會引起機體內腸道菌群未分類擬桿菌(Bacteroidales_S24-7_group)減少致使丁酸鹽減少,丁酸鹽的減少會破壞腸菌群生存環境的pH值,弱酸環境對于雙歧桿菌(Bifidobacterium)等益生菌的生長比較有利[30-31],本研究也發現原花青素B2干預高脂膳食小鼠腸道中雙歧桿菌相對豐度也有增加的趨勢。Hua等[32]研究證明,益生菌能夠刺激機體免疫功能,上調抗炎細胞因子,抑制機體炎癥反應,其代謝產物還能促進腸上皮細胞的修復和再生,從而有效減少LPS的吸收。
短鏈脂肪酸是由腸道菌群發酵部分未消化的碳水化合物、蛋白質與脂肪等營養素在結腸中產生的,它們能夠促進機體內難消化產物的吸收和結腸上皮細胞增殖與黏膜生長,短鏈脂肪酸的增加還具有調節改善結腸的功能[33-35]。本研究發現高脂膳食可導致腸道乙酸含量增多,這可能是過多攝入的脂肪等未被消化的營養素在結腸經乙酰輔酶A或Wood-Ljungdahl途徑產生,研究發現體內乙酸的增加可導致胰島素抵抗的作用,從而加劇脂代謝異常[36]。本研究結果發現高脂膳食小鼠經原花青素B2干預,腸道中丁酸含量顯著增加。研究表明,丁酸的代謝至少占結腸細胞能量需求的70%,丁酸可通過增加磷脂轉運蛋白mRNA的水平及磷脂轉運蛋白的分泌,促進膽固醇的轉運[37],激活蛋白PGC-1α增強線粒體功能,從而加速脂肪氧化[38],調節脂代謝異常[39]。因此,原花青素B2干預可調節腸道中的擬桿菌、雙歧桿菌、消化鏈球菌和梭菌屬等豐度的變化,從而改善小鼠血脂代謝異常。
本研究結果表明原花青素B2可以降低高脂小鼠血脂水平、抗氧化活性和增強肝酶活性,調節腸道菌群豐度和結構,促進短鏈脂肪酸的產生,從而可能改善血脂代謝紊亂。

