海鱸魚糜加工及凝膠形成過程中蛋白質的變化機理
劉芳芳,林婉玲,李來好,吳燕燕,楊少玲,黃 卉,楊賢慶,林 織
(1.中國水產科學研究院南海水產研究所,國家水產品加工技術研發中心,農業農村部水產品加工重點實驗室,廣東 廣州 510300;2.上海海洋大學食品學院,上海 201306;3.廣東順欣海洋漁業集團有限公司,廣東 陽江 529800)
魚糜是指己經去皮的魚肉經過漂洗、脫水、精濾后得到的蛋白質濃縮物,有“濃縮的肌原纖維蛋白”之稱[1]。魚糜制品是以冷凍魚糜或新鮮魚糜為原料,添加輔料擂潰成魚漿,然后成型、加熱,制成具有彈性的凝膠體[2]。蛋白質凝膠是影響魚糜制品品質的關鍵,其構象變化決定著凝膠特性。目前,熱誘導魚糜形成凝膠是較為普遍的凝膠形成方式。熱誘導蛋白質凝膠是一個復雜的過程[3],加熱可以改變蛋白質的二級結構,使α-螺旋結構部分向β-折疊和無規卷曲轉化[4-5],同時也可誘導蛋白質性質及組成發生變化[6],如使蛋白質溶解度降低等[7]。漂洗、斬拌等加工工藝對蛋白質構象以及蛋白質之間的化學作用力有一定影響,漂洗可以使蛋白質溶解度以及巰基含量顯著降低[8],蛋白質二級結構發生改變,肌球蛋白二級結構中的β-折疊含量減少[9]。但是,目前研究主要集中在漂洗和斬拌工藝對蛋白質組成、凝膠持水性、凝膠強度和質構特性等的影響[10-11],關于魚糜加工及凝膠形成過程中蛋白質間化學作用力對蛋白質的二級結構的影響卻鮮見報道。漂洗、斬拌等工藝對蛋白質構象、維持蛋白構象的化學作用力的影響以及他們之間相互變化關系鮮見研究,另外漂洗和斬拌對魚糜微觀結構的影響也鮮見報道。因此,研究魚糜加工工藝及加熱過程中蛋白質特性的變化,對揭示魚糜凝膠形成機理具有重要的意義。
海水魚因含有較高的鹽溶蛋白而具有較好的凝膠特性,海鱸魚(Perca fluviatilis)是我國重要的經濟海水養殖魚類之一,2017年全國海水養殖海鱸魚產量為15.66萬 t,比2016年增長13.56%,年產量逐年提升。但隨著海鱸魚產量增大及壓塘問題的產生,對海鱸魚加工品進行多樣化開發己經迫在眉睫。海鱸魚具有肉質潔白和骨刺較少的特點,并且富含蛋白質及人體必需氨基酸[12],很適合作為開發魚糜產品的原料,生產海鱸魚糜等產品也是海鱸魚產量快速增長的需要。目前關于海鱸魚糜的研究集中在高壓處理魚糜對凝膠強度的影響[13]、外援添加物[14]對魚糜凝膠強度的影響以及混合魚糜[15]的研究,更傾向于工藝的研究,而關于海鱸魚糜凝膠機理的研究報道較少。本研究以海鱸魚為原料,研究其魚糜加工及凝膠形成過程中的蛋白質二級結構、三氯乙酸(trichloroacetic acid,TCA)-可溶性肽及蛋白質間化學作用力等特性的變化,揭示海鱸魚糜加工及凝膠形成過程中蛋白質變化機理,為海鱸魚糜的開發應用和海鱸魚產業的發展提供理論支持。
1 材料與方法
1.1 材料與試劑
海鱸魚購自廣州市黃沙水產市場,平均體質量2.5 kg,購買后1 h內運往實驗室,立即宰殺制作魚糜,本實驗制作魚糜所用海鱸魚均屬同一批魚。
食鹽、白砂糖(食品級) 廣州海珠區客村華潤萬家超市;氫氧化鈉、尿素、氯化鈉、TCA(均為分析純)廣州領馭生物科技有限公司;BeyoColorTM彩色預染蛋白 上海碧云天生物技術有限公司;微量總巰基測試盒 南京建成生物工程有限公司;三羥甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)(分析純)美國Sigma公司;β-巰基乙醇、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)(電泳級) 上海麥克林生化科技有限公司。
1.2 儀器與設備
絞肉機 廣東省佛山市順德區陳村鎮恒基隆五金機械廠;打漿機 湖南省長沙固利食品機械有限公司;IKA-T25組織勻漿機 德國IKA公司;HH-4快速恒溫數顯水浴箱 常州澳華儀器公司;Sunrise-basic吸光酶標儀 德國Tecan公司;Alpha1-4冷凍干燥機 德國Christ公司;IRAffinity-1傅里葉紅外光譜儀 日本島津公司。
1.3 方法
1.3.1 魚糜凝膠制備工藝
原料處理→采肉→漂洗(水洗1 次、0.2%鹽洗1 次,每次4 min,肉液比1∶4(g/mL))→擠壓脫水(保證含水量低于80%)→斬拌(空斬5 min后加入質量分數1%食鹽和質量分數1%白砂糖繼續斬拌10 min,斬拌溫度在4~10 ℃)→灌腸→低溫加熱(40 ℃加熱30 min形成凝膠化魚糜)→高溫加熱(將低溫加熱形成的凝膠化魚糜,經過90 ℃加熱30 min后形成魚糜凝膠)。
1.3.2 pH值的測定
參考GB 5009.237—2016《食品pH值的測定》[16]。
1.3.3 水分含量的測定
參考GB 5009.3—2016《食品中水分的測定》[17]。
1.3.4 化學作用力測定
參照Tan等[18]方法稍作修改。稱取1 g樣品加10 mL A1提取液(0.6 mol/L NaCl),在5 000 r/min勻漿2 min,于4 ℃放置1 h,并在4 ℃、18 600 r/min離心25 min,上清液于4 ℃保存。上述離心所得沉淀加10 mL A2提取液(1.5 mol/L尿素和0.6 mol/L NaCl的混合液),5 000 r/min勻漿2 min,于4 ℃放置1 h,4 ℃、18 600 r/min離心25 min,上清液4 ℃保存。將上述離心沉淀加10 mL A3提取液(8 mol/L尿素和0.6 mol/L NaCl的混合液),在5 000 r/min勻漿2 min,于4 ℃層放置1 h,4 ℃、18 600 r/min離心25 min,上清液4 ℃保存,重復此步驟,并將2 次離心得到的上清液合并,4 ℃保存。繼續向沉淀加10 mL A4提取液(0.5 mol/L β-巰基乙醇、0.6 mol/L NaCl和8 mol/L尿素的混合液,pH 7),在5 000 r/min勻漿2 min,4 ℃放置1 h,4 ℃、18 600 r/min離心,上清液4 ℃保存。上述各步離心后所得上清液分別加入等體積質量分數為20% TCA,3 950 r/min離心15 min,棄上清液,向沉淀中加入1 mL 1 mol/L NaOH溶液于4 ℃放置,采用雙縮脲法測定其蛋白質的含量。離子鍵、氫鍵、疏水相互作用、二硫鍵的貢獻分別以溶解于A1、A2、A3、A4蛋白質的相對質量分數表示。
1.3.5 蛋白質溶解度測定
參考劉海梅[19]方法,將1 g魚糜樣品溶解于20 mL 20 mmol/L Tris-HCl緩沖液(含0.01 mg/mL SDS,8 mol/L尿素和0.02 mg/mL β-巰基乙醇,pH 8.0)中,均質,混合液100 ℃加熱2 min后,于室溫攪拌4 h,然后10 000 r/min離心30 min后取上清液10 mL,添加0.5 mg/mL冷TCA至終質量濃度為0.1 mg/mL,混合液于4 ℃放置18 h,10 000 r/min離心3 min,沉淀物用10% TCA沖洗并溶解于0.5 mol/L NaOH溶液中。蛋白質含量用雙縮脲法測定,溶解度表示為樣品在溶劑中測得的蛋白質總量占總蛋白(凝膠直接溶解于0.5 mol/L NaOH溶液測得)的百分比。
1.3.6 總巰基含量測定
參照南京建成公司總巰基含量測試盒說明書進行。
1.3.7 TCA-可溶性肽測定
參考Benjakul等[20]方法并稍作修改。取2 g制備好的魚糜樣品至18 mL提前預冷的5% TCA溶液中,11 000 r/min均質2 min,4 ℃靜置1 h,置于冷凍離心機中10 000 r/min離心15 min。根據雙縮脲法測定上清液中的TCA-可溶性肽含量,以樣品中Tyr物質的量計算,結果用μmol/g表示。
1.3.8 紅外光譜法測定蛋白質的二級結構變化
參照胡熠等[21]方法,將樣品冷凍干燥,取約2 mg干粉和200 mg KBr在研缽中充分研磨后取適量壓片,壓片完成后,用傅里葉紅外光譜儀在400~4 000 cm-1的波數范圍進行全波段掃描測定吸光度,確定魚糜加工及凝膠形成過程。
1.3.9 電鏡掃描
將樣品切成小塊,用2.5%戊二醛固定液浸泡24 h以上,再用0.1 mol/L磷酸緩沖液(pH 7.2)浸泡清洗20 min,重復4 次。依次用30%、50%、70%、90%、100%乙醇脫水15 min,最后用叔丁醇浸泡,每次15 min,重復3 次。冷凍干燥后鍍金,最后進行電鏡掃描觀察。
1.4 數據分析
2 結果與分析
2.1 pH值及水分含量的變化
魚肉pH值對魚糜凝膠性能有顯著的影響。pH值低于6.3時,會阻礙肌球蛋白三磷酸腺苷酶對肌球蛋白和肌動蛋白的結合;高于8.0時,蛋白質分子之間的靜電斥力會增強,影響凝膠作用;pH 6.5~7.5有利于魚糜凝膠的形成,超過這個范圍時則容易造成蛋白質變性[22]。本研究的海鱸魚在魚糜加工及凝膠形成的過程中,pH值范圍為6.39~6.77(表1),原料pH值略低于最適范圍,但經過漂洗,魚糜pH值顯著增大。研究表明,清水漂洗可以不同程度地提高魚肉的pH值,鹽洗可使魚肉pH值接近中性[23]。經過斬拌、加熱形成凝膠后,pH值減小,這與魚肉自身營養組成具有一定的關系。在斬拌過程中,脂肪酸釋放導致pH值減小,但均在形成凝膠的最適pH值范圍內。凝膠化魚糜與斬拌魚糜pH值差異不顯著(P>0.05),而魚糜凝膠相比于凝膠化魚糜,pH值顯著增大(P<0.05),這主要由于隨著加熱溫度的升高,酸性基團特別是羧基減少,形成酯結合的側鏈(R—CO—O—R’)[24],pH值增大;另外高溫加熱造成pH值增大與蛋白質變性、蛋白質結構變化、游離氨基增多也有一定的關系。
水作為魚糜中含量最高的成分,在魚糜凝膠形成過程中起著重要的作用。海鱸魚糜加工及凝膠過程中含水量的變化如表1所示。海鱸魚肉含水量為75.16%,經漂洗后,魚糜的含水量上升至79.32%,主要是由于漂洗后魚肉蛋白吸水膨脹。由于在斬拌時加入食鹽和白砂糖,斬拌后魚糜含水量顯著降低(P<0.05)。后期經過40 ℃和90 ℃加熱形成凝膠的過程中,魚糜含水量變化不顯著(P>0.05),但比斬拌魚糜略高。魚糜在凝膠形成過程中,蛋白質變性聚集形成空間三維網狀結構,能夠捕獲更多的水分[25]。在魚糜加工過程中,水分狀態不斷發生著變化,并且不易流動水與蛋白質的二級結構有一定的相關性,而蛋白質二級結構主要依靠蛋白質間化學作用力維持,因此,進一步研究魚糜加工及凝膠形成過程中蛋白質間化學作用力的變化有利于進一步揭示魚糜加工過程中蛋白質的變化機理。

表1 魚糜加工及凝膠過程中pH值和含水量的變化Table 1 Changes in pH and water content during surimi processing and gelation
2.2 化學作用力的變化
在魚糜凝膠形成過程中,蛋白質變性聚合形成空間三維網絡結構。由圖1可知,離子鍵和氫鍵在整個過程中呈下降趨勢,說明離子鍵和氫鍵是主要維持蛋白質的天然結構,而不是維持凝膠三維網絡的主要作用力。在魚糜凝膠形成過程中,首先需要鹽離子打破離子鍵,分散蛋白質,后經加熱使得蛋白質變性聚集。由圖1可知,相比于原料而言,魚糜經過漂洗后離子鍵含量增大,斬拌后又減小,經過加熱加工,離子鍵含量顯著減小(P<0.05);氫鍵主要維持蛋白質二級結構中的α-螺旋結構,與蛋白質凝膠化、茹彈性有一定的關系,氫鍵在蛋白質受熱變性時發生斷裂,在魚糜凝膠冷卻以后會重新形成,起到穩定結合水、促使凝膠變硬的作用[26]。
疏水相互作用和二硫鍵在整個過程中呈上升趨勢。在凝膠形成過程中,蛋白質變性并有序聚集形成三維網狀結構,并且依靠離子鍵、氫鍵、疏水相互作用和二硫鍵等化學作用力達到平衡,其中疏水相互作用和二硫鍵發揮著主要的作用。疏水相互作用主要是蛋白質受熱發生變性,疏水基團暴露,增強了相鄰分子非極性基團的相互作用,發生聚集形成凝膠,對于未受熱的蛋白質,這些基團被包埋在α-螺旋結構中。如圖1所示,經過漂洗,海鱸魚糜的疏水相互作用增加31%,這主要是因為漂洗會引起蛋白質的部分氧化,而蛋白質氧化會使蛋白質內部疏水結合被打破,疏水基團暴露,表面疏水性增加[27];斬拌后,疏水相互作用相比漂洗過程增加17%;40 ℃加熱,對疏水相互作用影響相對較小;90 ℃加熱形成魚糜凝膠后,疏水相互作用顯著增大(P<0.05)。疏水相互作用的形成主要是依靠加熱,有研究表明,魚肉在60 ℃時疏水相互作用達到最大,并且由于魚種的不同,疏水相互作用最適形成溫度也有所差異[28]。因此,在本實驗中,40 ℃凝膠化魚糜疏水相互作用顯著小于90 ℃加熱后形成的魚糜凝膠(P<0.05)。
蛋白質的聚集與二硫鍵的生成緊密相關[29],形成于魚糜加工的各個階段。加熱是熱誘導凝膠形成過程中巰基氧化形成二硫鍵的主要原因,并且不同魚類,二硫鍵形成的最適溫度也不同[30-31]。如圖1所示,漂洗魚糜相比于魚肉原料,二硫鍵顯著增加,這主要是由于半胱氨酸屬于氧化敏感氨基酸,并且含有巰基,經過氧化易形成二硫化物,在漂洗過程中活性氧攻擊蛋白質,從而形成有利于蛋白質聚集的共價相互作用力二硫鍵。經斬拌后,二硫鍵相比漂洗過程僅增加8%,增加幅度較小;40 ℃和90 ℃加熱后,二硫鍵分別相比于斬拌過程增加27%和93%,這說明加熱是二硫鍵形成的主要原因,并且海鱸魚二硫鍵最佳形成溫度高于40 ℃。
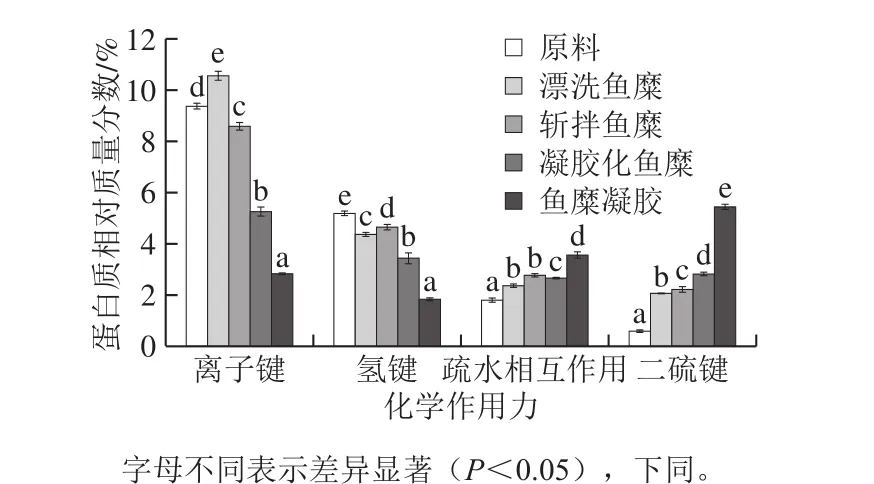
圖1 魚糜加工及凝膠過程中化學作用力的變化Fig. 1 Changes in chemical forces during surimi processing and gelation
2.3 非二硫共價鍵的變化
蛋白質的溶解度可以反映凝膠網絡結構中形成的非二硫共價鍵的多少,非二硫共價鍵ε-(γ-Glu)-Lys的形成主要是轉谷氨酰胺酶(transglutaminase,TGase)催化肌球蛋白重鏈的Glu殘基的γ-酰胺基與Lys殘基的ε-氨基之間發生交聯作用,非二硫共價鍵也是魚糜網絡結構形成的主要化學作用力,賦予魚糜較高的彈性和強度[32]。由圖2可知,在魚糜加工及凝膠形成過程中,蛋白質溶解度先降低后升高。在前期加工過程中蛋白質溶解度持續降低,40 ℃凝膠化魚糜相比于原料,溶解度降低了60%,說明形成了非二硫共價鍵。目前己有研究表明,在4~40 ℃溫度范圍內,TGase均能催化形成非二硫共價鍵,增強凝膠強度[33]。而經過高溫加熱形成魚糜凝膠時,蛋白溶解率顯著增大,非二硫共價鍵含量低于低溫凝膠化時的含量。劉海梅等[34]在鰱肌球蛋白膠凝過程化學鍵變化中研究發現,蛋白質溶解度隨著溫度的上升先降低后升高,呈V型分布,當溫度過高時,非二硫共價鍵的形成則受到抑制,與本研究結論一致。
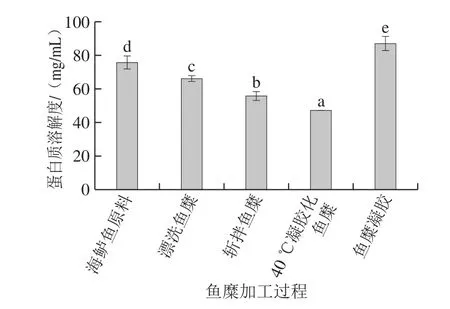
圖2 魚糜加工及凝膠過程中蛋白質溶解度的變化Fig. 2 Changes in protein solubility during surimi processing and gelation
2.4 巰基的變化
在蛋白凝膠形成過程中,巰基含量的降低意味著其被氧化生成二硫鍵[35]。有研究表明,低溫(65 ℃)加熱對牛肉蛋白的巰基沒有顯著影響,而高溫加熱會導致巰基含量下降[36]。如圖3所示,巰基含量總體呈下降趨勢;經過漂洗,巰基含量相比原料下降了28%;而斬拌、40 ℃加熱對巰基含量影響不顯著(P>0.05);90 ℃高溫加熱后,巰基含量再次顯著下降,相比凝膠化魚糜下降率為43%,與2.2節研究結果一致,進一步說明了海鱸魚糜在加工及凝膠形成過程中,凝膠特性的形成與巰基減少和二硫鍵的增多有關。
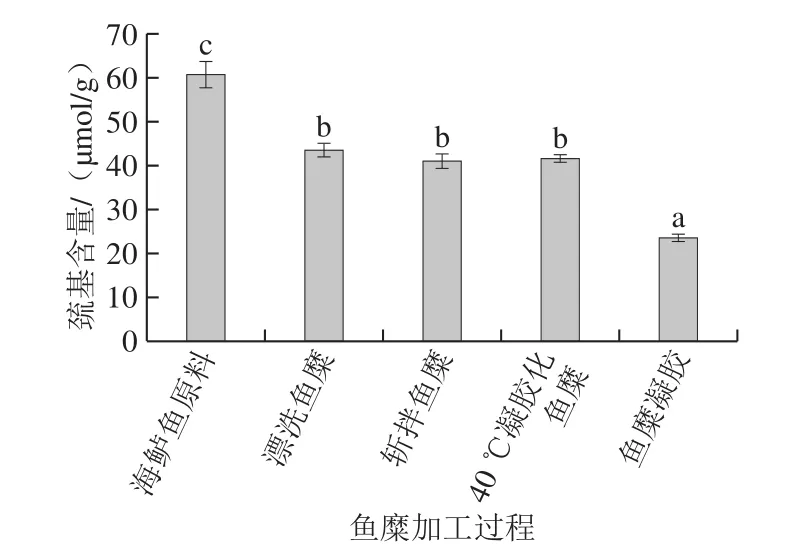
圖3 魚糜加工及凝膠過程中巰基含量的變化Fig. 3 Changes in sulfhydryl group content during processing and gelation of surimi
2.5 TCA-可溶性肽含量的變化
TCA-可溶性肽反映魚糜凝膠中小分子肽的含量,從而反映蛋白質在內源性組織蛋白酶作用下的水解程度,其含量與蛋白質降解程度呈負相關[37]。由圖4可知,漂洗造成TCA-可溶性肽含量顯著降低(P<0.05),其主要原因是蛋白質的降解與組織蛋白酶有關,而漂洗可以除去魚肉組織蛋白酶,從而有效抑制蛋白質的降解,使TCA-可溶性肽含量從99.58 μmol/g下降至16.58 μmol/g。錢娟等[38]己證明清水漂洗可以有效抑制蛋白質的降解。斬拌對蛋白質降解程度無明顯影響,而經過40 ℃低溫加熱后,TCA-可溶性肽含量顯著增大(P<0.05),這是由于加熱使得漂洗未除盡的內源蛋白酶活性增強,從而加速蛋白質的降解,導致TCA-可溶性肽含量增大68%。經過90 ℃高溫加熱形成凝膠后,TCA-可溶性肽含量顯著降低(P<0.05),因為此時蛋白凝膠形成,由于蛋白質間相互作用的關系,使得蛋白質內部形成穩定的結構,被降解程度降低,TCA-可溶性肽含量隨之減少。
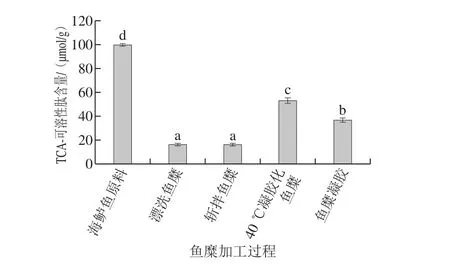
圖4 魚糜加工及凝膠過程中TCA-可溶性肽含量的變化Fig. 4 Changes in TCA-soluble peptide content during processing and gelation of surimi
2.6 蛋白質二級結構的變化
酰胺I帶(1 600~1 700 cm-1)常用來分析蛋白質二級結構的變化規律[39],通常認定1 600~1 640 cm-1波數范圍是β-折疊;1 640~1 650 cm-1波數范圍是無規卷曲;1 650~1 660 cm-1波數范圍是α-螺旋;1 660~1 695 cm-1波數范圍是β-轉角。本實驗中,紅外光譜圖采用Peakfit 4.12軟件對酰胺I帶進行去卷積、二階導和高斯擬合處理,最終使各子峰分開,利用面積比確定蛋白質二級結構變化規律。
由表2可知,總體上β-折疊和無規卷曲呈先下降后上升再下降的趨勢,α-螺旋含量持續下降,β-轉角先上升后下降再上升。漂洗過后相比于魚肉原料,β-折疊含量下降13%,β-轉角含量上升39%,α-螺旋和無規卷曲含量變化不顯著(P>0.05)。袁凱等[8]研究表明,在4 ℃條件下,隨著漂洗次數增加,β-折疊含量持續下降;盧巖[40]研究發現,隨著H2O2濃度增加,β-折疊和α-螺旋結構明顯減少,證實了氧化會導致蛋白質二級結構發生改變。因此漂洗過程中,蛋白質氧化是導致蛋白質二級結構改變的主要原因。斬拌是魚糜凝膠制備的一道重要工序,斬拌過程中,剪切力和NaCl溶解的共同作用會促進蛋白質高級結構的展開[41],Kang Zhuangli等[42]研究表明,豬肉糜中隨著NaCl添加量的增加,β-折疊相對含量有升高趨勢。本實驗中,經過斬拌,β-折疊和無規卷曲結構顯著上升(P<0.05),α-螺旋和β-轉角顯著下降(P<0.05),表明斬拌使α-螺旋解旋形成β-折疊和無規卷曲結構;經過40 ℃低溫加熱,相比斬拌魚糜,β-折疊和β-轉角含量分別增加8%和6%,無規卷曲含量下降12%,α-螺旋結構無明顯變化;而當凝膠化魚糜經90 ℃高溫加熱形成凝膠后,β-折疊、無規卷曲和α-螺旋含量都下降,β-轉角含量顯著增加(P<0.05)。有研究表明,高溫加熱時α-螺旋解旋主要形成β-折疊和無規卷曲結構[19]。賈丹[43]研究發現,青魚魚糜經過90 ℃高溫加熱后,β-轉角結構明顯增加,而鰱魚魚糜無規卷曲結構顯著增加。其原因主要由于不同魚種的蛋白構象存在差異,從而導致高級結構和功能特性的差異。
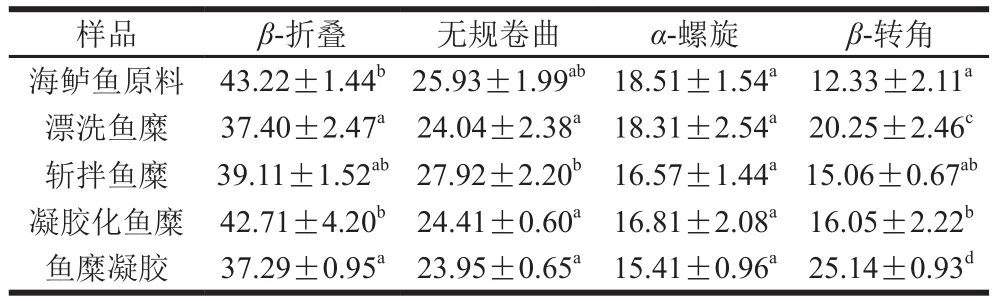
表2 魚糜加工及凝膠過程中蛋白質二級結構的變化Table 2 Changes in protein secondary structures during surimi processing and gelation%
2.7 相關性分析
蛋白質構象通過蛋白質間化學作用力維持,有研究指出,α-螺旋是依靠肌原纖維蛋白分子內氫鍵形成的,β-折疊是依賴蛋白質分子間氫鍵形成的[44];氫鍵和離子鍵主要維持蛋白質的天然結構,疏水性相互作用是蛋白質變性形成緊湊結構的主要驅動力。如表3所示,化學鍵之間相關關系極顯著(P<0.01),疏水鍵和巰基與水解度顯著相關(P<0.05);α-螺旋結構與離子鍵、氫鍵和巰基相關系數分別為0.545、0.54、0.534,均顯著正相關,與疏水鍵和二硫鍵顯著負相關,相關系數分別為-0.620、-0.562。β-轉角與離子鍵顯著負相關,與氫鍵和巰基極顯著負相關(P<0.01),與疏水鍵和二硫鍵極顯著正相關(P<0.01),相關系數為0.966。無規卷曲和β-折疊與蛋白質間化學鍵無顯著相關性(P>0.05);蛋白質二級結構不同構象間也有一定的相關性,β-轉角與β-折疊和無規卷曲顯著負相關(P<0.05)。
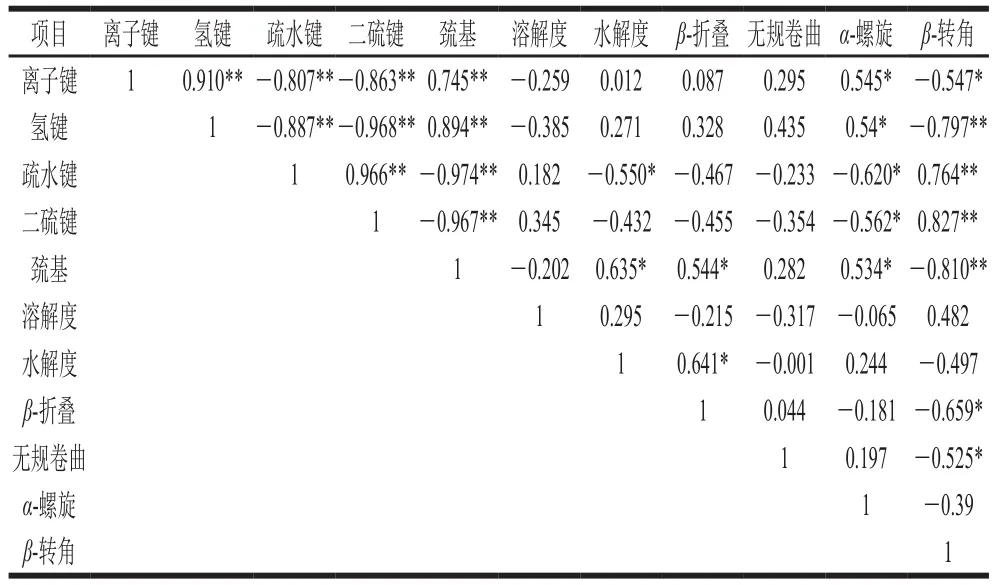
表3 魚糜加工及凝膠過程中理化指標相關性分析Table 3 Correlation analysis of physicochemical indicators during surimi processing and gelation process
2.8 微觀結構變化

圖5 魚糜加工及凝膠過程中微觀結構的變化Fig. 5 Microstructure changes during surimi processing and gelation
本研究發現蛋白質在漂洗、斬拌以及加熱過程中都發生變化,并且這些變化與蛋白質的聚合有一定的相關關系,而魚糜的凝膠形成是在蛋白質間化學作用力的共同作用下形成的,并且魚糜凝膠結構的變化是蛋白質解聚、聚合的表觀。因此,對魚糜凝膠微觀結構的研究,有利于進一步研究魚糜加工及凝膠形成過程中蛋白質的聚合過程。由圖5可知,漂洗對魚糜網絡結構無明顯影響,而經過斬拌后,原本疏松的魚糜網絡結構開始局部出現較大的網孔結構。在低溫加熱后,凝膠化魚糜開始有蛋白顆粒堆積,并且網孔結構更為明顯,孔徑也明顯減小,但是相比于90 ℃加熱后形成的穩定魚糜凝膠,低溫凝膠化沒有形成明顯的三維網絡結構。90 ℃加熱形成的魚糜凝膠結構緊密,且可明顯看到聚集簇的形成,進一步說明了凝膠的形成是天然蛋白質先發生變性解聚然后在蛋白質間相互作用下聚合的過程。
3 結 論
本實驗通過海鱸魚糜加工及凝膠形成過程中理化性質的變化,發現造成pH值改變的主要過程是漂洗和高溫加熱,而含水量的變化主要是由于漂洗和斬拌過程對水分的調節;90 ℃加熱后離子鍵、氫鍵含量顯著下降,疏水相互作用和二硫鍵形成的最適溫度均高于40 ℃,漂洗和斬拌對化學鍵的影響比加熱較小;蛋白質水解度和蛋白質溶解度在整個過程中都呈現先減小后增加的趨勢;漂洗對β-折疊和β-轉角影響顯著,斬拌、40 ℃加熱和90 ℃對α-螺旋、無規卷曲、β-折疊和β-轉角影響顯著(P<0.05);各指標相關性分析可知,離子鍵和氫鍵與α-螺旋正相關,氫鍵的斷裂伴隨著穩定結構α-螺旋解旋形成相對不穩定的無規卷曲和β-轉角,離子鍵、氫鍵、疏水鍵和二硫鍵與二級結構中的α-螺旋和β-轉角有顯著相關性,與β-折疊和無規卷曲無明顯相關性,非二硫共價鍵與蛋白質二級結構均無明顯相關性。

