大菱鲆水通道蛋白(AQP1、AQP3)以及離子通道蛋白(CFTR、NHE1)對低鹽脅迫的響應*
張金生 劉志峰 馬愛軍 崔文曉 曲江波
大菱鲆水通道蛋白(AQP1、AQP3)以及離子通道蛋白(CFTR、NHE1)對低鹽脅迫的響應*
張金生1,2,3劉志峰1,2,3馬愛軍1,2,3①崔文曉1,2,3曲江波4
(1. 中國水產科學研究院黃海水產研究所 山東省海洋漁業(yè)生物技術與遺傳育種重點實驗室青島市海水魚類種子工程與生物技術重點實驗室 青島 266071;2. 上海海洋大學水產與生命學院 上海 201306;3. 青島海洋科學與技術國家實驗室海洋生物學與生物技術功能實驗室 青島 266071;4. 煙臺開發(fā)區(qū)天源水產有限公司 煙臺 264003)
在魚類適應環(huán)境鹽度變化的過程中,鰓、腎、腸是主要的滲透調節(jié)器官,而水通道蛋白()、囊性纖維化跨膜傳導調節(jié)因子()、鈉氫交換體()又是這些器官中重要的滲透調節(jié)基因。為研究、、、在大菱鲆()低鹽脅迫過程中的滲透調節(jié)功能,本研究采用熒光定量PCR技術,對4種基因在鹽度5和鹽度10下大菱鲆鰓、腎、腸中表達量隨時間的變化進行檢測。結果顯示,表達量在鰓中極少(<0.05),在腎和腸中較高,低鹽脅迫下,鹽度5組和鹽度10組在鰓中的表達量無顯著變化,在腎和腸中均顯著上升(<0.05)。表達量在腎中極少(<0.05),在鰓中較高,在腸中較少,低鹽脅迫下,鹽度5組和鹽度10組在腎中的表達量無顯著變化,在鰓和腸中均顯著上升(<0.05)。表達量在腎中極少,在鰓中較高,在腸中較少,低鹽脅迫下,鹽度5組和鹽度10組在腎中的表達量無顯著變化,在鰓和腸中均顯著下降(<0.05)。在鰓和腸中表達量較少,在腎中較高,低鹽脅迫下,鹽度5組和鹽度10組在鰓中的表達量無顯著變化,在腎和腸中均顯著上升(<0.05)。這些結果表明,4種基因表達水平因組織、鹽度和時間的不同而不同,反映了這4種基因的功能特異性;在低鹽脅迫下,4種基因積極響應,表達量均發(fā)生不同程度的變化,表明、、和在大菱鲆低鹽環(huán)境適應中可能具有潛在的重要作用。另外,本研究結果可為大菱鲆半咸水養(yǎng)殖和淡化養(yǎng)殖提供理論依據,同時為培育適應低鹽環(huán)境大菱鲆良種提供理論和技術支撐。
大菱鲆;低鹽脅迫;水通道蛋白;囊性纖維化跨膜傳導調節(jié)因子;鈉氫交換體;熒光定量PCR
鹽度是影響魚類生長代謝等各種生理活動的重要環(huán)境因素,為適應滲透壓不斷變化的自然環(huán)境以及維持自身滲透壓穩(wěn)定,魚類進化出一系列的滲透壓調節(jié)機制。當外界滲透壓變化時,魚體內鰓、腎、腸等主要滲透調節(jié)器官和組織積極響應并調節(jié)機體水鹽代謝平衡,維持體內滲透壓穩(wěn)定。為深入了解魚類的滲透壓調節(jié)機理,國內外學者對此進行了大量研究,在滲透器官的形態(tài)結構(Yang, 2017)、離子轉運過程(Seale, 2014)、激素調節(jié)(Tipsmark, 2016)等方面取得許多成果。研究表明,魚類對環(huán)境鹽度變化的適應是由許多水通道蛋白(趙超平等, 2018)和離子通道蛋白(馬金武等, 2016)共同作用來實現。
AQPs是一組跨膜蛋白家族,作為水分的傳輸通道,允許水在細胞膜自由流動,對維持參與滲透調節(jié)和體液穩(wěn)態(tài)的器官中的水分平衡具有重要作用(Gonen, 2006)。目前,已經發(fā)現并報道了13種(~),其中,廣泛存在于各種生物體內并發(fā)揮重要作用,并得到最為廣泛和深入的研究。在魚類方面,第1個被克隆出的同系物來自日本鰻鱺(),在日本鰻鱺體內,主要在腸道中表達,且海水鰻魚腸道中mRNA的表達水平高于淡水鰻魚(Aoki, 2003),而在刀鱭()鰓、腎、腸、腦中的表達水平均較高,高鹽脅迫后,鰓中的表達水平下降,而在腎和腸中升高(王美垚等, 2017)。由此可見,在不同魚類和組織中具有差異性表達,其表達量也與鹽度密切相關。
與傳統(tǒng)水通道蛋白AQP1的功能有所不同,AQP3除運輸水分的主要功能外,對非離子小分子溶質(如尿素和甘油)也具有運輸作用,但不能運輸較大的分子(如氨基酸和糖)(Ishibashi, 1994)。在硬骨魚類中,首先在歐洲鰻鱺()中發(fā)現(Cutler, 2000),隨后,克隆了日本鰻鱺(Tse, 2006)、底鳉() (Jung, 2012)等的cDNA序列,并研究了其功能作用。在魚類體內分布廣泛,在鰓、腎、腸、腦等組織中均有表達,但其表達范圍和表達水平因魚類和組織的不同而差異顯著(甘遠迪, 2014; Cutler, 2002; Hirata, 2003)。
眾多學者已經證實,鈉氫交換體() (Watanabe, 2008; Choe, 2005)以及囊性纖維化跨膜傳導調節(jié)因子() (Davidson, 2000; Chen, 2001)與魚類滲透調節(jié)極具相關性。在魚類方面,家族成員-已被廣泛研究(Edwards, 2010; Pedersen, 2003; Claiborne, 1999)。關于魚類的研究主要集中在酸堿平衡的調節(jié),但越來越多的研究認為,在魚類的滲透調節(jié)方面也具有重要作用。Smith(1930)首先提出海水魚類鰓中氯化鈉和酸/堿運動之間的聯系,作為離子和滲透調節(jié)的潛在機制。Edwards等(2010)研究發(fā)現,底鳉不僅在酸中毒后的表達發(fā)生變化,在不同的鹽度環(huán)境下的表達也發(fā)生相應的變化。淡水適應的莫桑比克羅非魚() (Watanabe, 2008)和大西洋黃貂魚() (Choe, 2005)鰓中3表達水平大約是海水適應魚的2倍。這些結果表明,可能參與滲透調節(jié),特別是在魚類適應低鹽環(huán)境時發(fā)揮重要作用。
CFTR是ATP結合轉運蛋白質中唯一的離子通道蛋白,與Cl–的轉運相關,為Cl–跨上皮細胞運動提供選擇性通道,對于跨上皮的鹽類轉運、液體流動和離子濃度調節(jié)等具有重要作用(周建華等, 2015)。不同鹽度環(huán)境中的魚類分布和表達量具有顯著差異,適應海水環(huán)境的鳉魚鰓中CFTR集中分布于氯細胞的頂室頂膜,適應淡水的鳉魚鰓中CFTR集中分布于鰓上皮氯細胞和扁平細胞的基底外側膜,硬骨魚類從低鹽到高鹽環(huán)境適應過程中,CFTR在緩慢地從細胞基底外側位置重新分布到頂端膜的同時,離子分泌能力也會增強(Marshall, 2002a、b)。當鳉魚和羅非魚從海水移至淡水后,基因表達量明顯下降(Scott, 2004; Hiroi, 2005),日本鰻鱺經海水馴化后,基因表達量增加(Tse, 2006)。這些研究表明,廣鹽性硬骨魚類在高滲環(huán)境中的表達量遠大于低滲環(huán)境,在魚類適應高鹽環(huán)境時具有重要作用,是維持魚體Cl–平衡的重要調控途徑。
大菱鲆()俗稱“多寶魚”,是原產于歐洲沿海的一種名貴比目魚,1992年引進我國后,逐漸成為全國沿海地區(qū)尤其是北方地區(qū)主要的海水養(yǎng)殖經濟種類。同時,隨著養(yǎng)殖業(yè)的發(fā)展,為了適應環(huán)保需要,以及滿足內陸城市的消費需求,促使大菱鲆養(yǎng)殖區(qū)域逐漸向灘涂和內陸地區(qū)進行推廣,因此,對大菱鲆耐低鹽性狀的要求更高。但目前為止,國內有關大菱鲆滲透調節(jié)方面的研究卻鮮有報道。因此,本研究根據從大菱鲆基因組中得到的、、和基因序列,采用熒光定量PCR技術分析了大菱鲆鰓、腎、腸組織中的4種基因在不同鹽度脅迫下(鹽度5和鹽度10)隨時間的表達量變化,分析4種基因在低鹽脅迫下發(fā)揮的滲透調節(jié)功能,研究結果可為大菱鲆半咸水養(yǎng)殖和低鹽條件養(yǎng)殖提供理論依據,同時為培育適應低鹽環(huán)境大菱鲆良種提供理論和技術支撐。
1 材料與方法
1.1 實驗魚
實驗所用大菱鲆和養(yǎng)殖實驗場地均由國家大菱鲆良種場山東煙臺天源水產有限公司提供。隨機挑選體重為(300±20) g的健康大菱鲆300尾,分別于3個1.5 m3容量的實驗桶內暫養(yǎng)7 d,暫養(yǎng)期間水溫平衡在14℃~15℃,每天少量投餌1次,換水1次。暫養(yǎng)結束后停止喂食24 h。
1.2 鹽度脅迫實驗與取樣
急性鹽度脅迫實驗分為3個鹽度組,即鹽度30組(對照組)、鹽度10組和鹽度5組(實驗組),每個鹽度組設3個重復。鹽度30組直接使用深井海水,鹽度10和鹽度5組海水是由深井海水和淡水勾兌稀釋而成。每個實驗組將暫養(yǎng)的30尾大菱鲆分別放入0.4 m3容量的實驗桶中,實驗桶內水溫保持在14℃~15℃,溶氧大于6 mg/L,自然光照,實驗期間不投餌,無死亡現象。
每個鹽度組分別在1、12和24 h共3個時間點隨機挑選3尾魚(3個重復,共9條魚),MS222麻醉后迅速采取鰓、腸和腎組織,放入凍存管后立即在液氮中保存?zhèn)溆谩S捎诿{迫時間較短,對照組僅在實驗開始時進行取樣(暫養(yǎng)7 d停食24 h),取樣方法同上。
1.3 總RNA提取及反轉錄
RNA提取和cDNA合成過程使用天根生化科技有限公司提供的RNA提取試劑盒(DP431)和反轉錄試劑盒(KR116-02),實驗操作嚴格按照實驗說明書進行。使用NanoDrop 2000(Thermo)和凝膠電泳檢測RNA質量和濃度。使用檢測合格的RNA進行cDNA合成,合成產物稀釋后放入–80℃冰箱保存?zhèn)溆谩?/p>
1.4 熒光定量的引物設計合成與檢測
根據大菱鲆基因的、、和的序列,使用Primer 5.0軟件設計上、下游引物,引物合成后進行PCR反應,對反應產物進行序列測定,以檢測合成引物的特異性,引物合成以及PCR產物測序均在生工生物工程(上海)有限公司進行。對測序正確的引物,使用標準曲線的方法對其質量及合格程度進行檢測。定量用引物表見表1。
1.5 實時熒光定量PCR
使用大菱鲆18S RNA作為內參,通過熒光定量PCR,檢測在1、12和24 h的鰓、腎、腸中、、和基因的表達水平。具體操作方法如下:用反轉錄的cDNA作為模板以及檢測合格的特異性引物進行qRT-PCR反應,反應根據北京全式金生物技術有限公司熒光定量PCR試劑盒(AQ131-04)說明書在Applied Biosystems-Step One Plus PCR儀上進行。qRT-PCR的反應體系為20 μl:2 μl模板cDNA, 10 μl SuperMix(2×),6.8 μl RNase-Free Water,上、下游引物各0.4 μl,0.4 μl ROX Reference Dye,擴增反應程序:94℃ 30 s;94℃ 5 s,60℃ 30 s,40個循環(huán)。
表1、、和qRT-PCR引物序列

Tab.1 Primers of AQP1, AQP3, CFTR and NHE1 in qRT-PCR
1.6 數據分析
數據使用DDC法(2–DD)進行分析,數據統(tǒng)計分析采用SPSS 23.0軟件,結果用平均值±標準差(Mean±SD)表示。用Origin 8.6軟件作圖。使用Levene檢驗方差的均勻性。采用單因素方差分析法(One-way ANOVA)檢測平均值之間的差異,然后采用Tukey事后檢驗法對平均值進行多次比較。用Duncan檢驗對數據進行統(tǒng)計學分析(<0.05為顯著水平)。
2 結果
2.1 水通道蛋白AQP1和AQP3基因在不同鹽度脅迫下的表達變化
采用qRT-PCR檢測了不同鹽度脅迫下和基因在大菱鲆鰓、腎、腸中表達量隨時間的變化,結果顯示,在腎和腸中的表達量較高,在鰓中的表達量極小,顯著低于腎和腸(<0.05)。低鹽脅迫后,在鰓中,鹽度5組和鹽度10組的表達量在0~24 h內均無顯著變化;在腎中,鹽度5組和鹽度10組的表達量均呈上升趨勢,鹽度5組在各時間點均顯著高于鹽度10組(<0.05);在腸中,鹽度5組和鹽度10組的表達量呈先上升后下降的趨勢,在12 h達到峰值,鹽度5組在各時間點均顯著高于鹽度10組(<0.05)(圖1)。

圖1 低鹽脅迫下大菱鲆鰓、腎、腸中AQP1基因在各時間點的表達量變化
G:鰓;K:腎;I:腸;h:小時。不同的字母代表組間差異顯著(0.05)。下同
G: Gill; K: Kidney; I: Intestine; h: Hour. Different letters represented significant differences between groups (0.05). The same as below
與的表達特點不同,在鰓和腸中的表達量較高,而在腎中的表達量極低,顯著低于鰓和腸(0.05)。低鹽脅迫后,在鰓中,鹽度5組的表達量在0~24 h內呈先上升后下降的趨勢,在12 h達到峰值,鹽度10組的表達量在0~24 h呈上升趨勢,鹽度5組在24 h顯著低于鹽度10組(<0.05);在腎中,鹽度5組和鹽度10組的表達量無顯著差異;在腸中,鹽度5組的表達量在0~24 h內呈先上升后下降的趨勢,在12 h達到峰值,鹽度10組腸中的表達量無顯著變化,5鹽度組在第1、12小時均顯著高于鹽度10組(<0.05)(圖2)。
2.2 NHE1基因在不同鹽度脅迫下的表達變化
采用qRT-PCR技術檢測了不同鹽度脅迫下基因在大菱鲆鰓、腎、腸中表達量隨時間的變化,結果顯示,在腎中的表達量較高,在鰓和腸中的表達量較低。低鹽脅迫后,在鰓中,鹽度5組的表達量在0~24 h內顯著上升,鹽度10組的表達量在0~24 h內無顯著變化,鹽度5組在各時間點的鰓中表達量均顯著高于鹽度10組(<0.05);在腸中,鹽度5組表達量在1~24 h內顯著上升,鹽度10組表達量在0~24 h內無顯著變化,鹽度5組在第12、24小時顯著高于鹽度10組(<0.05);在腎中,鹽度5組的表達量在1~24 h內大幅上升,10鹽度組在0~24 h內小幅上升,鹽度5組在第12、24小時顯著高于鹽度10組(<0.05)(圖3)。

圖2 低鹽脅迫下大菱鲆鰓、腎、腸中AQP3基因在各時間點的表達量變化
2.3 CFTR基因在不同鹽度脅迫下的表達變化
采用qRT-PCR技術檢測了不同鹽度脅迫下基因在大菱鲆鰓、腎、腸中表達量隨時間的變化,結果顯示,基因在鰓中的表達量最高,顯著高于腎和腸(<0.05),在腎中基本不表達,在腸中的表達量較低。低鹽脅迫后,在鰓中,鹽度5組和鹽度10組的表達量在0~12 h大幅下降,在12~24 h內無顯著變化,鹽度5組在第1小時顯著低于鹽度10組(<0.05);在腎中,鹽度5組和鹽度10組的表達量在0~24 h內基本保持不變;在腸中,鹽度5組表達量在0~1 h內下降,在1~24 h內無顯著變化,鹽度10組的表達量在0~24 h內呈先下降后上升的趨勢,在12 h達到最低值,在24 h恢復,鹽度5組在24 h顯著低于鹽度10組(<0.05)(圖4)。
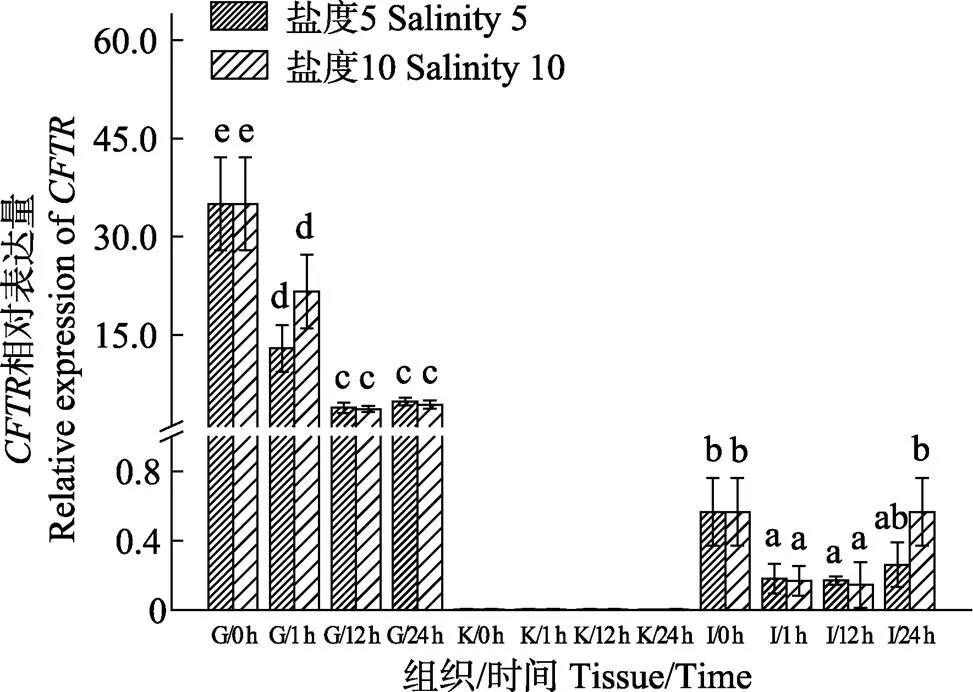
圖4 低鹽脅迫下大菱鲆鰓、腎、腸中CFTR基因在各時間點的表達量變化
3 討論
鰓、腎、腸作為主要滲透調節(jié)器官,當鹽度發(fā)生變化時,鰓、腎、腸等滲透器官可通過改變形態(tài)結構(Yang, 2017)、離子通道(Seale, 2014)以及離子轉運蛋白的表達和激素分泌水平(Tipsmark, 2016)等來調整體內外滲透壓的動態(tài)平衡。鰓可在高滲環(huán)境中分泌Cl–,在低滲環(huán)境中吸收Na+和Cl–,腸道可在高滲環(huán)境中排出過多的離子以降低所吞海水的滲透壓,進而間接地促進上皮細胞吸收大量的海水以補充丟失的水分。在低滲環(huán)境中,腸道則會吸收過多的水分。腎臟在高滲環(huán)境中重吸收水分并產生較少的高滲尿液,在低滲環(huán)境中吸收各種離子,排出大量稀薄的尿液。可見,這些滲透器官在發(fā)揮自己功能作用的同時又相互合作,共同進行滲透壓的調節(jié),維持機體滲透壓的正常穩(wěn)定。因此,本研究選取主要滲透調節(jié)器官鰓、腎和腸,檢測大菱鲆、、和在低鹽脅迫下的表達變化,分析這些基因在大菱鲆滲透調節(jié)過程中的作用。
3.1 水通道蛋白AQP1和AQP3基因對低鹽脅迫的響應分析
AQPs是一組跨膜蛋白家族,其作為水分的傳輸通道,允許水在細胞膜自由流動,對維持滲透調節(jié)和體液穩(wěn)態(tài)相關器官中的水分平衡具有重要作用(Gonen, 2006)。目前,和分別在日本鰻鱺(Aoki, 2003)、刀鱭(王美垚等, 2017)和歐洲鰻鱺(Cutler, 2000)、底鳉(Jung, 2012)等硬骨魚類中被發(fā)現研究并報道,證實了及廣泛分布于魚類的各種滲透調節(jié)器官,其表達調控在魚體水分運輸調節(jié)中起到重要作用。本實驗結果顯示,基因在腎和腸中表達量較高,在鰓中表達量極少,與暗紋東方鲀() (Jeong, 2014)的研究結果一致。低鹽脅迫后,在鰓中表達量變化不顯著,推測可能在大菱鲆鰓中的滲透調節(jié)功能有限。在腎和腸中的表達量顯著升高,這與黑鯛()和歐洲鰻鱺的研究結果相一致,當海水中培養(yǎng)的黑鯛(An, 2008)轉移至10%海水和淡水時,基因在腎和腸中的表達量顯著增加,對黃鰻(歐洲鰻鱺)(Martinez, 2012)進行高鹽脅迫時,腎中的表達量顯著下降。而卵形鯧鲹() (趙超平等, 2018)和暗紋東方鲀(Jeong, 2014)腎和腸中的表達量在高滲脅迫下上升,在低滲脅迫下降低,這與本研究結果相反。通常在高滲條件下,魚類吞咽高滲水溶液,通過腸和腎對高滲液的吸收以及腎對尿液的重吸收來補充魚體失水,這些過程需要較高水平的水運輸,因此,需要的表達量增加。大菱鲆在低滲脅迫后,的增加看似難以理解,但實際上腎和腸都可以作為吸收或分泌器官來發(fā)揮滲透調節(jié)作用,因此,在器官中的差異性表達可能是根據魚類適應環(huán)境變化的需要來發(fā)揮其吸收或分泌的作用。當水環(huán)境滲透壓降低時,魚類將面臨大量水分滲透進體內,進而需要腎產生大量的低滲尿液以及腸排出更多的水分,因此,大菱鲆在低滲條件下中的表達量上升可能是參與了腎腸組織的排水過程,是一種應對低滲環(huán)境的科學表達模式(An, 2008)。此外,鹽度10組,腎中在第12小時有上升趨勢,隨后趨于穩(wěn)定,而鹽度5組在各時間點表達量均顯著升高,可能是因為大菱鲆具有良好的滲透調節(jié)能力,因此,鹽度10組在第12小時升高表達量后足以應對鹽度為10的環(huán)境,而鹽度5組則需要繼續(xù)升高表達量來應對更低鹽度的環(huán)境。在腸中,鹽度5組和鹽度10組表達量均呈先上升后下降的趨勢,推測是因為大菱鲆受到低鹽刺激后,腸道中大量表達,增加對水的通透性,有利于水的排出,當大菱鲆體內水鹽趨于平衡時,表達量回落。
與的表達模式不同,主要在鰓中表達,在腸中表達量較少,在腎中幾乎不表達,與歐洲鰻鱺(Cutler, 2000)和日本鰻鱺(Kim, 2010)的表達模式一致。低鹽脅迫后,鹽度10組和鹽度5組在鰓和腸中表達量均有不同程度的上升,在腎中無明顯變化。研究發(fā)現,在鹽度脅迫下,尼羅羅非魚()鰓中的表達量隨鹽度的上升而下降,隨鹽度的下降而上升(甘遠迪, 2014),海鱸()(Giffard-Mena, 2007)和銀海鯛() (Deane, 2006)在低滲環(huán)境下,鰓中表達量顯著高于高滲環(huán)境,這些研究結果均與本研究結果基本一致。眾所周知,鰓組織直接接觸周圍環(huán)境介質,海水魚類將面臨因滲透梯度較大而產生高通量水分子流的風險,因此,從滲透調節(jié)的角度來看,生物體選擇將鰓上皮的透水性保持在較低限度,以維持體內滲透穩(wěn)態(tài),是一種科學的適應模式(王美垚等, 2017)。對于鰓中表達量在低滲條件下高于高滲條件的現象,有學者認為,在淡水條件下,鰓上皮對水的通透性高(Kammerer, 2010),大量水分進入魚體內,鰓上皮細胞可將由細胞頂端進入的水從基底側排出,因此,增加的表達量來促進水分的排出,可防止上皮細胞膨脹破裂,維持體內滲透平衡(Cutler, 2001)。此外,有研究通過免疫組化顯示,存在于歐洲鰻鱺鰓中的氯細胞、初級鰓瓣的基底上皮細胞以及鰓弓上皮細胞中,在歐洲鰻鱺海水適應的過程中,氯細胞內的表達量不變,而初級鰓瓣的基底上皮細胞以及鰓弓上皮細胞中的顯著減少,這可能是導致mRNA和蛋白在海水環(huán)境中下調的原因(Cutler, 2007)。令人感到意外的結果是,鹽度脅迫的第12小時,鹽度5組和鹽度10組在鰓中的表達量均顯著升高,在第24小時鹽度5組表達量急劇下降,而鹽度10組繼續(xù)上升,推測原因可能是從高鹽環(huán)境轉移至低鹽環(huán)境后出現了一定的滲透調節(jié)失衡所致(趙超平等, 2018;An, 2008)。在腸中,鹽度5組表達量在第1、12小時顯著上升后,在第24小時恢復,鹽度10組的表達量也在第12小時輕度上調后,在第24小時恢復。推測是因為大菱鲆受到低鹽刺激后,腸道中大量表達,增加對水的通透性,有利于水的排出,而后大菱鲆體內水鹽趨于平衡,表達量回落。
3.2 離子通道蛋白NHE1對低鹽脅迫的響應分析
NHE是一種雙向離子交換載體蛋白,通常位于細胞的頂膜或基底膜外側,具有催化細胞內H+和細胞外Na+的電中性交換的作用。Edwards等(2010)等研究發(fā)現,底鳉不僅在酸中毒后的表達發(fā)生變化,在不同的鹽度環(huán)境下的表達也會發(fā)生相應的變化。這些結果表明,可能參與滲透調節(jié),特別是在魚類適應低鹽環(huán)境時發(fā)揮了重要作用。本研究結果顯示,在鰓中表達量較多,在腎和腸中表達量較少,顯著低于鰓中。低鹽脅迫后,在鰓、腎、腸中的表達量均顯著升高,推測在低滲條件下參與了滲透調節(jié)過程。有研究顯示,淡水適應的莫桑比克羅非魚(Watanabe, 2008)和大西洋黃貂魚(Choe, 2005)鰓中的3表達水平均顯著高于海水適應魚,三疣梭子蟹() (馬金武等, 2016)在低鹽脅迫下,在鰓中的表達量上升,在高鹽脅迫下,鰓中表達量下降。這些研究結果與本研究結果相一致,表明可能具有從低離子環(huán)境中吸收鈉的功能(Choe, 2005)。此外,鹽度5組各組織中的表達量在大多數時間點顯著高于鹽度10組,推測低鹽環(huán)境可能對鰓、腎、腸中的表達具有促進作用,在極低鹽的環(huán)境中作用更明顯(馬金武等, 2016)。另外,鹽度5組大菱鲆鰓中的表達量在脅迫后第1小時就顯著上升,而在腎和腸中的表達量在第12小時才開始增加,這可能是因為鰓作為與水環(huán)境直接接觸的滲透調節(jié)器官,當水環(huán)境鹽度劇烈變化時,最先響應鹽度脅迫進行滲透調節(jié),以維持魚體滲透壓穩(wěn)定。而腎和腸則需要根據魚體吞咽進來的水來判定鹽度的變化,因此響應時間有所延遲,不過這種猜測還需進一步的驗證(趙超平等, 2018)。
3.3 離子通道蛋白CFTR對低鹽脅迫的響應分析
CFTR是一種與Cl–的轉運相關的離子通道蛋白,為Cl–跨上皮細胞運動提供選擇性通道,對于跨上皮的鹽類轉運、液體流動和離子濃度調節(jié)等具有重要作用(周建華等, 2015)。大量研究已表明,廣鹽性硬骨魚類在高滲環(huán)境中的表達量遠大于低滲環(huán)境,在魚類適應高鹽環(huán)境時具有重要作用,是維持魚體Cl–平衡的重要調控途徑(Hiroi, 2005; Tse, 2006)。本結果顯示,主要在鰓中表達,表達量遠高于腸和腎,在腸中表達量較少,在腎中基本不表達。這與舌齒鱸()的研究結果一致,無論是在海水或淡水環(huán)境中,在舌齒鱸鰓中的表達量均顯著高于腎和腸(Bodinier, 2009)。在海水條件下,魚類通過吞咽海水,利用腸和腎對高滲液的吸收以補充水分,然后經過鰓將鹽分排出體外,因此,在鰓中的大量表達有助于Cl–的排出。低鹽脅迫后,本研究中鹽度10組和鹽度5組在鰓和腸中的表達量顯著降低,在腎中的表達量無明顯變化,與底鳉(Scott, 2004)的研究結果相一致,當底鳉從鹽度10海水分別移至淡水和海水時,底鳉的鰓中的表達量分別顯著降低和增加,將舌齒鱸從海水轉移至淡水時,鰓和腸中的表達量均顯著降低。海水硬骨魚類通過吞飲海水,利用腸道吸收水和離子,并通過鰓和皮膚上皮的氯細胞將過多的離子分泌出體外(Singer, 1998)。因此,當外部環(huán)境鹽度突然下降時,魚體積極響應,促使鰓和腸中表達量減少,防止魚體內離子大量流失而導致體內水鹽失衡。此外,在第1小時鹽度10組的鰓中,表達量顯著高于鹽度5組可能是因為鹽度5組的鹽度更低,導致表達量下降更顯著。
本研究利用qRT-PCR技術,檢測了大菱鲆鰓、腎、腸中、、、四種基因在不同鹽度脅迫下不同時間點的表達量,結果顯示,、、三種基因的表達量在低鹽脅迫下總體呈上升趨勢,而基因的表達量在低鹽脅迫下總體呈下降趨勢,這4種基因表達水平因組織、鹽度和時間的不同而不同,反映了這4種基因的功能特異性。在低鹽脅迫下,4種基因積極響應,且表達量均發(fā)生不同程度的變化,因此,、、和在大菱鲆低鹽環(huán)境適應中可能具有潛在的重要作用。本研究可為在分子水平上闡述大菱鲆的滲透調節(jié)機制提供理論依據,同時為半咸水養(yǎng)殖和低鹽條件下養(yǎng)殖提供理論支撐。
An KW, Kim NN, Choi CY. Cloning and expression of aquaporin 1 and arginine vasotocin receptor mRNA from the black porgy,: Effect of freshwater acclimation. Fish Physiology and Biochemistry, 2008, 34(2): 185–194
Aoki M. Intestinal water absorption through aquaporin 1 expressed in the apical membrane of mucosal epithelial cells in seawater-adapted Japanese eel. Journal of Experimental Biology, 2003, 206(19): 3495–3505
Bodinier C, Lorin-Nebel C, Charmantier G,. Influence of salinity on the localization and expression of thechloride channel in the ionocytes of juvenileexposed to seawater and freshwater. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2009, 153(3): 345–351
Chen JM, Cutler C, Jacques C,. A combined analysis of the cystic fibrosis transmembrane conductance regulator: Implications for structure and disease models. Molecular Biology and Evolution, 2001, 18(9): 1771–1788
Choe KP, Kato A, Hirose S,.3 in an ancestral vertebrate: Primary sequence, distribution, localization, and function in gills. American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2005, 289(5): R1520
Claiborne JB, Blackston CR, Choe KP,. A mechanism for branchial acid excretion in marine fish: Identification of multiple Na+/H+antiporter isoforms () in gills of two seawater teleosts. Journal of Experimental Biology, 1999, 202: 315–324
Cutler CP, Cramb G. Branchial expression of an aquaporin(-3) homologue is downregulated in the European eelfollowing seawater acclimation. Journal of Experimental Biology, 2002, 205(17): 2643–2651
Cutler CP, Cramb G. Molecular physiology of osmoregulation in eels and other teleosts: The role of transporter isoforms and gene duplication. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2001, 130(3): 551–564
Cutler CP, Cramb G. Water transport and aquaporin expression in fish, molecular biology and physiology of water and solute transport. Springer US, 2000, 431–441
Cutler CP, Martinez AS, Cramb G. The role of aquaporin 3 in teleost fish. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2007, 148(1): 82– 91
Davidson H, Taylor MS, Doherty A,. Genomic sequence analysis ofand flanking genes in a 60 kb region conserving synteny with 800 kb of human chromosome 7. Genome Research, 2000, 10(8): 1194–1203
Deane EE, Woo NYS. Tissue distribution, effects of salinity acclimation, and ontogeny of aquaporin 3 in the marine teleost, silver sea bream (). Marine Biotechnology (New York), 2006, 8(6): 663–671
Edwards SL, Wall BP, Morrison-Shetlar A,. The effect of environmental hypercapnia and salinity on the expression of-like isoforms in the gills of a euryhaline fish (). Journal of Experimental Zoology Part A Ecological Genetics and Physiology, 2010, 303A(6): 464–475
Gan YD. cDNA cloning of aquaporin 3 in,and tissue expression patterns under salinity stresses. Master′s Thesis of Shanghai Ocean University, 2014 [甘遠迪. 薩羅羅非魚、尼羅羅非魚cDNA序列克隆及鹽度脅迫下組織表達特征. 上海海洋大學碩士研究生學位論文, 2014]
Giffard-Mena I, Boulo V, Aujoulat F,. Aquaporin molecular characterization in the sea-bass (): The effect of salinity onandexpression. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2007, 148(2): 430–444
Gonen T, Walz T. The structure of aquaporins. Quarterly Reviews of Biophysics, 2006, 39(4): 361–396
Hirata T, Kaneko T, Ono T,. Mechanism of acid adaptation of a fish living in a pH 3.5 lake. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2003, 284(5): R1199–R1212
Hiroi J, Mccormick SD, Ohtanikaneko R,. Functional classification of mitochondrion-rich cells in euryhaline Mozambique tilapia () embryos, by means of triple immunofluorescence staining forNa/K- ATPase,Na/K/2Cl cotransporterandanion channel. Journal of Experimental Biology, 2005, 208(11): 2023–2036
Ishibashi K, Sasaki S, Fushimi K,. Molecular cloning and expression of a member of the aquaporin family with permeability to glycerol and urea in addition to water expressed at the basolateral membrane of kidney collecting duct cells. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(14): 6269–6273
Jeong SY, Kim JH, Lee WO,. Salinity changes in the anadromous river pufferfish,, mediate gene regulation. Fish Physiology and Biochemistry, 2014, 40(1): 205–219
Jung D, Sato JD, Shaw JR,. Expression of aquaporin 3 in gills of the Atlantic killifish (): Effects of seawater acclimation. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2012, 161(3): 320–326
Kammerer BD, Cech JJ, DietmarKültz. Rapid changes in plasma cortisol, osmolality, and respiration in response to salinity stress in tilapia (). Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2010, 157(3): 260–265
Kim YK, Watanabe S, Kaneko T,. Expression of aquaporins 3, 8 and 10 in the intestines of freshwater- and seawater- acclimated Japanese eels. Fisheries Science (Tokyo), 2010, 76(4): 695–702
Ma JW, Lü JJ, Liu P,. Na+/H+-exchanger in swimming Crab (): Cloning, characterization andmRNA expression under salinity stress. Acta Hydrobiologica Sinica, 2016, 40(5): 902–907 [馬金武, 呂建建, 劉萍, 等. 三疣梭子蟹Na+/H+-exchanger基因克隆鑒定及在鹽度脅迫下的表達分析. 水生生物學報, 2016, 40(5): 902–907]
Marshall WS, Lynch EM, Cozzi RRF. Redistribution of immunofluorescence ofanion channel and NKCC cotransporter in chloride cells during adaptation of the killifishto sea water. Journal of Experimental Biology, 2002a, 205(9): 1265–1273
Marshall WS, Singer TD. Cystic fibrosis transmembrane conductance regulator in teleost fish. Biochimica et Biophysica Acta Biomembranes, 2002b, 1566(1): 16–27
Martinez AS, Cutler CP, Wilson GD,. Cloning and expression of three aquaporin homologues from the European eel (): Effects of seawater acclimation and cortisol treatment on renal expression. Biology of the Cell, 2012, 97(8): 615–627
Pedersen SF, King SA, Rigor RR,. Molecular cloning offrom winter flounder RBCs: Activation by osmotic shrinkage, cAMP, and calyculin A. Renal Physiology, 2003, 284: C1561–1576
Scott GR. Changes in gene expression in gills of the euryhaline killifishafter abrupt salinity transfer. American Journal of Physiology: Cell Physiology, 2004, 287(2): C300–C309
Seale AP, Stagg JJ, Yamaguchi Y,. Effects of salinity and prolactin on gene transcript levels of ion transporters, ion pumps and prolactin receptors in Mozambique tilapia intestine. General Comparative Endocrinology, 2014, 206(9): 146–154
Singer TD, Tucker SJ, Marshall WS,. A divergenthomologue: Highly regulated salt transport in the euryhaline teleost. American Journal of Physiology, 1998, 274(1): 715–723
Smith HW. The absorption and excretion of water and salts by marine teleosts. American Journal of Physiology, l930: 419–427
Tipsmark CK, Breves JP, Rabeneck DB,. Regulation of gill claudin paralogs by salinity, cortisol and prolactin in Mozambique tilapia (). Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2016, 199: 78–86
Tse WK, Au DW, Wong CK. Characterization of ion channel and transporter mRNA expressions in isolated gill chloride and pavement cells of seawater acclimating eels. Biochemical and Biophysical Research Communications, 2006, 346(4): 1181–1190
Wang MY, Yang J, Xu P,. Molecular cloning and expression analysis of aquaporin-1 from theunder high-salinity conditions. Journal of Fishery Sciences of China, 2017, 24(3): 449–458 [王美垚, 楊健, 徐跑, 等. 刀鱭水通道蛋白1的分子克隆及高鹽作用下的表達分析. 中國水產科學, 2017, 24(3): 449–458]
Watanabe S, Niida M, Maruyama T,. Na+/H+exchanger isoform 3 expressed in apical membrane of gill mitochondrion-rich cells in Mozambique tilapia. Fisheries Science, 2008, 74
Yang SH, Tsai JD, Kang CK,. The ultrastructural characterization of mitochondria-rich cells as a response to variations in salinity in two types of teleostean pseudobranch: Milkfish () and Mozambique tilapia (). Journal of Morphology, 2017, 278(3): 390–402
Zhao CP, Guo HY, Zhang J,. Molecular characteristics and expression analysis ofa fromunder acute salinity stress. South China Fisheries Science, 2018, 14(4): 56–65 [趙超平, 郭華陽, 張健, 等. 卵形鯧鲹a分子特征及其對急性鹽度脅迫的表達響應. 南方水產科學, 2018, 14(4): 56–65]
Zhou JH, Pu JY. Current status and prospects of chloride channel-related kidney diseases. Journal of Clinical Nephrology, 2015, 15(11): 644–649 [周建華, 蒲金赟. 氯離子通道相關腎臟疾病的現狀和展望. 臨床腎臟病雜志, 2015, 15(11): 644–649]
Response of Aquaporin (AQP1, AQP3) and Ion Channel Protein(CFTR, NHE1) of Turbot () to Low-Salinity Stress
ZHANG Jinsheng1,2,3, LIU Zhifeng1,2,3, MA Aijun1,2,3①, CUI Wenxiao1,2,3, QU Jiangbo4
(1.Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Shandong Key Laboratory of Marine Fisheries Biotechnology and Genetic Breeding; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Qingdao 266071;2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306; 3.Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071; 4.Yantai Tianyuan Aquatic Limited Corporation, Yantai 264003)
Salinity is an important environmental factor affecting the growth and metabolism of fish. The gill, kidney, and intestine are the main osmoregulatory organs involved in the adaptation of fish to changes in environmental salinity, and(), the(), and theNa/H exchanger() are important osmoregulatory genes in these organs. To study the osmoregulatory function of,,, andin turbots () under low salinity stress, their expressions in the gill, kidney, and intestine of turbots at salinity levels of 5 and 10 (5- and 10-salinity groups, respectively) were detected by quantitative real-time PCR. The results showed that the expression ofwas very low in the gill but high in the kidney and intestine. Under low salinity stress, the expression ofin the gill did not change significantly in either of the salinity groups, but it increased significantly in the kidney and intestine (<0.05). The expression ofwas very low in the kidney, high in the gill, and low in the intestine. Under low salinity stress, the expression ofin the kidney did not change significantly in either of the salinity groups, but it increased significantly in the gill and intestine (<0.05). Similarly, the expression ofwas very low in the kidney, high in the gill, and low in the intestine. Under low salinity stress, the expression ofin the kidney did not change significantly in either of the salinity groups, but it decreased significantly in the gill and intestine (<0.05). The expression ofwas low in the gill and intestine but high in the kidney. Under low salinity stress, the expression ofin the gill did not change significantly in either of the salinity groups, but it increased significantly in the kidney and intestine (<0.05). These results indicate that the expressions of the four genes vary according to tissue type, salinity, and time, thus reflecting their functional specificity. Under low salinity stress, these genes responded positively and their expressions changed to varying degrees, thus suggesting the roles of,,, andin the adaptation of turbots to low salt environments. In addition, the results of this study can provide theoretical basis for brackish water aquaculture and desalination aquaculture of turbots as well as theoretical and technical support to improve the breeding of turbot varieties and their adaptation to low salinity environments.
; Low-salinity stress;;; Na/H-exchanger; Quantitative real-time PCR
MA Aijun, E-mail: maaj@ysfri.ac.cn
S967
A
2095-9869(2020)04-0041-09
10.19663/j.issn2095-9869.20190410003
http://www.yykxjz.cn/
張金生, 劉志峰, 馬愛軍, 崔文曉, 曲江波. 大菱鲆水通道蛋白(AQP1、AQP3)以及離子通道蛋白(CFTR、NHE1)對低鹽脅迫的響應. 漁業(yè)科學進展, 2020, 41(4): 41–49
Zhang JS, Liu ZF, Ma AJ, Cui WX, Qu JB. Response of aquaporin (AQP1, AQP3) and ion channel protein (CFTR, NHE1) of turbot () to low-salinity stress. Progress in Fishery Sciences, 2020, 41(4): 41–49
* 現代農業(yè)產業(yè)技術體系建設專項(CARS-47-01)、中國水產科學研究院黃海水產研究所基本科研業(yè)務費(20603022019019)、青島海洋科學與技術國家實驗室“鰲山人才”培養(yǎng)計劃項目(2017ASTCP-OS04)、國家自然科學基金項目(41706168)和山東省農業(yè)良種工程項目(2016LZGC031)共同資助 [This work was supported by China Agriculture Research System (CARS-47-01), Special Scientific Research Funds for Central Non-Profit Institutes, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences (20603022019019), “Aoshan Talents” Training Program Project by Qingdao National Laboratory for Marine Science and Technology (2017ASTCP-OS04), National Natural Science Foundation(41706168), and Shandong Agriculture Seed Project (2016LZGC031)]. 張金生,E-mail: 1451980580@qq.com
馬愛軍,研究員,E-mail: maaj@ysfri.ac.cn
2019-04-10,
2019-06-03
(編輯 馮小花)

