鹽酸浸出鈦鐵礦制人造金紅石的技術研究
楊顯猴,唐 勇,周高明,劉祥海,王 梁,張祖超
(宜賓天原集團股份有限公司,四川 宜賓 644004)
隨著氯化法鈦白工藝的快速發展,對原料的需求日益增長[1],其中天然金紅石品質高,對其不斷開發利用于氯化法鈦白生產,致使日漸枯竭[2],因此,作為天然金紅石的優質替代品,人造金紅石的開發和利用已成為國內外相關科研機構及相關企業研究的熱點,越來越多的研究者對其進行了更深入、更廣泛的研究。
目前人造金紅石成熟的制備方法主要有電熱法[3]、還原銹蝕法[4]、酸浸法[5]。其中,酸浸法具有浸出速度快、除雜能力強等優點而被廣泛應用以及研究[6]。而對于鹽酸法浸出鈦鐵礦這一領域的研究,在酸浸前,一般需對鈦鐵礦進行預處理。目前主要采用“強還原”、“強氧化-弱還原” 以及“ 強氧化-強還原” 預處理方式[7]對鈦鐵礦進行改性,使其形成多孔物相結構,并且其鐵元素主要物相為以Fe2+形式存在的FeTiO3,以利于酸浸除雜[8]。然而在這三類預處理方式中,都存在高耗能問題。因此,通過低能耗預處理得到鈦鐵礦,再浸出制備人造金紅石是值得研究的。
本實驗將鈦鐵礦先采用“弱氧化-弱還原”的預處理方式對其進行改性,得到的改性鈦鐵礦其主要礦相為赤鐵礦、金紅石、鈦鐵礦,然后通過研究常壓浸出或加壓浸出該“弱氧化-弱還原”改性鈦鐵礦,發現采用加壓浸出“弱氧化-弱還原”改性鈦鐵礦工藝可制備可氯化人造金紅石。該方法目前研究較少、耗能低且高效,具有研究意義。
1 實驗部分
1.1 實驗原料
本實驗所采用原料為莫桑比克鈦鐵礦,其化學組成如表1所示。其粒度范圍分布見表2所示。

表1 原料鈦鐵礦化學成分組成 /%
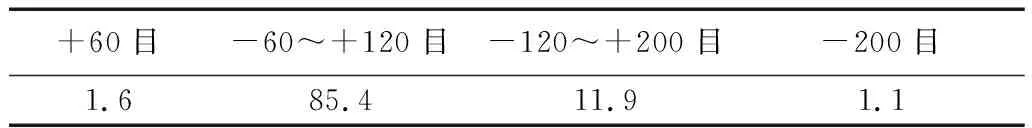
表2 原料鈦鐵礦粒度分布
1.2 分析儀器
采用X射線熒光光譜儀( XRF,荷蘭PANalytical公司生產的Axiosmax型,功率 4.0 kW,最大激發電壓60 kV,最大電流 133 mA,Rh靶X射線)對固相顆粒的化學成分進行表征;采用X射線衍射儀(XRD,荷蘭PANalytical 公司生產的Empyrean型,Cu Kα靶射線,管壓40 kV,管流40 mA),在2θ=10°~100°間掃描對其物相組成測定分析。
1.3 實驗方法
1.3.1預處理實驗
將500 g鈦鐵礦送入流化床,在空氣氣氛下700 ℃氧化20 min,然后在氫氣氣氛下580 ℃還原20 min,得到“弱氧化-弱還原”改性鈦鐵礦。
1.3.2常壓浸出實驗
稱取“弱氧化-弱還原”改性鈦鐵礦50 g放置在裝有磁石的三口燒瓶中,并以礦酸比(m/m)1∶3加入一定濃度的鹽酸溶液,然后將三口燒瓶放在調溫磁力攪拌器中進行加熱攪拌,升溫至105 ℃,恒溫反應一定時間,待反應時間結束對其進行過濾洗滌,隨后在120 ℃下干燥4 h、然后在850 ℃下煅燒1 h,最后冷卻至常溫。
1.3.3加壓浸出實驗
稱取“弱氧化-弱還原”改性鈦鐵礦50 g放置在高壓反應釜中,并以一定礦酸比加入一定質量濃度鹽酸,再將反應釜放入鹽浴爐中,設置攪拌速率為7 r/min,升溫至150 ℃并持續反應6小時,待反應結束后對其過濾洗滌、隨后在120 ℃下干燥4 h、然后在850 ℃下煅燒1 h,最后冷卻至常溫。
2 實驗結果與討論
2.1 改性鈦鐵礦物相與成分分析
根據Qingshan Zhu 等人[9]研究結果表明:在鈦鐵礦600-800 ℃弱氧化后,會形成以赤鐵礦、金紅石、鈦鐵礦為主要相的礦物,且礦物鹽酸浸出速率:赤鐵礦(Fe3+)>鈦鐵礦(Fe2+)>>假板鈦礦(Fe3+)。本研究將鈦鐵礦先經700 ℃弱氧化,使鈦鐵礦形成以赤鐵礦、金紅石、鈦鐵礦為主要相的礦物,然后再經過580 ℃弱還原,使其中的赤鐵礦、金紅石部分還原為鈦鐵礦,但其主要物相仍然為赤鐵礦、金紅石、鈦鐵礦。在含有部分赤鐵礦條件下,使其有利于后續鹽酸浸出,提高浸出效率。如圖1所示,在經過“弱氧化-弱還原”改性的鈦鐵礦,主要物相為鈦鐵礦、赤鐵礦、金紅石,其赤鐵礦含量為20.6%,含量較高,即以赤鐵礦物相存在的Fe3+含量為14.42%。該改性鈦鐵礦化學組成成分見表3所示。由此可知,以赤鐵礦物相存在的的Fe3+含量占TFe含量的41.8%。
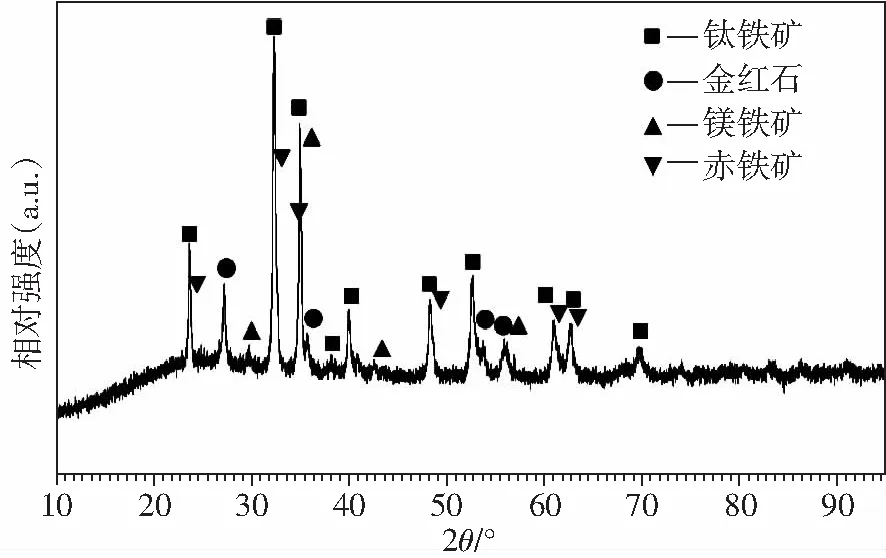
圖1 鈦鐵礦經700 ℃弱氧化、580 ℃弱還原后的XRD圖
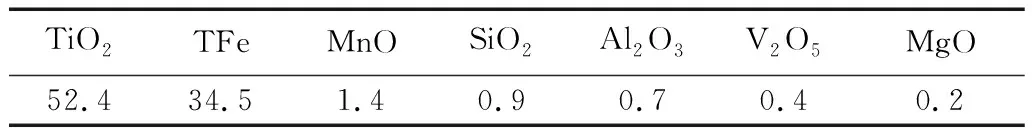
表3 改性鈦鐵礦的化學成分組成 /%
2.2 改性鈦鐵礦的常壓浸出實驗
利用該改性鈦鐵礦,本實驗首先通過常壓低濃度鹽酸浸出實驗,在固定礦酸比為1∶3,酸浸溫度為105 ℃的條件下,研究了低濃度鹽酸不同濃度與酸浸時間對其酸浸效果的影響。由圖2可知,酸浸時間相同(6~10 h),人造金紅石中的TiO2含量隨著鹽酸濃度(18%~22%)提高而增大;同樣地,鹽酸濃度相同時(18%~22%),人造金紅石中的TiO2含量隨著酸浸時間(6~10 h)增大而增大,但均不能獲得TiO2含量>88%的人造金紅石。因此,在此條件下,常壓浸出“弱氧化-弱還原”改性鈦鐵礦是不可行的,分析其原因可能為:相對于以赤鐵礦利于浸出的程度,改性鈦鐵礦形成的孔洞小且數量少,成為了制約浸出速率的主要因素。
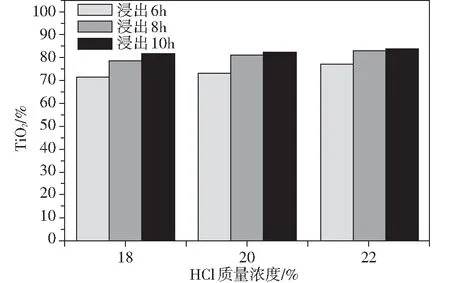
圖2 常壓浸出時間、鹽酸濃度對人造金紅石TiO2含量的影響
2.3 改性鈦鐵礦的加壓浸出實驗
隨后,本實驗通過加壓低濃度鹽酸浸出實驗,在固定礦酸比為1∶3、酸浸溫度為150 ℃以及酸浸時間為6 h的條件下,研究了鹽酸濃度與酸浸時間對“弱氧化-弱還原”性鈦鐵礦酸浸效果的影響。在鹽酸濃度18%~22%時,由圖3可知,制備的人造金紅石TiO2含量隨著鹽酸濃度提高而增大,其含量均大于88%,其中鹽酸濃度為22%時,TiO2含量為92.37%。
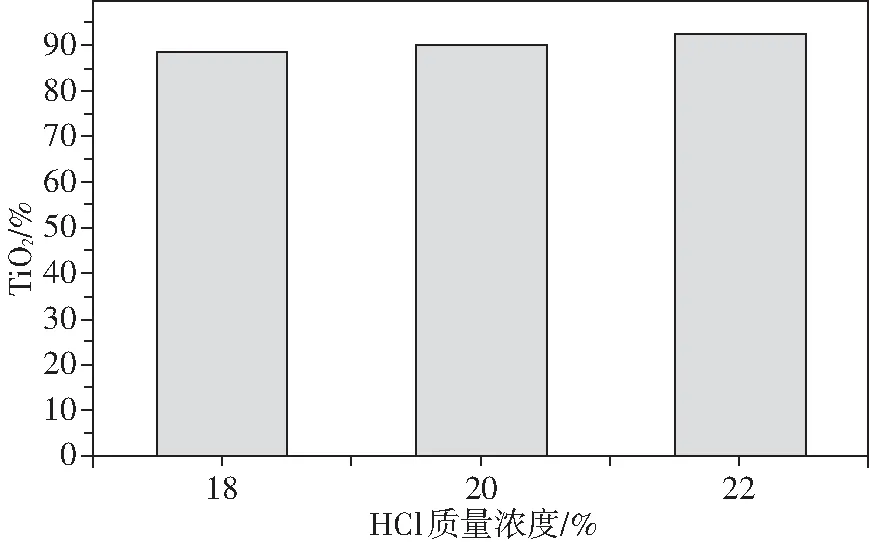
圖3 鹽酸濃度對人造金紅石TiO2含量的影響
由圖4可知,制備的人造金紅石雜質全鐵元素(TFe)的含量均低于5%。其中,鹽酸濃度為22%時,其含量為1.55%。由此可知,制備的人造金紅石中TiO2與雜質TFe含量滿足可氯化制鈦白粉要求的原料指標。
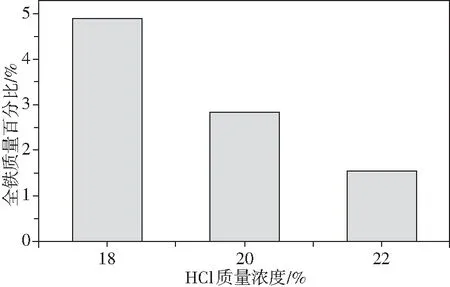
圖4 鹽酸濃度對人造金紅石TFe含量的影響
眾所周知,浸出前后TiO2的回收率、雜質浸出率也是評價浸出效果的重要指標,因此對其進行了研究。由圖5可知,人造金紅石的總浸出質量以及對應的總浸出率隨鹽酸濃度(18%~22%)提高而增大。
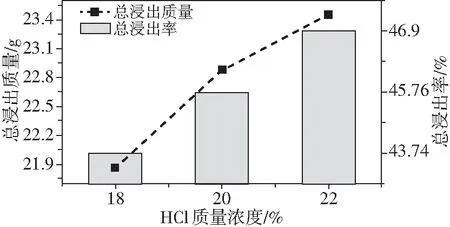
圖5 鹽酸濃度對人造金紅石總浸出質量與總浸出率的影響
根據公式(1)計算得到人造金紅石TiO2的回收率,根據公式(2)計算得到改性鈦鐵礦TFe浸出率。其中,η1與η2分別為人造金紅石TiO2的回收率、改性鈦鐵礦TFe的浸出率,m1與m2分別為原料改性鈦鐵礦浸出前、浸出后的質量,x1與x2分別為改性鈦鐵礦浸出前、浸出后TFe的百分含量。
(1)
(2)
由圖6可知,TiO2回收率達到92%以上。由圖7可知,TFe浸出率達到90%以上,其中浸出鹽酸濃度為20%~22%時,TFe浸出率達到95%以上,可知改性鈦鐵礦中除了鈦鐵礦中的鐵元素雜質被有效除去,改性鈦鐵礦中的赤鐵礦中的Fe3+(占TFe含量的41.8%)也被有效的除去,其原因為以赤鐵礦物相存在的Fe3+浸出速率遠大于以假板鈦礦物相存在的Fe3+的浸出速率,且浸出速率也高于以鈦鐵礦物相存在的Fe2+。

圖6 鹽酸濃度對人造金紅石中TiO2回收率的影響
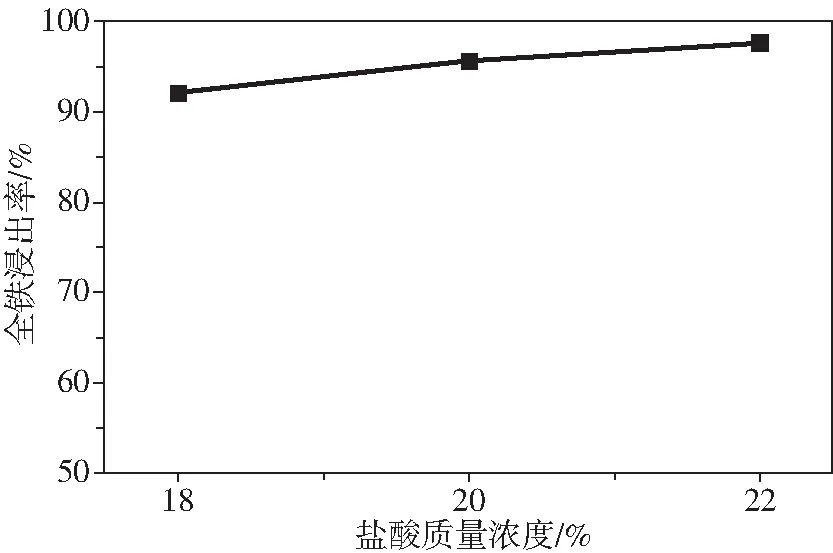
圖7 鹽酸濃度對改性鈦鐵礦中TFe浸出率的影響
最后,對產品人造金紅石的粉化率也進行了研究,結果如圖8所示。由圖8可知,浸出后的人造金紅石的粒徑分布與浸出前的改性鈦鐵礦的粒徑分布基本一致,可知改性鈦鐵礦在浸出后無明顯粉化。因此,采用浸出溫度為155 ℃、浸出時間為6 h、酸礦比為3∶1、鹽酸濃度為22%時,可制備得到TiO2為92.37%、TFe為1.55%,品位合格且浸出前后無明顯粉化的人造金紅石。
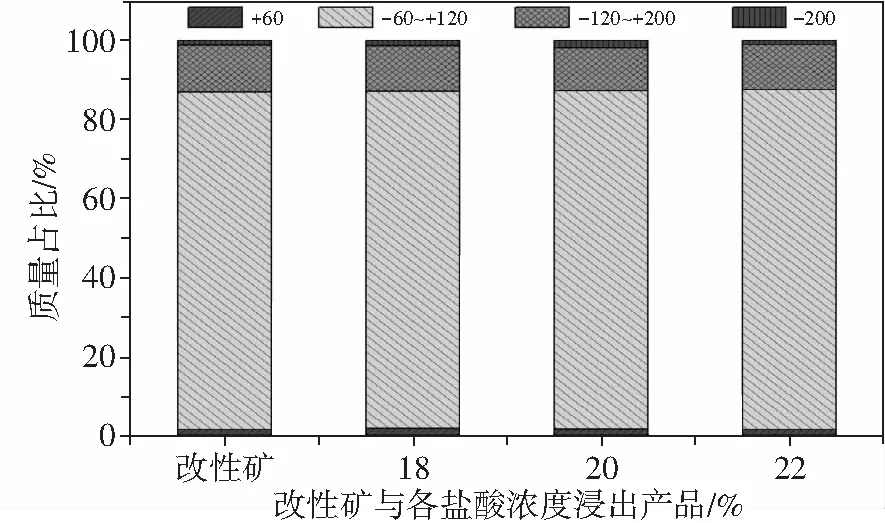
圖8 改性鈦鐵礦浸出前后的粒度分布
3 結論
(1)通過在700 ℃氧化、580 ℃還原低耗能預處理方式改性后,得到的鈦鐵礦主要物相為鈦鐵礦、赤鐵礦、金紅石、鎂鐵礦。
(2)對“弱氧化-弱還原”改性得到的鈦鐵礦進行低濃度鹽酸常壓浸出實驗,發現低濃度鹽酸常壓浸出效果不佳,其主要原因可能為:相對于以赤鐵礦利于浸出的程度,改性鈦精礦形成的孔洞小且少,成為了制約浸出速率的主要因素。
(3)采用低濃度鹽酸加壓浸出“弱氧化-弱還原”改性得到的鈦鐵礦,可以得到優質的可氯化人造金紅石,其鐵元素被有效浸出的主要原因為:鈦鐵礦中的鐵元素有近40%是以赤鐵礦物相形式存在,有利于浸出。當氧化溫度為700 ℃、還原溫度為580 ℃、浸出溫度為155 ℃、浸出時間為6h、酸礦比為3∶1、鹽酸濃度為22%時,可制備得到TiO2為92.37%、TFe為1.55%,且浸出前后無明顯粉化的人造金紅石。該工藝低耗能且簡單,值得進一步研究。

