三種制備菜籽蛋白質方法的比較
張杰 陳沖 張倩玉

[摘要]本文以雙低菜籽餅粕為原料,選擇堿溶酸沉法、Osborne分級提取法和膜分離法三種蛋白制備方法分別分離提取菜籽蛋白,通過測定和分析蛋白樣品的功能性質等,對三種菜籽蛋白制備方法進行比較。結果表明,與堿溶酸沉法和Osborne分級提取法相比,膜分離法蛋白回收率最高,達到40%,膜分離法獲得了2S清蛋白組分和12S球蛋白組分,含量分別為84.5%和85.3%。膜分離法制備的蛋白樣品功能性質最佳,其中球蛋白組分溶解度83.1%、起泡性56%、泡沫穩定性71.4%、乳化性61.7%、乳化穩定性89.7%;清蛋白組分溶解度97.9%、起泡性68%、泡沫穩定性35.3%、乳化性58.7%、乳化穩定性92.6%。
[關鍵詞]菜籽蛋白;堿溶酸沉法;Osborne分級提取法;膜分離法
中圖分類號:TS201.21 文獻標識碼:A DOI:10.16465/j.gste.cn431252ts.202005
油菜籽作為油料作物具有重要地位,菜籽榨油后的副產物為菜籽餅粕,其中含有35%~45%的蛋白質[1],菜籽蛋白質中80%以上為貯藏蛋白,其余為膜蛋白,貯藏蛋白包括12S球蛋白(cruciferin)、2S清蛋白(napin),以及一些較小的蛋白質如胰島素抑制劑和脂質轉移蛋白。12S球蛋白天然構象的平均分子量在300kDa左右,在極端pH條件下可分裂成6個亞基,每個亞基都由α和β兩條分子量為大小在20~30kDa的多肽鏈組成,約占菜籽蛋白的60%,等電點約7.2;2S清蛋白是一種堿性蛋白,約占菜籽蛋白的20%,相對分子量約12~17kDa,等電點約11[2]。菜籽蛋白具有很高的營養價值,是一種全價蛋白、無限制性氨基酸,且氨基酸組成合理,尤其是含有豐富的堿性氨基酸(賴氨酸)和含硫氨基酸(甲硫氨酸、半胱氨酸),符合FAO與WHO的推薦模式,總體品質優于大豆蛋白,媲美酪蛋白[3]。所以,菜籽餅粕是一種巨大的優質植物蛋白來源,目前菜籽餅粕主要用于動物飼料方面,對菜籽餅粕中優質蛋白的利用仍然不足。
目前在菜籽蛋白的提取制備方面,還是以堿溶酸沉法為主,該法雖然工藝簡單、成本較低,但是蛋白回收率較低,制備的蛋白質功能性質較差,制約了菜籽蛋白的商業化發展。此外,菜籽蛋白以12S球蛋白和2S球蛋白為主,堿溶酸沉法僅能獲取菜籽分離蛋白,若能將菜籽蛋白中的球蛋白和清蛋白分離制備,做到產品的細分,并依據其特性有針對性地進一步加工利用,將極大地提升菜籽蛋白的利用度。
本研究以雙低菜籽粕為原料,選擇堿溶酸沉法、Osborne分級提取法和膜分離法三種蛋白提取方法制備菜籽蛋白,從蛋白樣品的蛋白含量、溶解度和回收率等方面比較三種方法的優缺點,優選出適合工業化生產制備優質菜籽蛋白的技術方法。
1 材料與設備
1.1 材料與試劑
雙低菜籽粕:市售,粉碎過80目,于4℃環境儲存;30kDa超濾膜:德國默克公司;正己烷、氫氧化鈉、鹽酸、氯化鈉、Tris、硼酸、硫酸銅、硫酸鉀、濃硫酸:分析純,費希爾控制設備國際有限公司。
1.2 儀器與設備
IKA磁力攪拌器:德國IKA儀器設備有限公司;GL-21M離心機:上海市離心機械研究所有公司;FreeZone12Plus凍干機:美國LABCONCO公司;KX-100型高速多功能粉碎機、DHG-9140A電熱鼓風干燥箱:上海一恒科學儀器有限公司;BUCHIK-436快速消解儀、BUCHIK-360自動滴定儀:瑞士BUCHI公司;MERCK400mL超濾杯:德國默克公司。
2 實驗方法
2.1 雙低菜籽粕的脫脂
參考李楊[4]的方法,使用正己烷和索氏抽提器對雙低菜籽粕進行脫脂處理。
2.2 菜籽蛋白的制備
2.2.1 堿溶酸沉提取菜籽蛋白
根據雷麗云[5]的方法采用堿溶酸沉法提取菜籽蛋白。將菜籽粕溶于蒸餾水(質量體積比1∶10)中,用1mol/L的NaOH溶液調節pH至11.0,室溫攪拌2h,4℃、10 000r/min下離心20min。收集上清液,用1mol/L的HCl溶液調節pH至4.5,靜置2h,4℃、10 000r/min下離心20min,棄去上清液,沉淀物4℃下透析,冷凍干燥得到菜籽分離蛋白。
2.2.2 Osborne分級提取法
參照瞿瑗等[6]描述的Osborne分級方法,將菜籽粕溶于蒸餾水(質量體積比1∶10)中,室溫攪拌2h,4℃、10 000r/min下離心20min。收集上清液冷凍干燥得到2S清蛋白組分,收集沉淀,向沉淀中加入3%的氯化鈉溶液(質量體積比1∶10),室溫攪拌2h,4℃、10 000r/min下離心20min。收集上清液,4℃下透析,冷凍干燥得到12S球蛋白組分。
2.2.3 膜分離法
參考黃橙子[7]的方法,將菜籽粕溶于0.1mol/L的Tris-HCl溶液(質量體積比1∶10)中,室溫攪拌2h,4℃、10 000r/min下離心20min。收集上清液,選用30kDa的超濾膜進行超濾,截留液為大于30kD的組分,濾出液為小于30kD的組分,將截留液和濾出液分別進行透析除鹽和冷凍干燥,截留液部分得到的樣品為12S球蛋白組分,濾出液部分得到的樣品為2S清蛋白組分。
2.3 菜籽蛋白含量的測定
參照《飼料中粗蛋白的測定 凱氏定氮法》(GB/T 6432—2018)[8]測定菜籽蛋白的含量。
2.4 菜籽蛋白溶解度的測定
參照戴彩霞等[9]的方法,測定蛋白的溶解度。將不同蛋白樣品制備成蛋白溶液,調節pH至所需條件,攪拌30min使樣品混勻,靜置2min后,將上層液倒入離心管中離心(5 000r/min,20min)。取上清液,采用考馬斯亮藍法測定蛋白含量。溶解度計算公式如下:
2.5 菜籽蛋白起泡性及起泡穩定性的測定
參照李天文[10]的方法,測定蛋白質的起泡性及泡沫穩定性。稱取1g菜籽蛋白樣品,分散于蒸餾水(料液比1∶100)中,10 000r/min下均質60s。均質結束后快速將溶液倒入量筒中,記錄均質停止時的泡沫體積,用V0表示,起泡性按下列公式計算:
將量筒在室溫條件下放置30min,記錄均質停止30min后的泡沫體積,用V表示,泡沫穩定性按下列公式計算:
2.6 菜籽蛋白乳化性及乳化穩定性的測定
準確稱取2份均為0.1g的菜籽蛋白樣品,加入2.5mL蒸餾水,充分溶解樣品,再加入2.5mL大豆油,快速渦旋震蕩5min后,吸取兩管中液體部分,將其移入10mL離心管中。1 000r/min條件下離心3min后穩穩取出離心管,記錄此時離心管中乳化層高度H1和液體高度H2,乳化性按下列公式計算:
將離心后的離心管放入80℃的恒溫水浴鍋中,加熱20min后移出,用自來水快速冷卻至室溫,在1 000r/min條件下離心3min,緩緩取出離心管,記錄此時離心管中乳化層高度H3和液體高度H4,乳化穩定性按下列公式計算:
2.7 菜籽蛋白回收率的測定
參考任嬌艷等[11]的方法測定蛋白回收率。考察三種提取方式對菜籽蛋白回收率的影響,取一定量的菜籽粕制備菜籽蛋白樣品,蛋白回收率計算公式如下:
2.8 菜籽蛋白分子量分布的測定
參照高瑀瓏等[12]的方法,采用電泳儀進行SDS-PAGE凝膠電泳分析,具體方法如下:將菜籽蛋白樣品配制成約5mg/mL的蛋白溶液,與樣品緩沖液按一定稀釋比混合,沸水浴5min左右,加10μL樣品于電泳凝膠內,電壓100V,時間2h,待蛋白條帶移至底端后取出電泳凝膠,在考馬斯R-250溶液中染色1h左右。染色結束后,將電泳凝膠移至脫色液中過夜脫色,中途更換一次脫色液,待膠片中條帶清晰后拍照分析。
2.9 試驗數據的統計與分析
使用SPSS軟件對數據進行處理分析,數據采用單因素方差分析(ANOVA)和鄧肯多變量檢驗,差異有統計學意義(P<0.05),使用Oringin 2018軟件作圖。
3 結果與討論
3.1 菜籽蛋白含量的比較
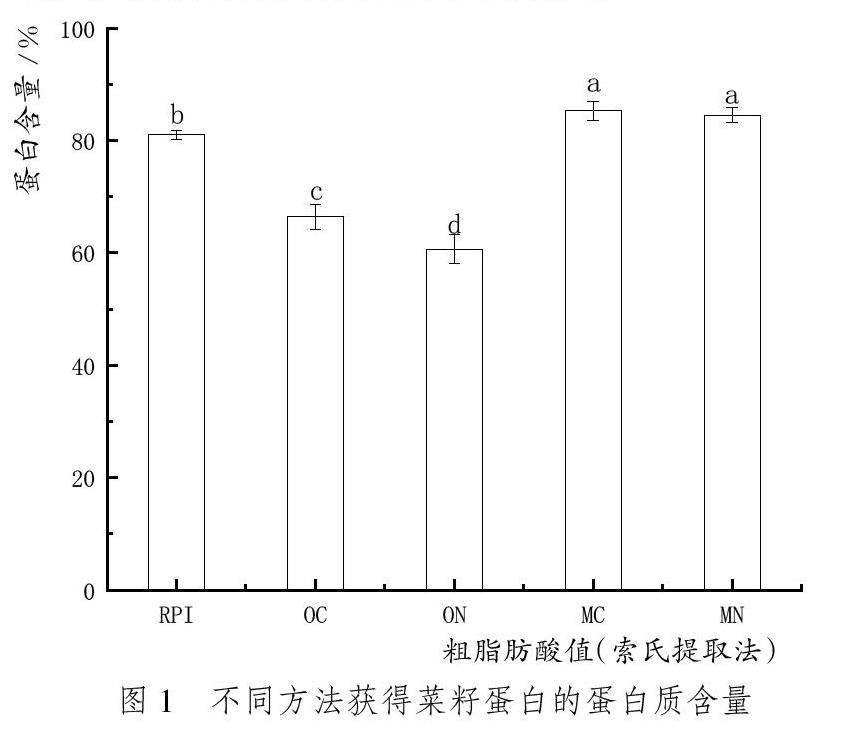
將堿溶酸沉法制備的菜籽分離蛋白記為RPI,將Osborne分級提取法制備的球蛋白和清蛋白分別記為OC、ON,膜分離法制備的球蛋白和清蛋白分別記為MC、MN。結果如圖1所示。
由圖1可知,提取方式對蛋白含量具有顯著影響。RPI蛋白含量達到81%、OC蛋白含量66.4%、ON蛋白含量為60.7%、MC蛋白含量為85.3%、MN蛋白含量為84.5%。Osborne分級提取法制備的蛋白樣品蛋白含量較低的原因可能是Osborne分級提取法是根據2S清蛋白組分和12S球蛋白組分的溶解特性的不同進行分步提取,相關文獻表明分級提取法制備的蛋白樣品蛋白含量普遍較低。例如,李婷等[13]從花生中分級提取球蛋白和清蛋白,蛋白含量分別為73.2%和53.59%;田旭靜等[14]從藜麥糠中分級提取清蛋白,蛋白含量43.21%。原因可能是簡單的水相提取過程導致樣品中含有較多可溶性雜質,所以Osborne分級提取法制備的菜籽蛋白在蛋白含量方面低于另外兩種提取方法。
3.2 菜籽蛋白溶解度的比較
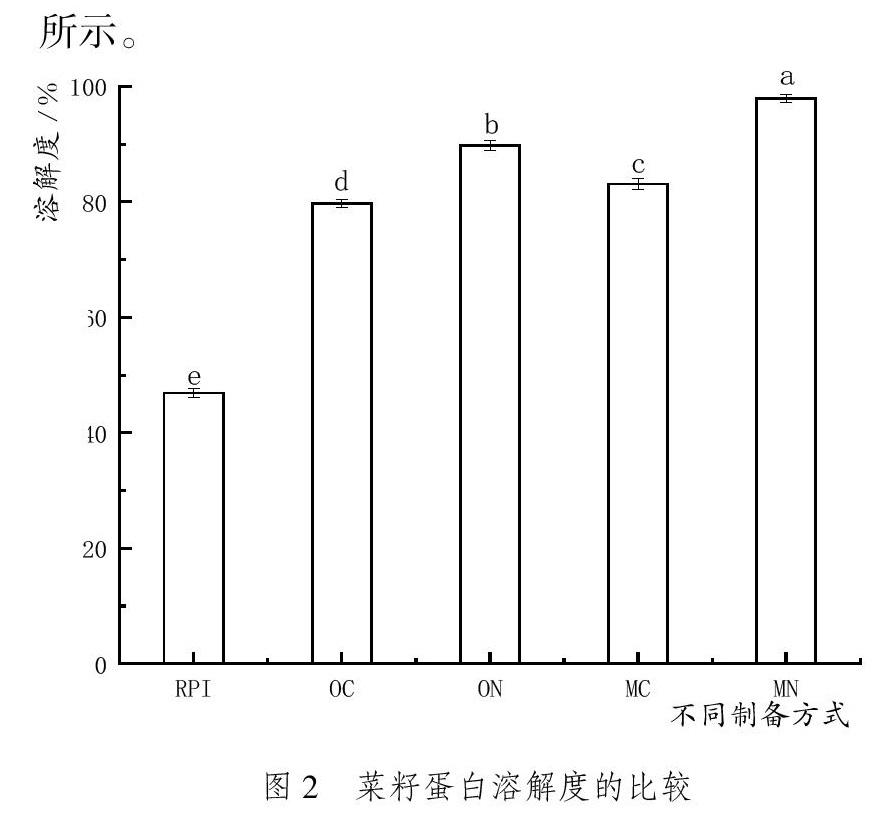
不同方法獲得的菜籽蛋白溶解度結果如圖2所示。
由圖2可知,提取方式對樣品溶解度有顯著影響,RPI溶解度46.9%,OC溶解度79.7%、ON溶解度89.8%、MC溶解度83.1%、MN溶解度97.9%。膜分離法得到的菜籽蛋白(MN)溶解性顯著優于堿溶酸沉法和Osborne分級提取法(P<0.05),原因可能是菜籽蛋白在強酸強堿條件下發生變性,結構變松散,暴露出更多的疏水基團,導致樣品溶解度降低[15]。所以,堿溶酸沉法制備的蛋白樣品溶解度明顯低于另外兩種方法制備的蛋白樣品。
3.3 菜籽蛋白起泡性及泡沫穩定性的比較
不同方法獲得的菜籽蛋白的起泡性及泡沫穩定性結果如圖3所示。
由圖3可知,提取方式對樣品起泡性和泡沫穩定性有顯著影響,RPI起泡性16%、泡沫穩定性75%,OC起泡性44%、泡沫穩定性45.5%,ON起泡性32%、泡沫穩定性50%,MC起泡性56%、泡沫穩定性71.4%,MN起泡性68%、泡沫穩定性35.3%。付本寧等[16]研究了影響花椒籽仁分離蛋白起泡性與泡沫穩定的因素,結果表明,決定蛋白溶解度的pH環境是影響蛋白起泡性的關鍵因素,在同樣的pH環境下,膜分離法制備的蛋白樣品有較好的溶解性和較高的蛋白含量,所以膜分離法制備的蛋白樣品起泡性優于其他蛋白樣品。
3.4 菜籽蛋白乳化性及乳化穩定性的比較
不同方法獲得的菜籽蛋白的乳化性及乳化穩定性結果如圖4所示。
由圖4可知,著性差異(P<0.05)。蛋白乳化性是植物蛋白的基本特性之一,對飲料、乳制品等產品的品質穩定具有重要影響,影響蛋白乳化性的最主要因素是蛋白溶解度。王麗娜等[17]通過熱改性增強了紫蘇蛋白的乳化性。綜合比較,膜分離法制備的蛋白樣品在乳化性和乳化穩定性上優于堿溶沉法和Osborne分級提取法。
3.5 分子量分布情況
不同方法獲得的菜籽蛋白質的分子量分布結果如圖5所示。
由圖5可知,1、2處為12S球蛋白條帶;3、4處為2S清蛋白條帶。RPI、ON、OC三個樣品都出現了2S清蛋白和12S球蛋白的條帶,說明堿溶酸沉法和分級提取法無法實現球蛋白和清蛋白的分離提取;MN樣品只出現了2S清蛋白的條帶,說明膜分離法可以分離提取出2S清蛋白;MC樣品雖然出現了2S清蛋白和12S球蛋白的條帶,但凝膠電泳使用的樣品只進行了一次超濾,且由于超濾過程終點不確定,截留液中含有2S清蛋白的可能性較大,2S清蛋白沒有完全被濾出。如果工業生產中進行多次超濾,理論上可以分離提取出較純的12S球蛋白。通過比較可以得出,膜分離法在菜籽蛋白的分離制備上優于堿溶酸沉法和Osborne分級提取法。
3.6 蛋白回收率比較
如圖6所示,提取方式對蛋白回收率有顯著影響(P<0.05),其中堿溶酸沉法蛋白回收率約12.6%,分級提取法蛋白回收率約28%,膜分離法蛋白回收率最高,約40%。由于菜籽蛋白成分復雜,具有多個等電點區域,采用等電點沉淀法獲取蛋白會造成蛋白得率較低;分級提取法采用水和稀鹽溶液進行兩步提取,有一定的蛋白得率;膜分離法調節了溶液pH值,增加了蛋白的溶出,提高了蛋白得率。所以,膜分離法蛋白回收率高于堿溶酸沉法和分級提取法。
4 結 論
本文以雙低菜籽餅粕為原料,選擇堿溶酸沉法、Osborne分級提取法和膜分離法三種蛋白制備方法分別分離提取菜籽蛋白,對蛋白樣品功能性質等方面的測定分析對三種菜籽蛋白制備方法進行比較,具體結果如下。
(1)蛋白含量和回收率分析比較:堿溶酸沉法制備的蛋白含量為81%;膜分離法制備球蛋白和清蛋白含量分別為85.3%和84.5%;Osborne分級提取法制備的球蛋白和清蛋白含量分別為66.4%和66.7%。堿溶酸沉法蛋白回收率12.6%;Osborne分級提取法蛋白回收率為28%;膜分離法蛋白回收率為40%。膜分離法在蛋白含量和蛋白回收率方面均優于另外兩種方法。
(2)菜籽蛋白的溶解度、起泡性、乳化性分析比較:堿溶酸沉法制備的菜籽蛋白溶解度46.9%、起泡性16%、乳化性53.2%;Osborne分級提取法制備的球蛋白和清蛋白溶解度分別為79.7%和89.8%、起泡性分別為44%和45.5%、乳化性分別為54.3%和56.5%;膜分離法制備的球蛋白和清蛋白溶解度分別為83.1%和97.9%、起泡性分別為56%和68%、乳化性分別為61.7%和58.7%。膜分離法制備的菜籽蛋白樣品在功能性質方面優于另外兩種方法制備的蛋白樣品。
(3)菜籽蛋白的組分分析:堿溶酸沉法制備的是菜籽分離蛋白,同時含有球蛋白和清蛋白條帶;分級提取法雖然按照球蛋白和清蛋白的溶解特性分別進行了分離提取,但是不能完全將12S組分和2S組分分離開來,兩個組分均含有球蛋白和清蛋白條帶;膜分離法獲得了較純的2S清蛋白組分,僅有清蛋白條帶出現,但是因為超濾終點不確定,導致截留液中還含有2S清蛋白組分的殘留,若進行進一步充分的超濾,理論上可以將2S組分和12S組分完全分離。
以上結果表明,膜分離法制備的菜籽蛋白樣品蛋白含量和蛋白回收率最高,能做到菜籽蛋白的分離制備,并且表現出更好的功能性質。所以,從菜籽粕原料的利用度及菜籽蛋白產品質量角度考慮,膜分離法是一種適合工業化生產的、優質的菜籽蛋白制備方法。
參考文獻
[1]易起達.酶解制備菜籽肽及其抗氧化作用研究[D].南京:南京財經大學,2013.
[2]何榮.菜籽蛋白源腎素和ACE雙重抑制肽的制備及其抑制機制研究[D].無錫:江南大學,2013.
[3]戴彩霞,何榮.超高壓和加熱處理對菜籽蛋白功能性質和結構的影響研究[J].中國油脂,2019,44(7):68-74.
[4]李揚.菜籽蛋白基納米銀抗菌復合膜的制備與研究[D].南京:南京財經大學,2018.
[5]雷麗云.雙低菜籽餅粕蛋白的制備及其功能特性研究[D].鎮江:江蘇大學,2007.
[6]瞿瑗,余國賢,黎杉珊,等.Osborne法分級提取青花椒籽蛋白質及其理化性質研究[J].核農學報,2018,32(12):2373-2379.
[7]黃橙子.酸溶性大豆蛋白的制備及其在酸性飲料中的應用[D].上海:華東師范大學,2013.
[8] GB/T 6432—2018,飼料中粗蛋白的測定 凱氏定氮法[S].
[9]戴彩霞,何榮.超高壓和加熱處理對菜籽蛋白功能性質和結構的影響研究[J].中國油脂,2019,44(7):68-74.
[10]李天文.麥胚蛋白的分級提取及其理化和功能特性研究[D].大慶:黑龍江八一農墾大學,2009.
[11]任嬌艷,史傳超,常博,等.核桃蛋白的分離制備及其酶解 ?物的抗氧化特性[J].現代食品科技,2019,35(3):118-124.
[12]高瑀瓏,鄭銳,王玉梅,等.菜籽分離蛋白分子質量分布及酶解條件的研究[J].中國糧油學報,2014,29(6):38-45.
[13]李婷,彭宇寧,李強,等.4種花生蛋白的分級提取及其結構的掃描電鏡觀察[J].食品科學技術學報,2015,33(3):35-42.
[14]田旭靜,段鵬慧,陳文超,等.Osborne分級法提取藜麥糠清蛋白及功能性質研究[J].食品工業科技,2017,38(12):264-269+276.
[15]張英蕾,姚鑫淼,盧淑雯,等.堿溶酸沉法提取黑豆蛋白工藝優化[J].中國食品添加劑,2019,30(1):60-68.
[16]付本寧,李超,潘姝璇,等.花椒籽仁分離蛋白起泡力及泡沫穩定性的影響因素研究[J].中國油脂,2018,43(9):40-43+48.
[17]王麗娜,李鳳林,康立寧.響應面法優化紫蘇蛋白的乳化特性[J].吉林農業科技學院學報,2019,28(4):1-5+115.

