嗜水氣單胞菌刺激對中華絨螯蟹免疫的影響
程 超,肖 敏,李 菁,毛振方,張翠真,陳志和,朱敏杰,簡少卿,3,趙大顯,3
( 1.南昌大學 生命科學學院,江西 南昌 330031; 2.江西省吉安市井岡山農業科技園,江西 吉安 343000; 3.江西省水產動物資源與利用重點實驗室,江西 南昌 330031 )
中華絨螯蟹(Ericheirsinensis),俗稱河蟹、毛蟹、大閘蟹等,是我國重要的特種水產養殖品種之一,因肉質鮮美,具有較高的營養價值和經濟價值。近年來,隨著市場需求量的不斷擴大,其增養殖模式在不斷發展,養殖規模也在逐步擴大。自20世紀80年代起,人工池塘養殖開始起步,在2000年后,中華絨螯蟹池塘生態養殖技術已逐漸成熟,到2016年全國中華絨螯蟹總產量達8.23×105t,產值超過400億元[1]。隨著人工養殖的迅速發展,其病害問題亦日趨突出,嚴重影響了中華絨螯蟹的養殖效益。因此,從根源上探明中華絨螯蟹的免疫機制,有效提高中華絨螯蟹的品質和抗病能力就顯得尤為重要。
嗜水氣單胞菌(Aeromonashydrophila)作為一種較常見的條件致病菌,在水環境中廣泛存在,是一種典型的人—獸—魚共患的致病菌,也是魚類發病的主要病原[2]。目前有關嗜水氣單胞菌對經濟類水產品的致病性研究,多集中在硬骨魚類、兩棲類和爬行類,而對甲殼動物如蝦、蟹等的研究則不多[2-3]。余雪明等[4]在對13種貝類及甲殼類海產品檢測時發現,致病性氣單胞菌檢測出8種,檢出率高達61.29%,其中以嗜水氣單胞菌數量最多;衣啟麟[5]則指出,致病性嗜水氣單胞菌會導致中華絨鰲蟹的顫抖病和水腫病等多種疾病的發生,也是蝦蟹類養殖病害中主要細菌病原之一。
筆者選定嗜水氣單胞菌為感染病原,采用注射方式急性感染中華絨螯蟹,探究其重要免疫器官組織結構變化和免疫相關基因表達規律,有助于從組織和分子水平揭示中華絨螯蟹對嗜水氣單胞菌的免疫應答機理以及嗜水氣單胞菌對中華絨螯蟹的致病機理,為尋找更科學的蟹病防治措施、提高養殖對象抗病能力,實現養殖產業的健康可持續發展提供科學依據。
1 材料與方法
1.1 試驗動物
中華絨螯蟹由南昌市墩子塘水產市場購得,規格為80~100 g,經充分曝氣自來水(水溫24 ℃,pH 6.8,溶解氧>5.0 mg/L)暫養7 d后,挑選健康、規格基本一致且肢體健全的蟹用于嗜水氣單胞菌免疫刺激試驗。
1.2 嗜水氣單胞菌
嗜水氣單胞菌(ATCC35654標準菌株)自上海復祥生物科技有限公司購得;菌種使用營養肉汁瓊脂培養基活化,并在營養肉汁液體培養基中進行擴增培養(30 ℃培養24 h)后,于4 ℃,3240 r/min下離心15 min,棄上清液,沉淀用生理鹽水(0.9%)進行洗滌、懸浮,懸浮后菌液密度約為2.8×108cfu/mL。
1.3 嗜水氣單胞菌免疫刺激試驗
試驗分為感染組和對照組,每組設3個平行,每個75 cm×55 cm×45 cm試驗桶中放中華絨螯蟹21尾,共計126尾。試驗期間日換水量約1/2~1/3,換水時清除污物,試驗期間不投餌。試驗組,使用1 mL的醫用一次性注射器取1.2中懸浮后菌液0.1 mL,于中華絨螯蟹第三步足基膜處注射進腹部肌肉;對照組注射等體積生理鹽水。試驗期間各組中華絨螯蟹均無死亡,于注射后0、3、6、12、24、48 h和72 h各平行組取2尾中華絨螯蟹分別抽取血淋巴,4 ℃,11 240 r/min離心10 min收集血細胞[按1∶1加入預冷抗凝劑后抽取樣蟹血淋巴,離心得到的血細胞加入適量TRIzol?Reagent (Life Technologies,USA)后置于冰箱-80 ℃凍存],用于總RNA抽提。隨后對試驗蟹進行解剖,小心取出中華絨螯蟹的鰓、肝胰腺組織(組織塊大小約0.5 cm×1.0 cm),用生理鹽水浸洗,濾干水分后置于體積比為20∶1的10%甲醛溶液中常溫保存,備用于組織切片觀察。
1.4 組織切片和測量
采用常規石蠟切片、蘇木精—伊紅染色對感染前后中華絨螯蟹鰓和肝胰腺組織進行切片制作,并通過顯微鏡(尼康TI-S)進行觀察、測量和拍照。
1.4.1 鰓絲厚度的測量
隨機選擇各時段切片視圖中5根結構完整的鰓絲,從鰓軸起至鰓絲末端間隨機選擇10個位點進行測量,求取平均值及標準差。
1.4.2 肝小管管腔比面積的測量
隨機挑取各時段切片視圖中5個結構完整的肝小管橫截面圖,因肝小管近橢圓形,取橢圓長軸直徑、短軸直徑進行測量,利用橢圓面積公式粗略計算肝小管橫截面積;因管腔形狀不規則,對環截面厚度的測量采用對環截面進行均勻布點,以多次(8~10次)測量求取平均值,估算肝小管管腔面積占比,取5次估算值的平均值及標準差。
1.4.3 指標計算公式
(1)
(2)
(3)
式中,TL表示中華絨螯蟹的鰓絲平均厚度,n為測量次數,T1、T2…Tn為各次測量的數值;S0為中華絨螯蟹肝小管的橫截面積,a、b表示肝小管長軸、短軸直徑;φ為估算的肝小管管腔面積占比,t表示肝小管厚度。
1.5 免疫相關基因的相對表達量分析
1.5.1 總RNA提取與cDNA模板獲得
取上述1.3中凍存血細胞樣品,采用Trizol法提取總RNA;用反轉錄試劑盒TaKaRa PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)進行第一鏈cDNA的合成,cDNA合成后于冰箱-20 ℃保存備用。
1.5.2 實時熒光定量PCR(qPCR)檢測分析
使用熒光定量PCR儀Bio-Rad CFX Manager 3.1進行qPCR檢測分析。PCR反應體系(20 μL)參照實時熒光定量PCR試劑盒TaKaRa SYBR?Premix Ex TaqTM(Tli RNaseH Plus)進行,組分為:SYBR Premix Ex Taq (Tli RNaseH Plus) (2×) 10 μL,PCR Forward Primer (10 μmol/L) 0.4 μL,PCR Reverse Primer (10 μmol/L) 0.4 μL,Template (<100 ng) 2 μL,dH2O 7.2 μL。反應條件如下:
步驟1:95 ℃預變性5 min后進入循環;步驟2:95 ℃變性30 s;步驟3:58~60 ℃退火30 s;步驟4:72 ℃延伸30 s,共39個循環;步驟5:溶解曲線分析,95 ℃ 5 s (變溫速率4.4 ℃/s),60 ℃ 1 min (變溫速率2.2 ℃/s),95 ℃(變溫速率0.11 ℃/s,采集方式:連續采集,每1 ℃ 5次)1個循環;步驟6:結束。每個反應重復3次。引物使用Primer 5.0軟件設計,具體序列見表1,其中β-actin為內參基因,引物均由上海生工生物工程股份有限公司合成。

表1 實時熒光定量PCR反應引物
1.6 數據分析
數據以平均值±標準差表示;實時熒光定量PCR數據使用2-△△Ct法(Livak法[6])進行分析計算目的基因的mRNA相對表達水平數值;使用Excel、OriginPro 8軟件完成相關制表、制圖等;使用SPSS 21軟件分析數據顯著性差異,P<0.05為顯著性差異,P<0.01為極顯著性差異。
2 結 果
本試驗中,對照組蟹在注射生理鹽水后無異常反應,活力正常;試驗組蟹在嗜水氣單胞菌(菌液密度約2.8×108cfu/mL)注射感染后,活力明顯下降,但未出現死亡,并在24 h后活動能力有逐步恢復的趨勢。
2.1 嗜水氣單胞菌免疫刺激對中華絨螯蟹鰓、肝胰腺組織結構的影響
2.1.1 對鰓組織結構的影響
對嗜水氣單胞菌免疫刺激前后中華絨螯蟹鰓絲厚度進行測量發現,對照組中華絨螯蟹鰓絲厚度無顯著差異變化(P>0.05),試驗組中鰓絲厚度在3 h時極顯著降低(P<0.01),在6~72 h時鰓絲厚度有不同程度的增厚(表2)。進一步通過鏡檢觀察發現,與對照組(圖1a)和感染組0 h(圖1b)相比,中華絨螯蟹在感染嗜水氣單胞菌3 h后鰓絲腔中上皮細胞形成的腔隔膜結構被破壞,致鰓絲厚度急劇減小,且鰓絲末端有血細胞積聚,但角質層及基膜結構完整(圖1c);6、12 h時角質層顯著增厚(P<0.05),并有波狀突起,部分角質層與基膜分離,且鰓絲腔增大,鰓絲末端破裂,相比近鰓軸處,鰓絲中后段血細胞數量較少(圖1d~e);24 h時鰓絲厚度達最大,血細胞數量異常增多,角質層增厚且波狀突起多與基膜脫離并呈碎裂狀,鰓絲末端結構破壞加劇(圖1f);48 h時鰓絲厚度相比24 h時有減小,且鰓絲近末端結構損傷處出現血細胞積聚現象(圖1g);72 h時觀察到鰓絲不同區段有血細胞積聚現象(圖1h)。試驗結果表明,嗜水氣單胞菌免疫刺激對中華絨螯蟹鰓組織結構造成了顯著影響。
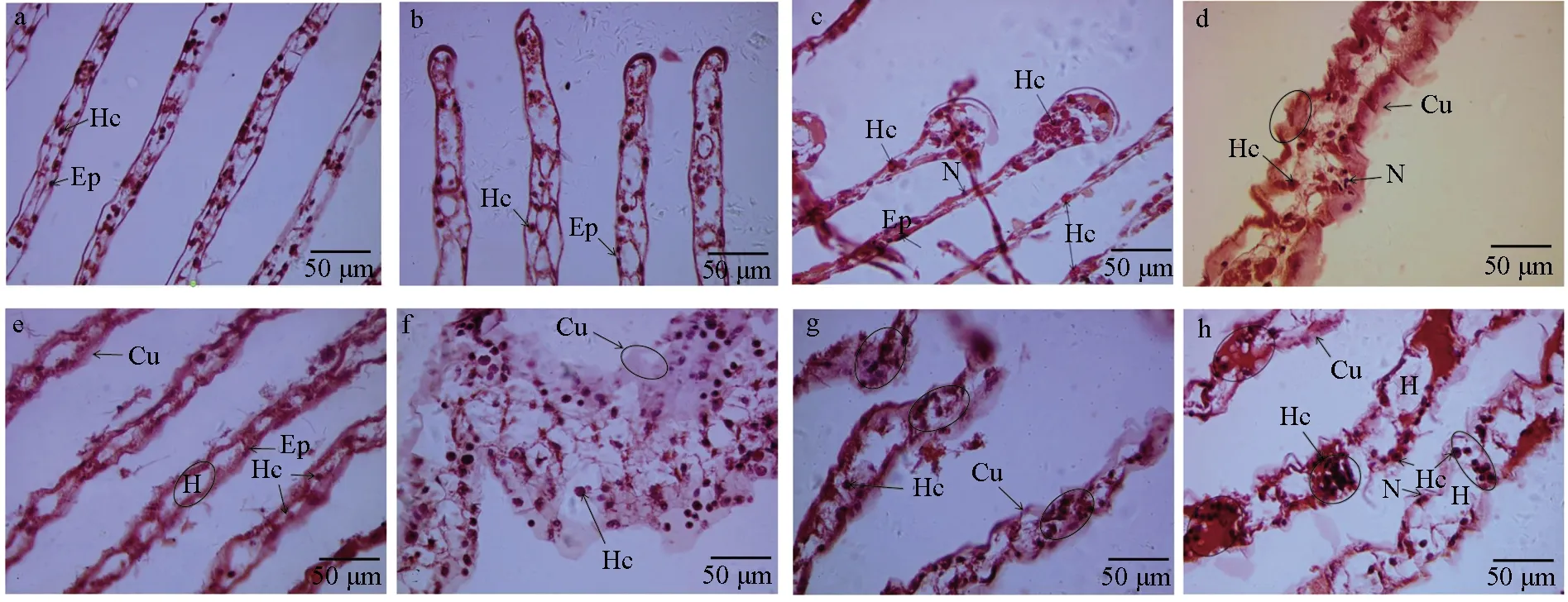
圖1 嗜水氣單胞菌免疫刺激對中華絨螯蟹鰓組織結構的影響

表2 嗜水氣單胞菌免疫刺激對中華絨螯蟹鰓絲厚度的影響 μm
2.1.2 對肝胰腺組織的影響
對中華絨鰲蟹肝胰腺中肝小管進行測量,計算肝小管中管腔面積占肝小管橫截面面積的百分比(后簡稱肝小管管腔面積比,φ)。結果顯示,在注射生理鹽水和嗜水氣單胞菌后,均會使肝小管管腔面積比均值增大,即使肝小管管腔面積增大,但對照組在6 h后面積比均值恢復至近0 h水平,試驗組則在6 h時面積比均值有最大值,隨后呈下降趨勢,但與0 h面積比均值相比仍較大。且對照組和試驗組在3 h時肝小管管腔面積比均值之間無顯著差異(P>0.05);6 h時面積比均值均有較高水平,且標準差較小;12 h時面積比均值較6 h時減小,且標準差值較大;24、48 h時面積比均值進一步減小,但標準差值仍較大;72 h時對照組肝小管面積比均值異常增大(表3)。

表3 嗜水氣單胞菌免疫刺激對中華絨螯蟹肝小管管腔面積比的影響 %
通過對中華絨螯蟹肝胰腺組織切片結構觀察發現,對照組0 h(圖2a)和試驗組0 h(圖2b)肝小管結構清晰,基膜完整,細胞核整齊排列于近基膜側,主要為纖維細胞與吸收細胞。嗜水氣單胞菌免疫刺激3 h時,肝小管部分細胞水腫,吸收細胞結構有變形,分泌細胞及胚細胞增生(圖2c);6 h時肝小管大部分細胞水腫,細胞排列紊亂,部分核固縮壞死,肝小管中,基膜與吸收細胞連接處碎裂、分離(圖2d);12 h時肝小管上皮增生,細胞排列層次增多,核大小不一,部分細胞水腫變形(圖2e);24 h時肝小管中細胞發生水樣變性,細胞結構模糊、排列紊亂,血細胞數量增多,出現空泡狀結構,但基膜結構仍完整(圖2f);48 h時肝小管中細胞核分布靠近基膜側,纖維細胞數量增多,吸收細胞與分泌細胞錯落分布,空泡狀結構減少(圖2g);72 h時肝小管中,基膜明顯增厚,分泌細胞位于近基膜處,吸收細胞結構為清晰柱狀且數量較多,偶見空泡狀結構(圖2h)。結果表明,注射生理鹽水和嗜水氣單胞菌均可能引起中華絨螯蟹的免疫反應,但生理鹽水無明顯毒性作用,而嗜水氣單胞菌免疫刺激會對中華絨螯蟹肝胰腺組織造成顯著影響。
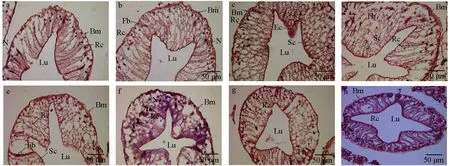
圖2 嗜水氣單胞菌免疫刺激條件下中華絨螯蟹肝胰腺組織結構的影響
2.2 嗜水氣單胞菌免疫刺激對中華絨螯蟹血淋巴中免疫相關基因表達量的影響
2.2.1 對免疫模式識別相關基因相對表達量的影響
對照組中華絨螯蟹血淋巴中脂多糖和β-1,3-葡聚糖結合蛋白(LGBP)mRNA的相對表達量在3、6 h略有上調,12 h下調,且為最小值,24、48 h時與0 h相近,72 h上調;試驗組中華絨螯蟹血淋巴中LGBP基因在6 h下調表達,在12 h時表達上調,24、48、72 h與0 h的相對表達量相近;與對照組相比,試驗組在6、72 h有顯著低表達(P<0.05),在12 h有極顯著高表達(P<0.01)(圖3)。
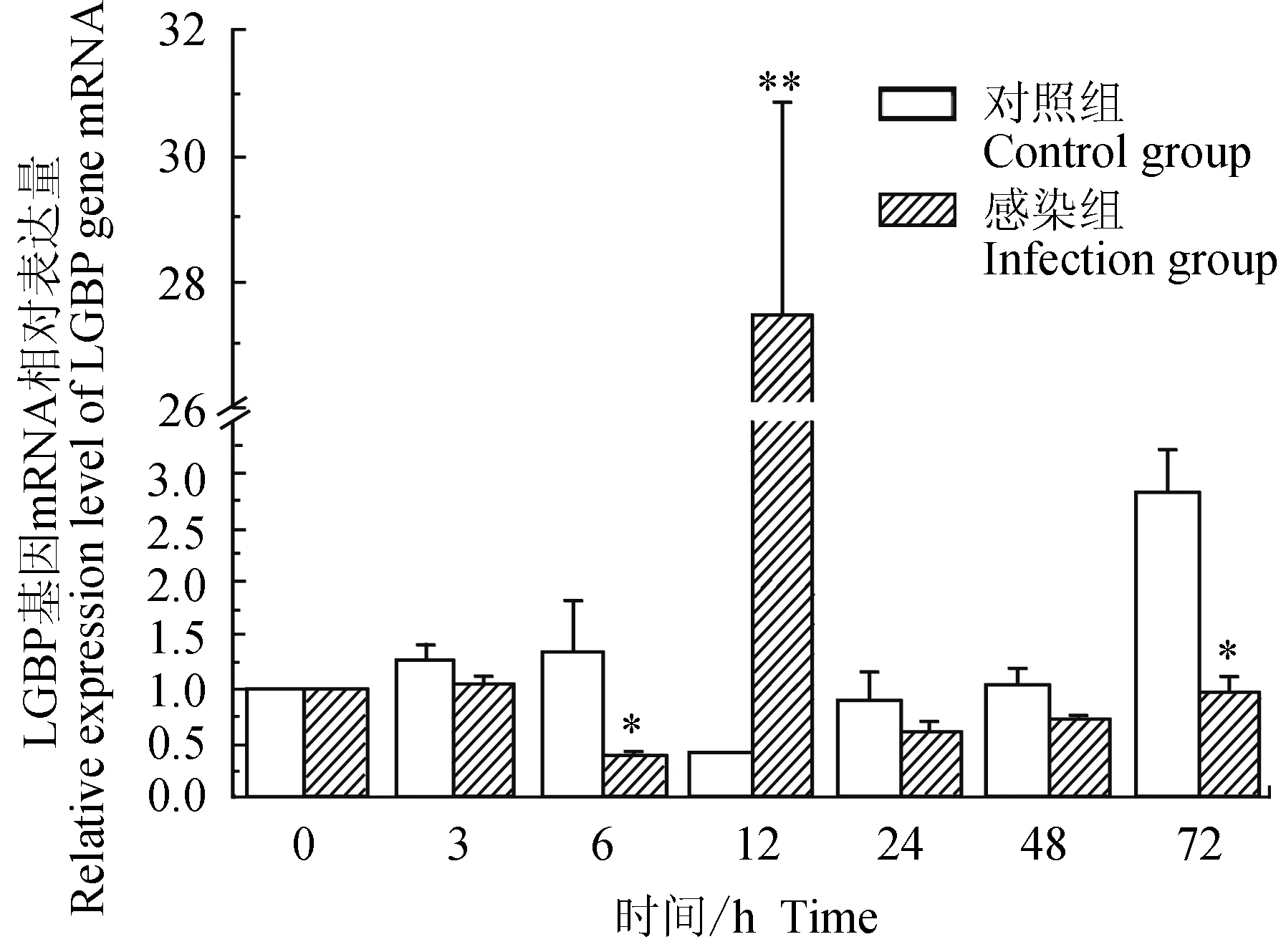
圖3 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫LGBP基因表達的影響
2.2.2 免疫信號傳導相關基因的相對表達量分析
對照組中華絨螯蟹血淋巴中免疫信號傳導Toll通路重要組件Tube基因的相對表達量水平在72 h內差異不大;試驗組中華絨螯蟹血淋巴中Tube基因在3、6 h逐級下調表達,在12、24、72 h上調表達,且在12 h有最大值;與對照組相比,試驗組在3、6 h有顯著低表達(P<0.05),在12 h有顯著高表達(P<0.05)(圖4)。
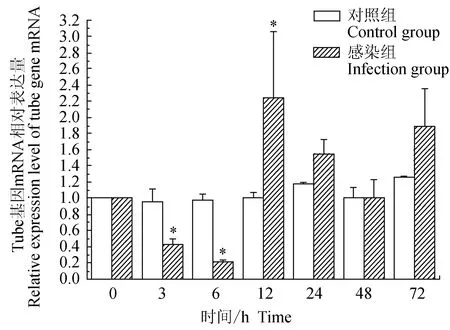
圖4 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫Tube基因表達的影響
對照組中華絨螯蟹血淋巴中免疫信號傳導Toll通路重要組件Dorsal基因在6、72 h有上調表達,3、12、24、48 h相對表達量與0 h相近;試驗組中華絨螯蟹血淋巴中Dorsal基因在3 h上調表達,隨后呈逐漸下調趨勢;與對照組相比,試驗組Dorsal基因在3 h有顯著高表達(P<0.05),在24、72 h有顯著低表達(P<0.05)(圖5)。
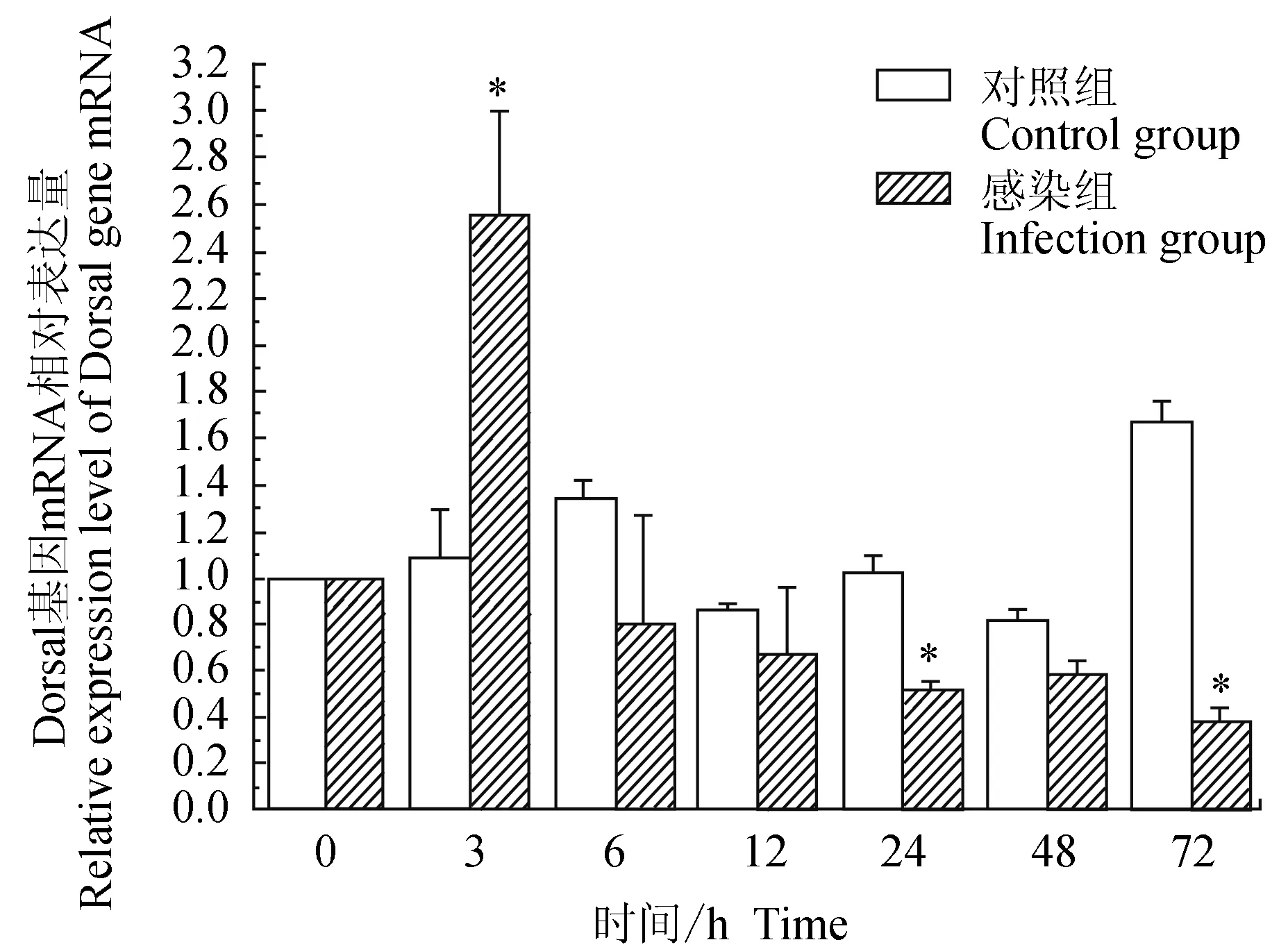
圖5 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫Dorsal基因表達的影響
對照組中華絨螯蟹血淋巴中整合素(Integrin)基因在3 h有下調,72 h上調,相對表達量在72 h內差異不大;試驗組中華絨螯蟹血淋巴中Integrin基因在3、6、12 h均上調表達,24、72 h均下調表達;相比對照組,試驗組Integrin基因在3、6 h顯著高表達(P<0.05),在12 h有極顯著高表達(P<0.01),在24、72 h時有顯著低表達(P<0.05)(圖6)。
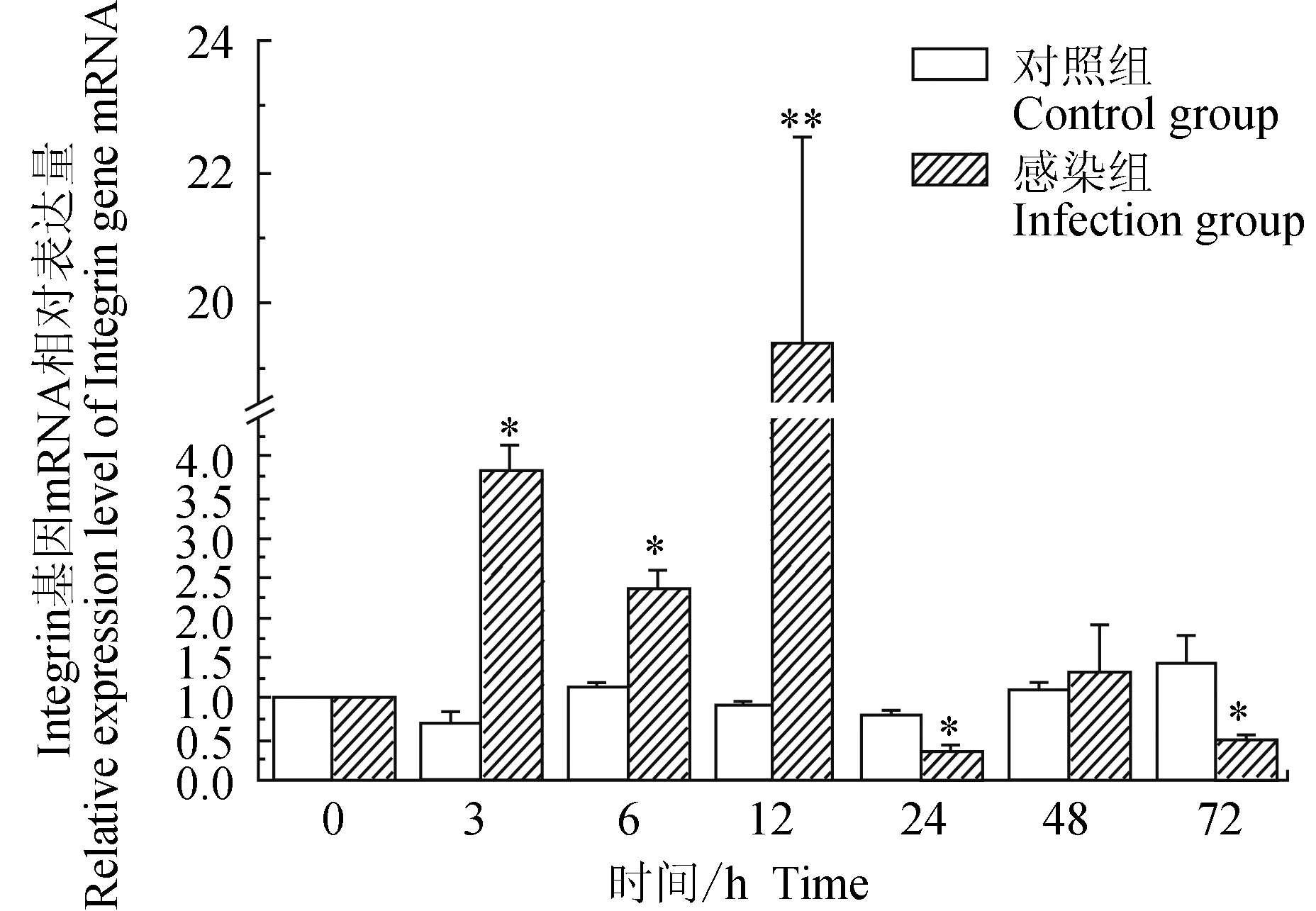
圖6 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫Integrin基因表達的影響
2.2.3 免疫效應相關基因的相對表達量分析
對照組中華絨螯蟹血淋巴中酚氧化酶原激活酶(PPAF)基因在3 h上調表達,在6 h時下調表達,12、24、48 h時有下調表達趨勢,12 h與0 h無明顯差異,72 h時上調表達;試驗組中華絨螯蟹血淋巴中PPAF基因在感染嗜水氣單胞菌72 h的相對表達量均明顯下調,在12 h有最小值;相比對照組,3、24 h有顯著低值(P<0.05),12、72 h有極顯著低值(P<0.01)(圖7)。
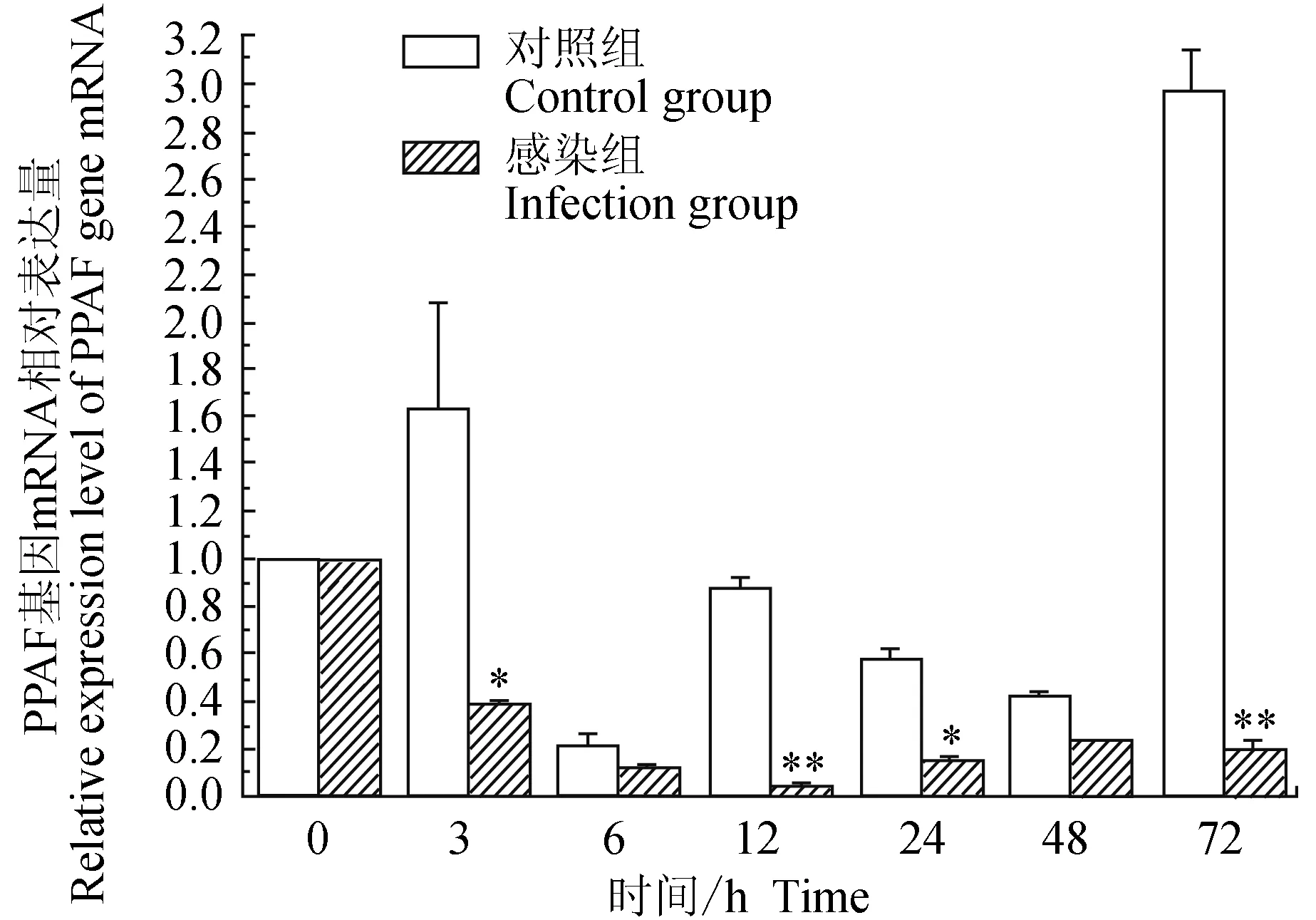
圖7 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫PPAF基因表達的影響
對照組中華絨螯蟹血淋巴中細胞黏附蛋白(PXN)基因在3、6、12 h逐級下調表達,6 h有最小值,24、72 h上調表達,48 h下調表達,有最低值,72 h有最高值;試驗組中華絨螯蟹血淋巴中PXN基因在12 h內逐級下調表達,12 h有最低值,24、48 h和72 h相對表達量有升高,但較0 h仍為下調表達;與對照組比較,6、72 h有顯著(P<0.01)低值,12 h有極顯著低值(P<0.01)(圖8)。
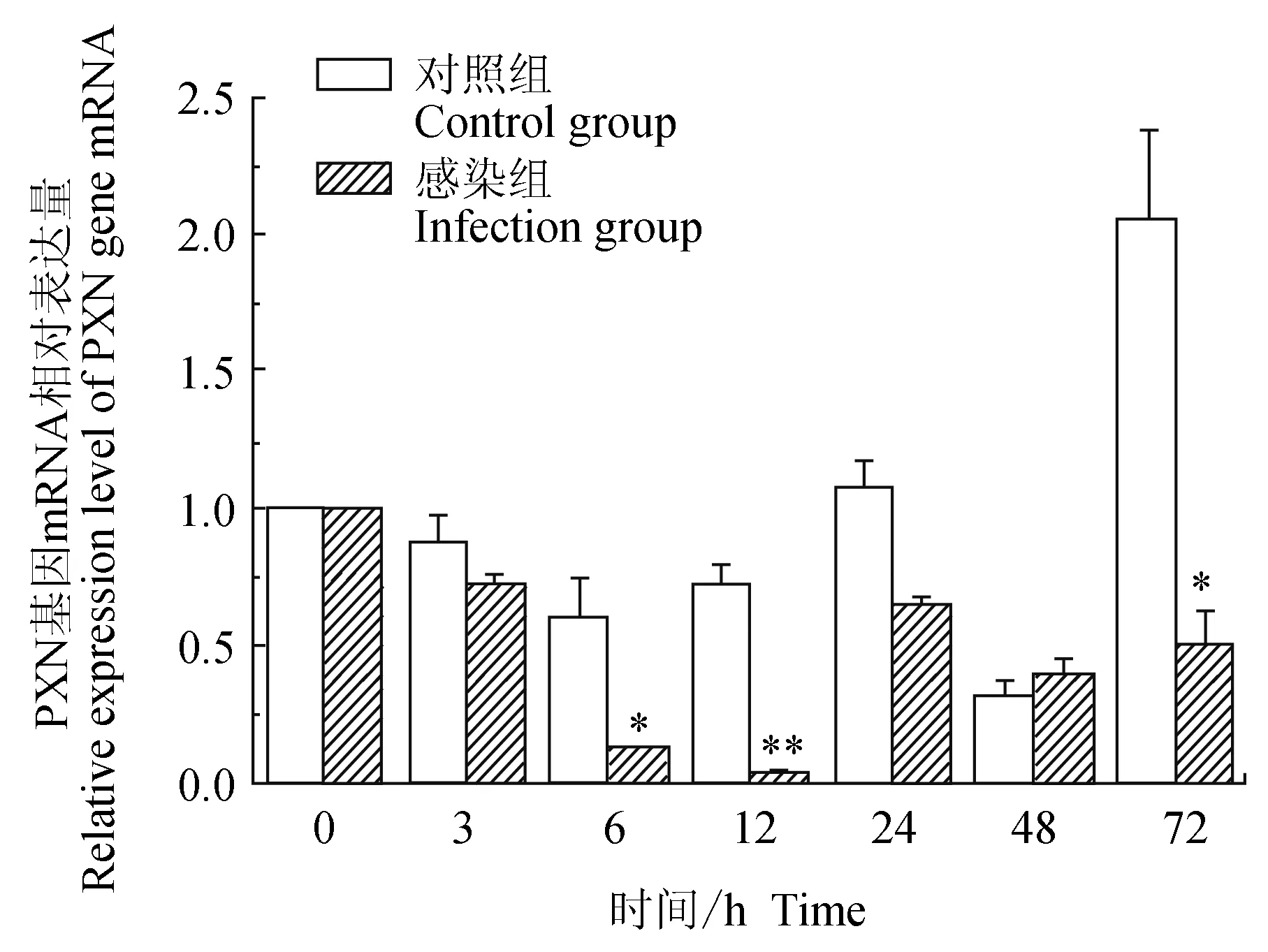
圖8 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫PXN基因表達的影響
對照組中華絨螯蟹血淋巴中谷胱甘肽硫轉移酶(GST)基因在3 h上調表達,隨后下調,48 h內與0 h時差異不大,72 h上調表達;試驗組中華絨螯蟹血淋巴中GST基因在12 h內逐級下調,12 h有最低值,24 h上調表達,48、72 h相對表達量與0 h相近;相比對照組,3、6、12 h和72 h均有顯著低值(P<0.05)(圖9)。
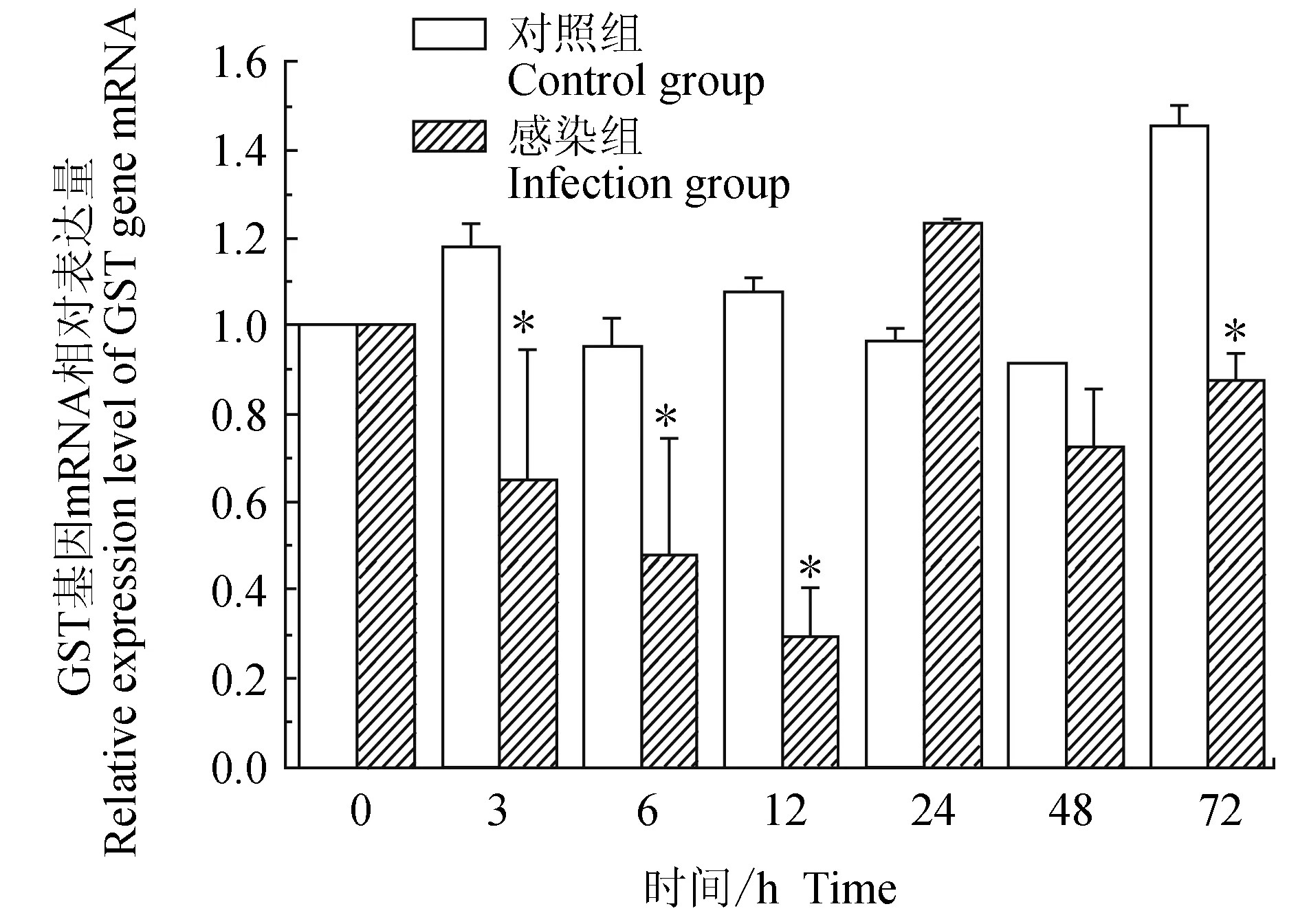
圖9 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫GST基因表達的影響
對照組中華絨螯蟹血淋巴中谷胱甘肽過氧化物酶(GPx)基因在3 h下調,隨后上調,趨于0 h水平,72 h上調;試驗組中華絨螯蟹血淋巴中GPx基因在24 h內均下調表達,48 h上調表達,72 h下調表達,6 h有最低值;相比對照組,6、24、72 h時有顯著低值(P<0.05),48 h時有顯著高值(P<0.05)(圖10)。
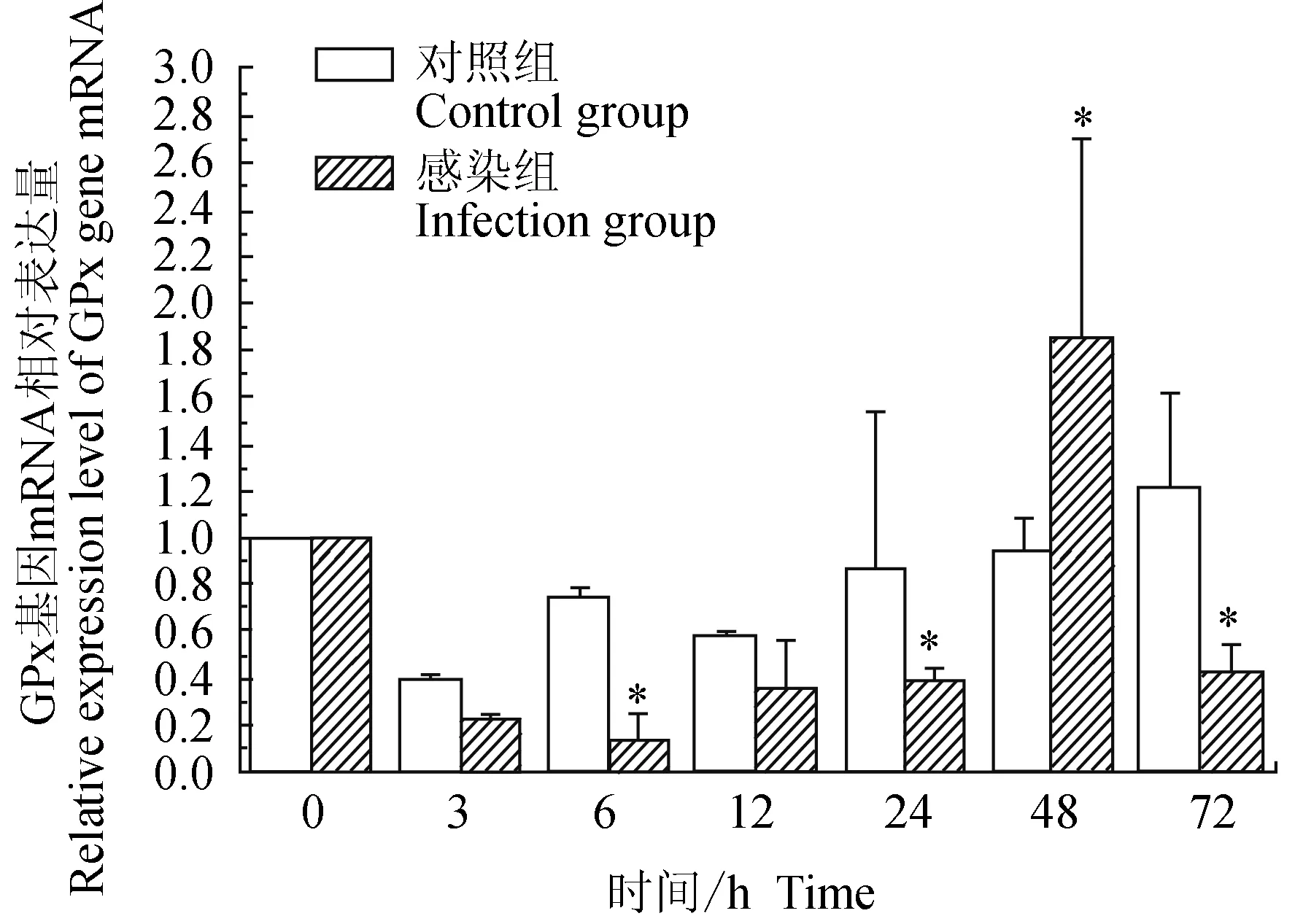
圖10 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫GPx基因表達的影響
對照組中華絨螯蟹血淋巴中超氧化物歧化酶(SOD)基因僅在24 h時下調表達,其余時段無顯著差異;試驗組中華絨螯蟹血淋巴中SOD基因在3 h上調,6、24 h下調,其余時段與0 h無顯著差異;相比對照組,6 h有顯著低值(P<0.05)(圖11)。
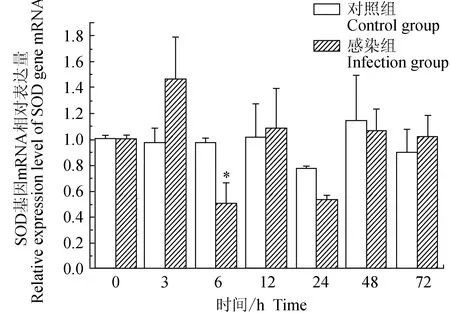
圖11 嗜水氣單胞菌免疫刺激對中華絨鰲蟹免疫SOD基因表達的影響
3 討 論
3.1 嗜水氣單胞菌
嗜水氣單胞菌屬弧菌科、氣單胞菌屬,是嗜溫、有動力的氣單胞菌群,廣泛存在于淡水、污水及土壤中,是水生動物尤其魚類最常見的致病菌[2]。嗜水氣單胞菌已在淡海水魚類[7]、淡水蝦類[8-9]、淡水蟹類[10]和蛙類[11-12]體內分離到。嗜水氣單胞菌感染后,不同對象表現出不同的臨床癥狀而有不同名稱,如蛙類[12]和大口黑鱸(Micropterussalmoides)[13]的“紅通病”,鯽魚(Carassiusauratus)、鰱魚(Hypophthalmichthysmolitrix)[14]的“暴發病”,胡子鲇(Clariasgariepinus)[15]和白斑狗魚(Esoxlucius)[16]的“紅嘴病”、“壞死病”等。在蝦蟹類中,有日本沼蝦(Macrobrachiumnipponense)[8]的“紅鰓病”,中華絨螯蟹[10]的“腹水病”、“抖抖病”等。姜艷麗等[2]研究發現,嗜水氣單胞菌能產生多種外毒素(如氣溶素、溶血素、細胞毒素和腸毒素等)、胞外蛋白酶和黏附因子等毒力因子,使蝦蟹類血淋巴失去功能或導致其他組織器官被侵染,發生病變,最終喪失功能,引發死亡。所以,在本試驗中選取嗜水氣單胞菌作為病原,分析其對中華絨螯蟹免疫系統的影響。
3.2 嗜水氣單胞菌免疫刺激對中華絨螯蟹鰓、肝胰腺組織結構的影響
鰓組織作為中華絨螯蟹重要的呼吸器官,是抵御水環境中病害侵蝕的第一道屏障,同時還承擔調節滲透壓和調節離子平衡等重要作用[17]。據顧志峰等[18-19]報道,中華絨鰲蟹鰓組織結構中鰓腔內的膨大細胞是由上皮細胞向鰓腔內分裂形成突起,生長膨大而成,且每個上皮細胞處于不斷的生長和分裂狀態。本研究發現,嗜水氣單胞菌免疫刺激后,試驗組中華絨螯蟹行動力明顯減弱,同時鰓組織結構有明顯的病理變化,具體表現為鰓絲中上皮細胞破壞崩解、鰓絲先銳減后增厚、鰓腔增大、鰓絲中血細胞數量先減后增及鰓絲末端結構逐漸破壞解體和血細胞積聚現象等。感染初期鰓絲厚度減小,可能是因為嗜水氣單胞菌隨血液循環系統進入鰓組織后,破壞了由上皮細胞形成的鰓腔隔,導致鰓絲失去支撐而厚度減小;而之后鰓腔中血細胞數量減少,可能是受嗜水氣單胞菌分泌的溶血素等毒力因子影響而引起的敗血癥狀;但在感染后期,由于機體大量合成血細胞,在清除病原菌的同時也在鰓絲末端積聚,從而起到一定的損傷修復。
甲殼動物的肝胰腺承擔肝臟和胰臟的雙重功能,對外界影響因素極為敏感[17]。中華絨螯蟹肝胰腺作為重要的免疫器官,其組織結構的變化在一定程度上也可反映出機體對環境的適應性改變[21]。張瑤等[20-21]研究發現,致病菌檸檬酸桿菌(Citrobacter)感染中華絨螯蟹后會引起其敗血癥,造成其肝胰腺對物質合成、消化吸收及能量代謝功能的紊亂或喪失,進而破壞整個機體的新陳代謝作用,同時會使鰓組織大面積腫脹、壞死,致病蟹呼吸困難甚至窒息,最終導致病蟹死亡。洪美玲等[22]研究指出,氨氮脅迫15 d后,中華絨螯蟹肝胰腺組織中分泌細胞數量均減少,轉運泡體積明顯增大,細胞核增大且數量增多;在高含量試驗組中,部分肝小管的基膜破裂、細胞結構模糊,少量細胞核解體。在本試驗中,觀察到試驗組肝胰腺肝小管管腔面積比相比對照組有明顯增大,但感染期間基膜基本結構完整,結構和數量具有明顯變化的主要是分泌細胞和吸收細胞,也出現細胞水腫、排列紊亂及變形水解等現象。該現象與洪美玲等[22-23]研究結果類似,說明嗜水氣單胞菌免疫刺激與氨氮、重金屬脅迫對中華絨螯蟹肝胰腺組織結構的影響可能存在一定的共性。
以上結果表明,嗜水氣單胞菌免疫刺激對中華絨鰲蟹產生了明顯的毒性作用,且對其鰓組織、血淋巴組織及肝胰腺組織均造成了一定的損傷,同時機體對病原菌也可能存在一定的免疫調節能力。
3.3 嗜水氣單胞菌免疫刺激對中華絨螯蟹血淋巴中免疫相關基因表達量的影響
中華絨螯蟹為典型的無脊椎甲殼類動物,其免疫主要依靠先天性免疫系統[24]。先天免疫系統包括細胞免疫和體液免疫,它們在免疫刺激下被激活。其中甲殼動物細胞免疫主要是由血細胞來承擔的,主要包括吞噬作用、節結形成和包裹作用等;體液免疫主要是機體在外源刺激和誘導下合成和分泌的一些免疫因子,如抗菌肽,具有殺菌活性和免疫相關酶活性的凝集素、溶菌酶、酚氧化酶酶原和酚氧化酶、超氧化物歧化酶等[25]。
3.3.1 對免疫模式識別相關基因LGBP表達的影響
和其他無脊椎動物一樣,中華絨螯蟹的免疫反應主要由一些模式識別蛋白發起[26]。在節肢動物中,主要的模式識別蛋白包括β-葡聚糖結合或識別蛋白(βGBP)、脂多糖結合或識別蛋白(LBP)、肽聚糖結合或識別蛋白(PGRP)和脂多糖及β-1,3-葡聚糖結合蛋白(LGBP)。其中LGBP已經在中華絨螯蟹中被克隆出全長,并指出其在防御細菌侵染方面起非常重要的作用[25]。本試驗中也分析了中華絨螯蟹血淋巴中免疫模式識別蛋白相關基因LGBP在嗜水氣單胞菌免疫刺激后的相對表達量變化,結果發現,在菌液注射感染6 h時檢測到LGBP基因顯著下調表達(P<0.05),在12 h時有極顯著上調表達(P<0.01),隨后趨于0 h水平。說明在嗜水氣單胞菌免疫刺激后,LGBP基因參與了中華絨螯蟹清除病原菌的免疫反應。與Zhao等[27]研究結果對比,LGBP基因的極顯著上調應答時間是在細菌感染1.5 h,應答時間較本試驗結果明顯提前,但本試驗中12 h時LGBP的相對表達量水平遠遠大于1.5 h時檢測水平。推測中華絨螯蟹機體在清除病原菌時可能存在多次免疫反應過程。
3.3.2 對免疫信號傳導相關基因Tube、Dorsal和Integrin表達的影響
Toll信號通路是無脊椎動物中主要的先天免疫信號通路之一,而Tube、Dorsal基因均為Toll信號通路中的重要組件,在先天免疫系統的信號傳導中發揮著重要作用,且均已在中華絨螯蟹中克隆出cDNA全長[28-29]。本試驗中,檢測到Tube基因表達量在3、6 h顯著下調(P<0.05),12 h顯著上調(P<0.05);Dorsal基因表達量在3 h有顯著上調(P<0.05),隨后下調。說明Tube、Dorsal基因能被嗜水氣單胞菌誘導表達,且可能存在一定的應答次序。
整合素(Integrin)是一種介導細胞和其外環境之間的連接的跨膜受體,在細胞遷移、分化和存活中起關鍵作用。Huang等[30]在中華絨螯蟹中克隆出β亞型整合素,并提出作為細胞受體,中華絨螯蟹整合素蛋白能結合多種細菌,對抗菌免疫具有重要作用;且在被脂多糖、肽聚糖、金黃色葡萄球菌(Staphyloccocusaureus)或副溶血弧菌(Vibrioparahaemolyticus)脅迫時,Integrin基因表達量會顯著上調[30]。本試驗中也觀察到,與對照組相比,試驗組中Integrin基因在3、6、12 h時均表現為顯著(P<0.05)或極顯著上調(P<0.01),說明Integrin基因在中華絨螯蟹先天免疫反應中擁有重要功能。
3.3.3 對免疫效應相關基因PPAF、PXN、GST、GPx和SOD的表達影響
酚氧化酶原激活酶(PPAF)為一類催化酚氧化酶酶原成為酚氧化酶的酶類,是酚氧化酶原系統中的重要組成成員,可通過級聯反應最終激活酚氧化酶系統[31]。研究表明,在嗜水氣單胞菌免疫刺激后,血細胞中PPAF基因會立刻啟動轉錄相應mRNA,合成蛋白行使功能[25]。本試驗中,對照組PPAF基因在3 h上調表達,隨后下調表達,趨于0 h水平;而試驗組PPAF基因則在受菌免疫刺激后,處于持續下調表達,在12 h達最小值;且與對照組相比,試驗組中PPAF基因的相對表達水平顯著降低(P<0.05)。結合鰓組織切片結果分析,在菌免疫刺激后,鰓腔中血細胞數量有先降后升的趨勢,12 h時鰓腔中血細胞數量最少,且由于PPAF基因在肝胰腺組織表達最高,在血細胞中表達相對較少[25],由此推測,嗜水氣單胞菌免疫刺激后,中華絨螯蟹血細胞數量的減少和PPAF主要在肝胰腺中表達的特點可能是導致該基因持續下調表達的原因。
細胞黏附蛋白(PXN)是甲殼動物中最早鑒定出的細胞黏附分子[32],和人的髓過氧化物酶具有類似的結構,是一類具有細胞黏附特性和過氧化物酶活性的免疫分子,能與整合素結合,并與胞外的超氧化物歧化酶協同作用發揮免疫效應,同時也與酚氧化酶原系統的激活有關,參與多種病原體的清除過程[33]。本試驗中檢測到PXN基因在菌免疫刺激后表達量降低,且在12 h有最低值,原因可能與PPAF表達量持續降低類似。
谷胱甘肽硫轉移酶(GST)、谷胱甘肽過氧化物酶(GPx)和超氧化物歧化酶(SOD)基因均為中華絨螯蟹抗氧化系統中的主要抗氧化酶類基因[34-36]。在甲殼動物血細胞吞噬作用過程中,會導致活性氧的產生,這些活性氧能有效殺死外源入侵者,但過多積累也會導致自身細胞的嚴重損傷。而谷胱甘肽硫轉移酶通過與還原型谷胱甘肽的巰基(-SH)結合,催化氧化應激產生的各種毒性代謝物等,使這些親電性的疏水化合物變成親水性的物質,可減少其毒性,進而保護細胞免受過量活性氧的損傷[34]。谷胱甘肽過氧化物酶可以消除機體內的過氧化氫及脂質過氧化物,阻斷活性氧自由基對機體的進一步損傷,是生物體內重要的活性氧自由基清除劑。它與體內的超氧化物歧化酶和過氧化氫酶一起構成了機體的抗氧化防御體系。超氧化物歧化酶是一種能夠催化超氧化物通過歧化反應轉化為氧氣和過氧化氫的酶,廣泛存在于各類動物、植物和微生物中,是一種重要的抗氧化劑[36]。目前,β型GST、不含硒型GPx和錳型SOD基因均在中華絨螯蟹中得到克隆,且被證實在應對菌免疫刺激均有免疫應答反應[25,34,37-38]。本試驗中,嗜水氣單胞菌免疫刺激后,GST、GPx和SOD基因在不同時段有一定的上調或下調表達,說明對菌免疫刺激均有應答。其中GST、GPx基因表達量在12 h均呈下調;而SOD基因表達量在3 h上調,在6 h顯著下調(P<0.05)。推測各基因之間可能存在一定的應答次序。
上述結果表明,在嗜水氣單胞菌免疫刺激下,中華絨螯蟹血淋巴組織中各免疫相關基因均有一定的應答反應,且各基因之間可能存在一定的應答次序或級聯關系。
綜上,嗜水氣單胞菌免疫刺激對中華絨螯蟹有明顯的毒性作用,可對其鰓、肝胰腺組織正常結構造成一定程度的破壞作用,也會顯著影響其血淋巴組織中各免疫相關基因的表達;同時在一定程度上,機體對病原菌也有一定的免疫調節能力及自我修復能力。

