化療前ALI、NLR、LMR水平對野生型晚期非小細胞肺癌患者預后的影響
姚菲菲 郭鋒 趙大海
2017年全球疾病負擔報告指出,肺癌居癌癥死亡之首[1]。非小細胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最主要的類型,約占80~85%,大部分患者發(fā)現(xiàn)時已處于晚期,失去手術(shù)機會[2]。隨著精準醫(yī)療及綜合治療手段的提高,NSCLC患者的療效有所改善,但其生存及預后仍不容樂觀,5年相對生存率僅為18.4%[3]。
TNM分期是評估NSCLC患者療效和預后的常用標準。目前推行的第8版肺癌TNM分期較之前的更加細化,但對預后的判定仍存在一定局限性[4]。
早在一個世紀前,人們已經(jīng)知曉炎癥與腫瘤進展存在相關(guān)性[5]。全身炎癥可促進腫瘤生長、侵襲和耐藥[6],也和惡病質(zhì)、癌痛以及死亡相關(guān)[7]。全身炎癥既是促進腫瘤發(fā)展的一個因素,也是腫瘤細胞惡變的必然結(jié)果[5]。因此,炎癥標志物的檢測對腫瘤患者的預后判定具有重要價值。外周血中某些全身炎癥指標,如晚期肺癌炎癥指數(shù)(Advanced lung cancer inflammation index, ALI)[7]、中性粒細胞/淋巴細胞比值(neutrophil-lymphocyte ratio, NLR)[8]和淋巴細胞與單核細胞比值(lymphocyte-monocyte ratio, LMR)[9]等,被發(fā)現(xiàn)與肺癌患者的預后有相關(guān)性。但將ALl、NLR和LMR聯(lián)合,用以評估NSCLC患者預后的研究目前較少。
本研究擬通過回顧性分析70例野生型晚期NSCLC患者的實驗室指標及無進展生存期和生存期,探討ALl、NLR、LMR對晚期NSCLC患者預后判定的臨床價值。
資料與方法
一、研究對象
選取安徽省宿州市立醫(yī)院呼吸內(nèi)科2015年12月至2018年12月間入院,經(jīng)組織學或細胞學確診且不可手術(shù)切除的Ⅲ~Ⅳ期NSCLC患者70例。其中,男51例、女19例,年齡48~85歲,中位年齡66歲。TNM分期:Ⅲ期26例,Ⅳ期44例;病理類型:腺癌37例,鱗癌33例。
二、治療方法
肺鱗癌患者采用鹽酸吉西他濱聯(lián)合順鉑(GP)化療方案,吉西他濱1000mg/m2,第1 d、8 d靜脈滴注;順鉑75mg/m2,第1~3 d靜脈滴注。肺腺癌患者采用培美曲塞二鈉聯(lián)合順鉑(AP)化療方案,培美曲塞二鈉500mg/m2,第1 d靜脈滴注;順鉑75mg/m2,第1~3 d靜脈滴注。21 d為一個周期,治療2個周期后統(tǒng)計分析患者近期療效。
三、檢測指標
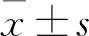
檢測指標包括體重指數(shù)(BMI)、血清白蛋白(Alb)、ALI、NLR、LMR等。BMI=體重(kg)/身高(m)2,ALI=(BMI×Alb)/NLR。
四、隨訪方法
隨訪時間自化療之日起至末次隨訪或死亡,隨訪方式包括門診復查、電話隨訪。隨訪截止時間為2019年06月30日。
五、療效評價
臨床病理分期采用國際抗癌聯(lián)盟制定的第7版和第8版TNM分期標準。療效評價指標包括近期和遠期療效。近期療效參照實體瘤療效評價標準1.1版:完全緩解(complete response, CR),腫瘤完全消失,腫瘤不能被顯示;部分緩解(partial response, PR),腫瘤明顯縮小,體積比治療前減少(≥ 50%);疾病穩(wěn)定(stable disease, SD),腫瘤體積比治療前減少(<50%)或增大(<25%);疾病進展(progressive disease, PD),腫瘤體積比治療前增大(≥ 25%)或出現(xiàn)新發(fā)病灶。對于CR、PR或SD需要穩(wěn)定4周以上方可確認。遠期療效觀察無進展生存期(progression free survival,PFS)和總生存期(overall survival,OS)。PFS指從初次治療日起至患者狀態(tài)惡化無法堅持化療或第1次發(fā)現(xiàn)復發(fā)轉(zhuǎn)移或死亡的時間。OS指從初次治療日到死亡的時間。
六、分組方法
根據(jù)ALI、NLR、LMR受試者工作特征(ROC)曲線取最大約登指數(shù)時對應的指標值為截斷點,將患者分組。
七、統(tǒng)計學方法
結(jié) 果
一、臨床特征
根據(jù)美國東部腫瘤協(xié)作組(ECOG)評分,4例(5.7%)為0,35例(50.0%)為1,31例(44.3%)為2。患者接受化療2周期后療效評價如下:PR 20例(28.6%),SD 31例(44.3%),PD 19例(27.1%)。到隨訪結(jié)束,死亡32例(45.7%),存活38例(54.3%),中位PFS為6月,中位OS為11月。
二、ALI、NLR、LMR和臨床特征與2周期療效的關(guān)系
ALI分組與NLR分組患者在年齡、性別、組織學等方面均無明顯差異(P>0.05)。LMR分組在性別上存在差異(P<0.05)。中位ALI、NLR、LMR及范圍分別為25.25(7.67~123.20)、3.09(0.73~9.67)、3.20(1.05~11.43)。ROC曲線的AUC分別為0.812、0.778、0.678,以ALI最大,優(yōu)先考慮ALI和NLR對NSCLC患者生存的預測價值。ALI、NLR、LMR的最大約登指數(shù)分別為0.447、0.322、0.199,對應指標數(shù)值分別為18.83、4.53、3.14,此時指標預測OS的靈敏度、特異度分別是92.2%和73.7%;73.7%和80.4%;66.7%和63.2%。據(jù)此將患者分成ALI ≤18.83組(炎癥重)和ALI>18.83組(炎癥輕),或NLR <4.53組(炎癥輕)和NLR ≥ 4.53組(炎癥重),或LMR ≤3.14組(炎癥重)和ALI > 3.14組(炎癥輕)。2周期療效在各組間均有統(tǒng)計學差異(ALI分組和NLR分組P<0.01,LMR分組P<0.05)(見圖1,表1,2)。

圖1 ALI、NLR、LMR預測NSCLC患者預后的ROC曲線

表1 NSCLC患者ALI、NLR、LMR分組結(jié)果

表2 ALI、NLR、LMR分組患者臨床特征及2周期療效比較
三、PFS、OS和臨床特征與ALI、NLR、LMR的關(guān)系
NSCLC患者的PFS、OS和性別、年齡、病理分型無關(guān)(P>0.05),與LMR分組無關(guān)(P>0.05),但和分期、療效、ALI、NLR水平相關(guān)。ALI ≤18.83組和>18.83組中位PFS估計值分別為4.00月和17.00月(P<0.01),而中位OS估計值分別為10.00月和19.00月(P<0.01)。在NLR<4.53組和 ≥ 4.53組中位PFS估計值分別為14.00月和4.00月(P<0.01),而中位OS估計值分別為18.00月和11.00月(P<0.01)。ALI兩組間和NLR兩組間的PFS和OS均具有統(tǒng)計學差異(見表3,圖2)。

圖2 ALI、NLR、LMR不同組別的PFS、OS生存曲線

表3 PFS和OS與臨床特征及ALI、NLR、LMR的關(guān)系
四、ALI、NLR、LMR預測NSCLC患者遠期療效
校正年齡、性別和分型后,多變量Cox回歸分析提示ALI是PFS和OS的一個重要預測因子(P<0.05),低ALI提示預后不良。而NLR、LMR則無明顯預測價值(P>0.05)(見表4、5)。

表4 ALI、NLR、LMR預測NSCLC患者PFS價值

表5 ALI、NLR、LMR預測NSCLC患者OS價值
討 論
癌癥和炎癥密切相關(guān),炎癥不僅會增加患者患癌風險,也與腫瘤患者的不良預后相關(guān)。血液學炎癥指標易于檢測且經(jīng)濟實用,利于標化[10],探討其與NSCLC預后的關(guān)系已成為當前研究熱點。NLR與NSCLC的進展相關(guān),為其獨立的生存預測因子[8]。腫瘤患者的消瘦和低白蛋白血癥都與持續(xù)的全身炎癥有關(guān)[11],癌癥晚期患者BMI降低很常見,是惡病質(zhì)的常規(guī)診斷標準[12]。ALI指標由Jafri等提出[7],它綜合納入了NLR、BMI、Alb這幾個和腫瘤進展相關(guān)的指標,比單純NLR更有參考價值。因此,低ALI對肺癌患者而言意味著肺癌進展、預后不良[13]。LMR最早用于判定某些血液病的預后,近年來才推廣到各種實體瘤,對臨床具有一定的指導意義[14]。
Jafri等[7]發(fā)現(xiàn),低ALI(<18)與晚期NSCLC的PFS和OS不良顯著相關(guān),是獨立預測指標。在ALI與小細胞肺癌(small cell lung cancer,SCLC)的預后相關(guān)性研究中,也發(fā)現(xiàn)低ALI(<19.5)和SCLC的OS不良顯著相關(guān),同樣也是SCLC的獨立預后因素[15]。此后,陸續(xù)發(fā)現(xiàn)ALI與術(shù)后的NSCLC及其它多種腫瘤(大B細胞淋巴細胞瘤[13]、食管鱗癌[16]、頭頸部鱗癌[17]、結(jié)直腸癌[6]等)的預后密切相關(guān)。在本研究中,ALI ≤18.83的患者2周期化療療效明顯較差(P<0.01),PFS和OS均較短(P<0.01)。多因素回歸分析發(fā)現(xiàn)ALI是肺癌患者OS的獨立預測因素,這與前述研究一致。文獻報道的ALI截斷值多在18~19.5之間,本研究取值18.83。
腫瘤組織中,中性粒細胞高預示著不良結(jié)果,而淋巴細胞則相反[18]。Zahorec等[19]研究發(fā)現(xiàn),NLR可用于快速評判腫瘤患者的病情嚴重程度,數(shù)值越高病情越重,反之則相對較輕。對于可以實施手術(shù)的各期NSCLC患者,術(shù)前高水平NLR是其術(shù)后低生存率的獨立危險因素[8,20-21]。對于晚期NSCLC患者,NLR既是預后指標,又是療效預測指標[22-23]。對各型肺癌的META分析表明,NLR升高是肺癌患者OS較差的一個預測因子[24]。另一項META則發(fā)現(xiàn),NLR截斷值為5時,似乎與NSCLC患者預后及療效較差相關(guān)性更強[18]。在本研究中也得到類似結(jié)論,NLR和療效、預后顯著相關(guān),高NLR的NSCLC患者療效、預后都更差。但在納入ALI的多因素分析后,僅發(fā)現(xiàn)ALI是唯一具有預測價值的因素,而NLR的預測價值不再顯著。這或許說明盡管NLR具備一定的療效和預后預測功能,但價值不如參考更多因素的ALI。ROC曲線的AUC排序也印證了ALI的預測價值。至于NLR的截斷值,本研究取值為4.53,和META分析的截斷值5十分接近。
LMR最先用于血液病如霍奇金淋巴瘤的生存期預測,低LMR為經(jīng)典型霍奇金淋巴瘤[25]與結(jié)節(jié)性淋巴細胞為主型霍奇金淋巴瘤[26]的PFS和OS預后不良的獨立預測因子。近年來,在對NSCLC的研究中,LMR也顯示出其獨立預測生存的價值,低LMR患者生存期更短[9]。本研究發(fā)現(xiàn)LMR與NSCLC患者年齡存在差異,可能與樣本量較少以及女性比例較低有關(guān),并不具臨床意義。同時也未發(fā)現(xiàn)LMR和化療效果及預后之間的相關(guān)性,有異于Hu[9]的研究結(jié)果,可能與選取的截斷值不同有關(guān)。
體重并不能準確反映身體狀態(tài)變化,對于腫瘤腫塊較大或積液較多的患者,其體重減輕可以不明顯[12],因此需謹慎對待ALI對此類患者的預測價值。提出ALI的學者Jafri認為,抑或采用骨骼肌指數(shù)代替BMI來計算ALI會更科學[27]。
總之,臨床評估晚期NSCLC患者時,應考慮其全身炎癥嚴重程度,ALI≤18.83是預后不良的獨立指標。因此,只要條件許可,應盡快對此類人群進行化療。

