應用肝分區評估法對不同鉛門模式門脈癌栓螺旋斷層放療劑量學特性分析
解傳濱,徐壽平,戴相昆,陳高翔,葛瑞剛,鞏漢順,曲寶林
中國人民解放軍總醫院第一醫學中心放療科,北京100853
前言
隨著技術的進步,放射治療已進入精準放療的新時代。螺旋斷層放射治療(Helical Tomotherapy,HT)作為一種新興的放射治療技術,以其較強的射束調制能力在眾多腫瘤的放射治療中顯示出明顯優勢[1‐2]。而隨著HT技術的發展,在原來技術基礎上又出現了動態鉛門與動態床等技術,為進一步減少常規螺旋照射中靶區上下界劑量延伸和提高計劃實施效率等帶來可能[3‐5]。本研究應用肝臟分區評估的方法探究不同鉛門模式下門脈癌栓HT 的劑量學特性,為臨床應用提供參考。
1 資料與方法
1.1 臨床病例及定位方法
選擇2017年12月~2018年9月于中國人民解放軍總醫院第一醫學中心放療科行HT治療的治療門脈癌栓患者共12例,其中,男7例,女5例,中位年齡55歲。所有病均取仰臥位熱塑體膜固定,在SEMENS 64排CT模擬定位機上行掃描定位,掃描層厚3 mm,掃描范圍為兩乳頭連線至左右髂前上棘連線。
1.2 輪廓定義及處方劑量
將定位掃描圖像以DICOM 格式傳輸至Eclipse計劃工作站,參照ICRU 50、62 號報告由同一名醫師進行靶區及危及器官勾畫,包括臨床靶區(Clinical Target Ⅴolume, CTⅤ)、計 劃 靶 區(Planning TargetⅤolume,PTⅤ),危及器官勾畫包括脊髓、雙側腎、胃及肝臟,并且根據靶區與肝臟解剖關系將肝臟超出靶區上緣部分定義為肝上區(Lsup),超出靶區下緣部分定義為肝下區(Linf),中間部分定義為肝中區(Lmid),如圖1所示。給予PTⅤ處方劑量為60 Gy/28 F。
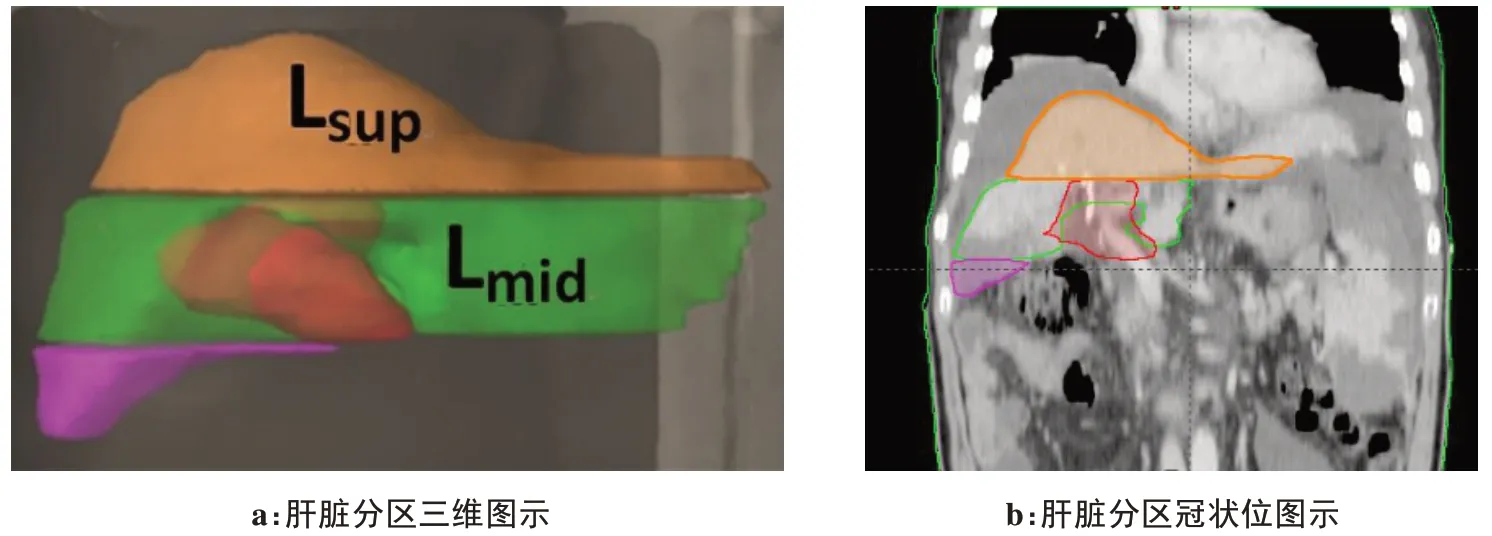
圖1 肝臟分區方法示意圖Fig.1 Diagram of liver segments
1.3 計劃設計及評估指標
由物理師完成相關計劃輔助結構勾畫后,將圖像及輪廓數據傳輸至Tomotherapy Hi.Art 計劃系統,按照兩種鉛門模式(fixed、dynamic)與3 種射野寬度(Field Width,FW)1.0、2.5、5.0 cm 進行組合,設計3組靜態鉛門(Fixed Jaw, FJ)計劃(F1.0、F2.5、F5.0)及2 組動態鉛門(Dynamic Jaw,DJ)計劃(D2.5、D5.0)。目標函數設置處方劑量覆蓋靶區95%體積,所有計劃螺距值(pitch)均選用0.35,調制因子(Modulate Factor, MF)選用2.4。
靶區劑量評價指標包括:D2、D98、Ⅴ60、均勻性指數(HI)及適形度指數(CI),其中HI=(D2‐D98)/DT(D2、D98分別表示2%和98%靶區體積所受照劑量,DT為處方劑量),HI越接近0 表示靶區劑量均勻性越好;CI=(TⅤpv)2/(TⅤ×PⅤ)(TⅤpv為處方劑量所覆蓋靶區體積,TⅤ為靶區體積,PⅤ為處方劑量覆蓋的總體積),CI越接近1 說明靶區劑量適形度越好[6]。危及器官評價指標包括:全肝(Lall)Ⅴ5、Ⅴ10、Ⅴ20、Ⅴ30、Ⅴ40、Ⅴ50、Dmean,并結合肝上段(Lsup)及中段(Lmid)各劑量參數對各計劃組進行分析評估,同時評價胃、雙腎及脊髓Dmean及Dmax。
通過計劃的機架旋轉周期、計劃實施時間等綜合評估各計劃組的計劃實施效率。
1.4 統計學方法
應用IBM SPSS 22.0 軟件進行數據分析。計量資料用均數±標準差表示,采用配對t檢驗的方式對各計劃組劑量參數進行統計分析,P<0.05 為差異有統計學意義。
2 結果
2.1 靶區劑量評估
對靶區相關劑量學參數進行比較發現,5 種計劃均能實現處方劑量對靶區的較好覆蓋且FW 越小,靶區均勻性越好,但在相同FW 不同鉛門模式下無明顯差異。除F1.0&D2.5分析中的D2與HI外,其他各劑量學參數比較差異均無統計學意義,如表1所示。
表1 靶區劑量參數比較(±s)Tab.1 Comparison of dosimetric parameters for the target area(Mean±SD)
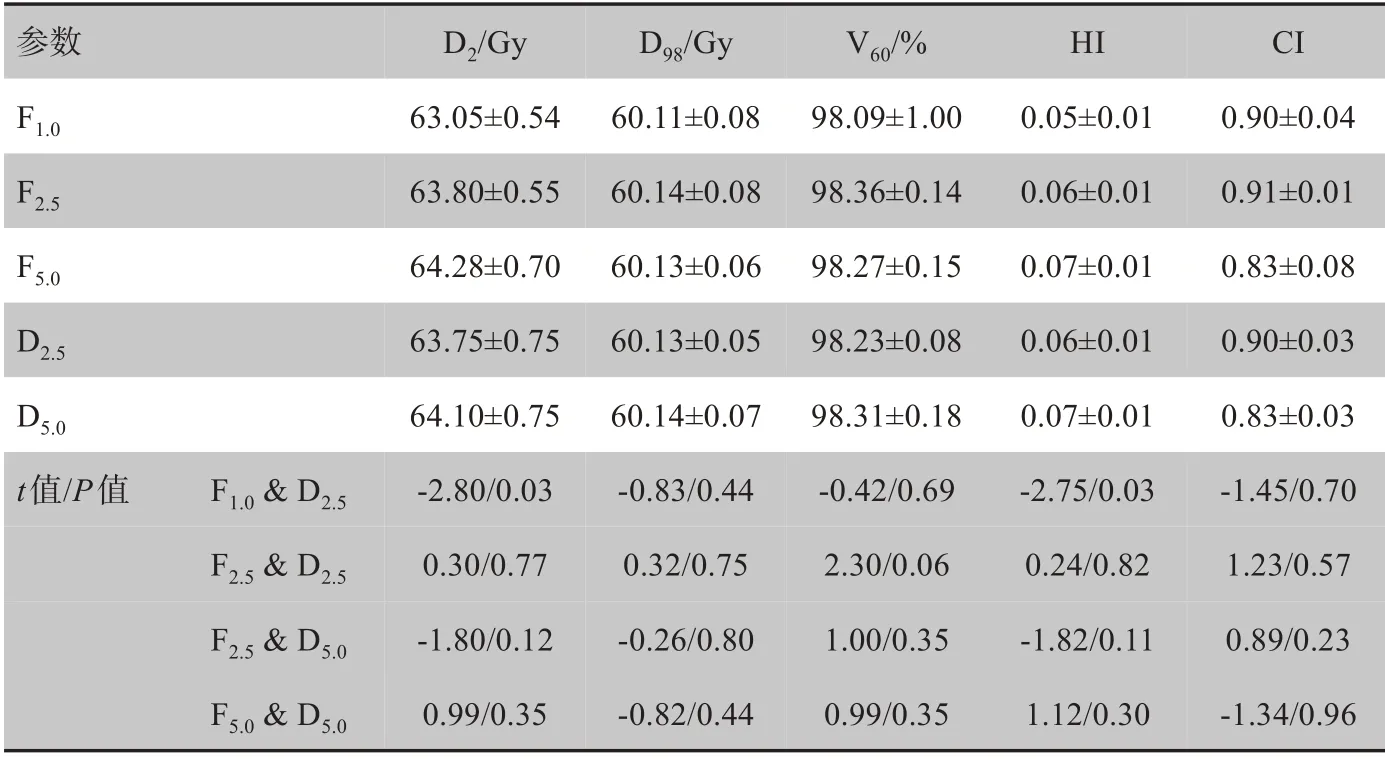
表1 靶區劑量參數比較(±s)Tab.1 Comparison of dosimetric parameters for the target area(Mean±SD)
參數F1.0F2.5F5.0D2.5D5.0 t值/P值 F1.0&D2.5F2.5&D2.5F2.5&D5.0F5.0&D5.0D2/Gy 63.05±0.54 63.80±0.55 64.28±0.70 63.75±0.75 64.10±0.75‐2.80/0.03 0.30/0.77‐1.80/0.12 0.99/0.35 D98/Gy 60.11±0.08 60.14±0.08 60.13±0.06 60.13±0.05 60.14±0.07‐0.83/0.44 0.32/0.75‐0.26/0.80‐0.82/0.44Ⅴ60/%98.09±1.00 98.36±0.14 98.27±0.15 98.23±0.08 98.31±0.18‐0.42/0.69 2.30/0.06 1.00/0.35 0.99/0.35 HI0.05±0.01 0.06±0.01 0.07±0.01 0.06±0.01 0.07±0.01‐2.75/0.03 0.24/0.82‐1.82/0.11 1.12/0.30 CI0.90±0.04 0.91±0.01 0.83±0.08 0.90±0.03 0.83±0.03‐1.45/0.70 1.23/0.57 0.89/0.23‐1.34/0.96
2.2 肝臟劑量分區評估
2.2.1 全肝受照劑量在相同鉛門模式下,隨著FW的增加,全肝受照劑量明顯增加,尤其在DJ模式下這種趨勢更為明顯。而在相同FW下,DJ計劃能顯著減少全肝劑量,并且DJ計劃能夠達到與比之小一檔FW靜態計劃相類似的肝臟劑量,甚至在低劑量區(Ⅴ5、Ⅴ10)D5.0計劃明顯優于F2.5計劃,如表2所示。
表2 全肝劑量參數比較(±s)Tab.2 Comparison of dosimetric parameters for Lall(Mean±SD)
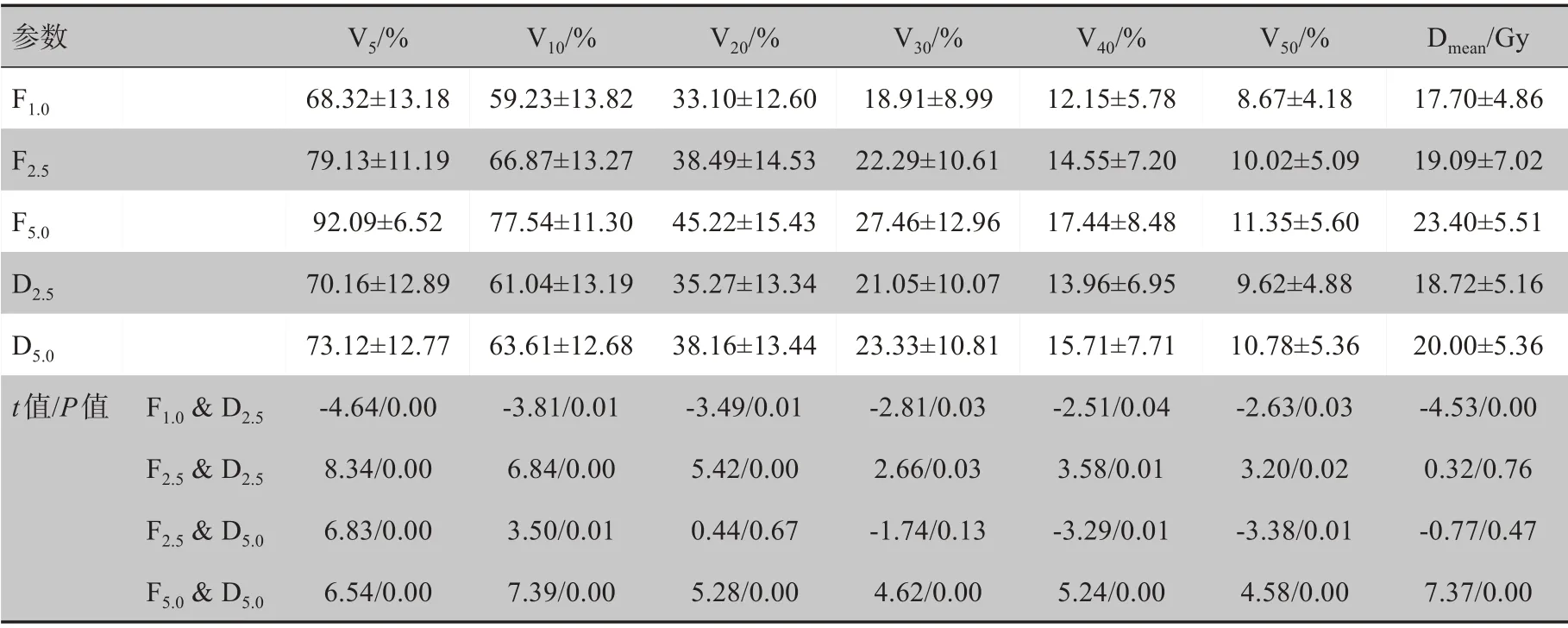
表2 全肝劑量參數比較(±s)Tab.2 Comparison of dosimetric parameters for Lall(Mean±SD)
參數F1.0F2.5F5.0D2.5D5.0 t值/P值 F1.0&D2.5F2.5&D2.5F2.5&D5.0F5.0&D5.0Ⅴ5/%68.32±13.18 79.13±11.19 92.09±6.52 70.16±12.89 73.12±12.77‐4.64/0.00 8.34/0.00 6.83/0.00 6.54/0.00Ⅴ10/%59.23±13.82 66.87±13.27 77.54±11.30 61.04±13.19 63.61±12.68‐3.81/0.01 6.84/0.00 3.50/0.01 7.39/0.00Ⅴ20/%33.10±12.60 38.49±14.53 45.22±15.43 35.27±13.34 38.16±13.44‐3.49/0.01 5.42/0.00 0.44/0.67 5.28/0.00Ⅴ30/%18.91±8.99 22.29±10.61 27.46±12.96 21.05±10.07 23.33±10.81‐2.81/0.03 2.66/0.03‐1.74/0.13 4.62/0.00Ⅴ40/%12.15±5.78 14.55±7.20 17.44±8.48 13.96±6.95 15.71±7.71‐2.51/0.04 3.58/0.01‐3.29/0.01 5.24/0.00Ⅴ50/%8.67±4.18 10.02±5.09 11.35±5.60 9.62±4.88 10.78±5.36‐2.63/0.03 3.20/0.02‐3.38/0.01 4.58/0.00 Dmean/Gy 17.70±4.86 19.09±7.02 23.40±5.51 18.72±5.16 20.00±5.36‐4.53/0.00 0.32/0.76‐0.77/0.47 7.37/0.00
2.2.2 肝上段受照劑量在相同鉛門模式下,同樣隨著FW的增加,其受照劑量明顯增加,并且增加的幅度較全肝更為明顯,尤其在FJ模式下,隨著FW的增加該段受照劑量呈倍數增長。在相同FW下,DJ能夠顯著降低該段受量:在2.5 cm FW下,DJ計劃相較于FJ計劃各參數(Ⅴ5、Ⅴ10、Ⅴ20、Ⅴ30、Ⅴ40、Ⅴ50、Dmean)分別降低了41.1%、48.0%、53.1%、42.8%、22.2%、66.9%、35.5%,而在5.0 cm FW 下,則分別降低了51.1%、60.8%、64.8%、73.9%、57.1%、63.7%、51.3%,如表3所示。
2.2.3 肝中段受照劑量鉛門模式的選擇對于肝中段劑量體積的影響不明顯,在相同FW 下,DJ 計劃較FJ計劃體現出略微降低的趨勢,但大都無統計學意義。而在相同鉛門模式下,隨著FW 的增加該段受照劑量稍有增加,如表4所示。
表3 肝上段劑量參數比較(±s)Tab.3 Comparison of dosimetric parameters for Lsup(Mean±SD)
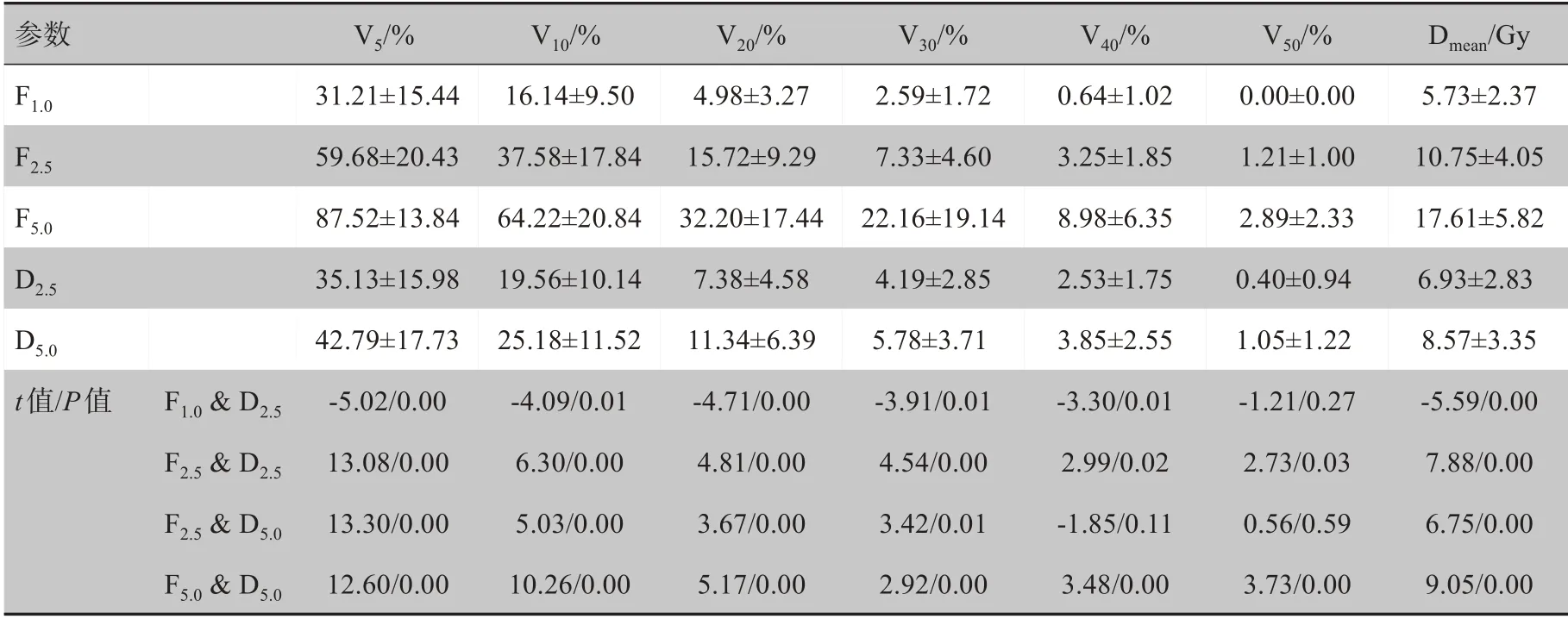
表3 肝上段劑量參數比較(±s)Tab.3 Comparison of dosimetric parameters for Lsup(Mean±SD)
參數F1.0F2.5F5.0D2.5D5.0 t值/P值 F1.0&D2.5F2.5&D2.5F2.5&D5.0F5.0&D5.0Ⅴ5/%31.21±15.44 59.68±20.43 87.52±13.84 35.13±15.98 42.79±17.73‐5.02/0.00 13.08/0.00 13.30/0.00 12.60/0.00Ⅴ10/%16.14±9.50 37.58±17.84 64.22±20.84 19.56±10.14 25.18±11.52‐4.09/0.01 6.30/0.00 5.03/0.00 10.26/0.00Ⅴ20/%4.98±3.27 15.72±9.29 32.20±17.44 7.38±4.58 11.34±6.39‐4.71/0.00 4.81/0.00 3.67/0.00 5.17/0.00Ⅴ30/%2.59±1.72 7.33±4.60 22.16±19.14 4.19±2.85 5.78±3.71‐3.91/0.01 4.54/0.00 3.42/0.01 2.92/0.00Ⅴ40/%0.64±1.02 3.25±1.85 8.98±6.35 2.53±1.75 3.85±2.55‐3.30/0.01 2.99/0.02‐1.85/0.11 3.48/0.00Ⅴ50/%0.00±0.00 1.21±1.00 2.89±2.33 0.40±0.94 1.05±1.22‐1.21/0.27 2.73/0.03 0.56/0.59 3.73/0.00 Dmean/Gy 5.73±2.37 10.75±4.05 17.61±5.82 6.93±2.83 8.57±3.35‐5.59/0.00 7.88/0.00 6.75/0.00 9.05/0.00
表4 肝中段劑量參數比較(±s)Tab.4 Comparison of dosimetric parameters for Lmid(Mean±SD)
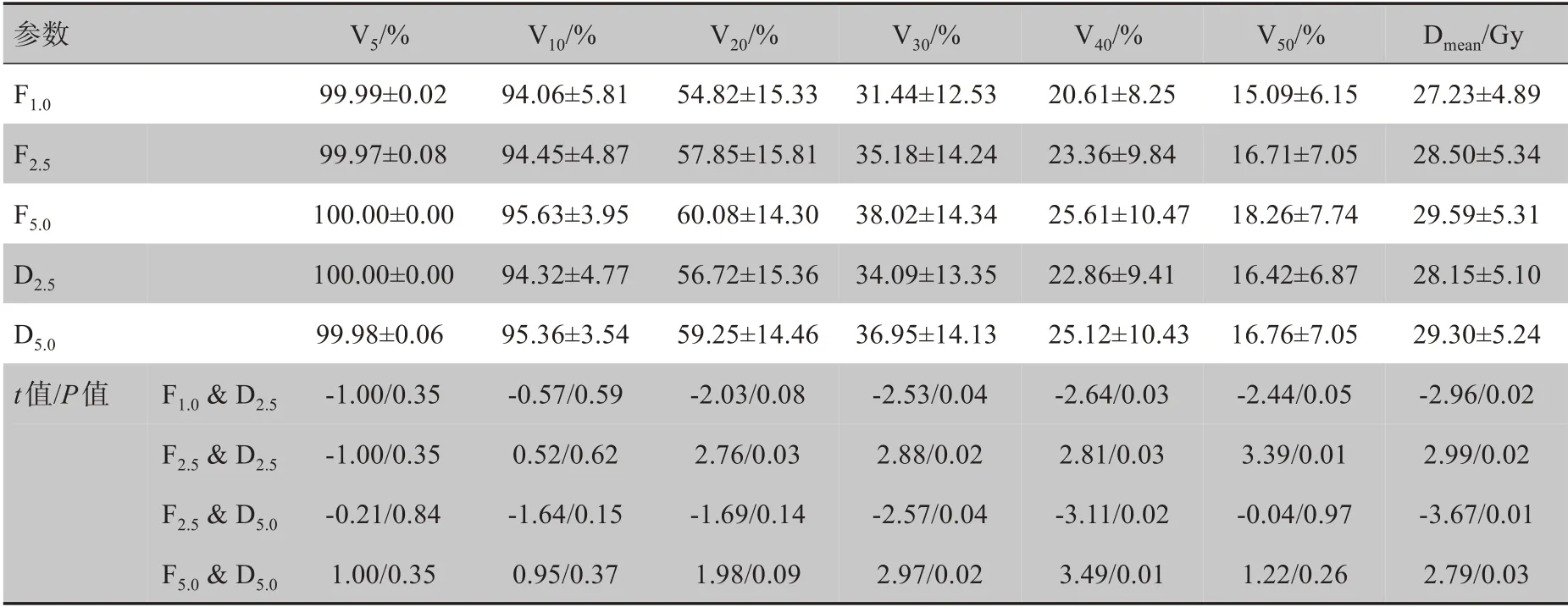
表4 肝中段劑量參數比較(±s)Tab.4 Comparison of dosimetric parameters for Lmid(Mean±SD)
參數F1.0F2.5F5.0D2.5D5.0 t值/P值 F1.0&D2.5F2.5&D2.5F2.5&D5.0F5.0&D5.0Ⅴ5/%99.99±0.02 99.97±0.08 100.00±0.00 100.00±0.00 99.98±0.06‐1.00/0.35‐1.00/0.35‐0.21/0.84 1.00/0.35Ⅴ10/%94.06±5.81 94.45±4.87 95.63±3.95 94.32±4.77 95.36±3.54‐0.57/0.59 0.52/0.62‐1.64/0.15 0.95/0.37Ⅴ20/%54.82±15.33 57.85±15.81 60.08±14.30 56.72±15.36 59.25±14.46‐2.03/0.08 2.76/0.03‐1.69/0.14 1.98/0.09Ⅴ30/%31.44±12.53 35.18±14.24 38.02±14.34 34.09±13.35 36.95±14.13‐2.53/0.04 2.88/0.02‐2.57/0.04 2.97/0.02Ⅴ40/%20.61±8.25 23.36±9.84 25.61±10.47 22.86±9.41 25.12±10.43‐2.64/0.03 2.81/0.03‐3.11/0.02 3.49/0.01Ⅴ50/%15.09±6.15 16.71±7.05 18.26±7.74 16.42±6.87 16.76±7.05‐2.44/0.05 3.39/0.01‐0.04/0.97 1.22/0.26 Dmean/Gy 27.23±4.89 28.50±5.34 29.59±5.31 28.15±5.10 29.30±5.24‐2.96/0.02 2.99/0.02‐3.67/0.01 2.79/0.03
2.3 其他危及器官劑量評價
對其他危及器官劑量參數進行分析發現,雙腎、胃及脊髓的各劑量參數在各鉛門模式下隨著FW 的增加均體現出略有增加的趨勢,而在相同FW 下,DJ鉛門計劃能有效降低右腎及胃的平均劑量(Dmean)且差異具有統計學意義,如表5所示。
表5 其他危及器官劑量參數比較(±s,Gy)Tab.5 Comparison of dosimetric parameters for other organs-at-risk(Mean±SD,Gy)
胃參數左腎Dmean右腎DmeanDmeanDmax脊髓DmaxF1.0F2.5F5.0D2.5D5.0 t值/P值 F1.0&D2.5F2.5&D2.5F2.5&D5.0F5.0&D5.03.85±3.15 6.29±6.95 6.43±3.24 3.79±2.68 4.38±2.84 0.14/0.90 1.18/0.30 0.92/0.41 3.53/0.02 3.88±2.31 4.94±2.36 6.97±2.46 4.32±2.08 4.96±2.41‐0.92/0.41 3.30/0.03‐0.14/0.89 15.97/0.00 8.74±2.61 9.92±2.54 12.75±3.55 8.89±2.70 9.63±2.66‐1.02/0.34 4.87/0.00 1.00/0.35 3.75/0.01 33.20±15.47 36.96±13.41 43.59±10.16 35.60±15.83 36.58±14.03‐1.93/0.10 1.10/0.31 0.57/0.59 2.92/0.02 18.99±2.66 20.26±3.17 20.94±3.49 19.81±3.14 20.86±3.55‐2.78/0.03 1.65/0.14‐1.23/0.26 0.21/0.84
2.4 等劑量曲線評估
對不同計劃等劑量曲線比較分析發現,5 組計劃均實現處方劑量對靶區的較好覆蓋,并達到了較好的靶區適形度和均勻性,在FJ 模式下,隨著FW 的增加,在靶區縱向邊緣出現明顯的劑量延伸,如圖2所示。在患者冠狀位劑量分布縱軸方向同一直線上讀取各點劑量,對靶區縱向邊緣劑量梯度進行分析可以看到,DJ 兩種FW(2.5、5.0 cm)計劃均可實現與FW 1.0 cm 計劃相類似的劑量梯度,從而有效降低靶區縱向邊緣相鄰組織的受照劑量,如圖3所示。
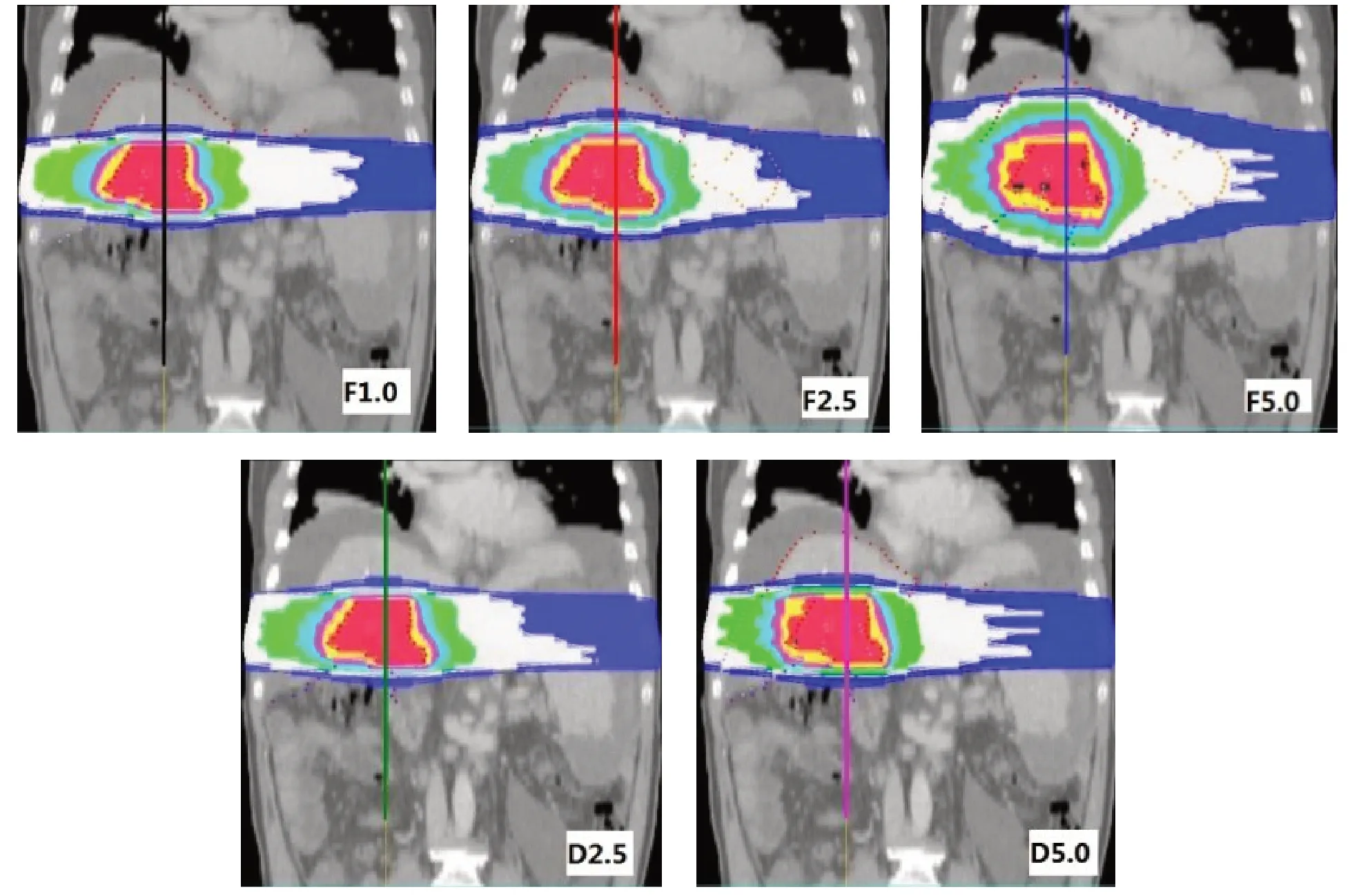
圖2 同一例患者不同計劃冠狀位等劑量曲線Fig.2 Coronal isodose curve distributions of different plans for the same patient
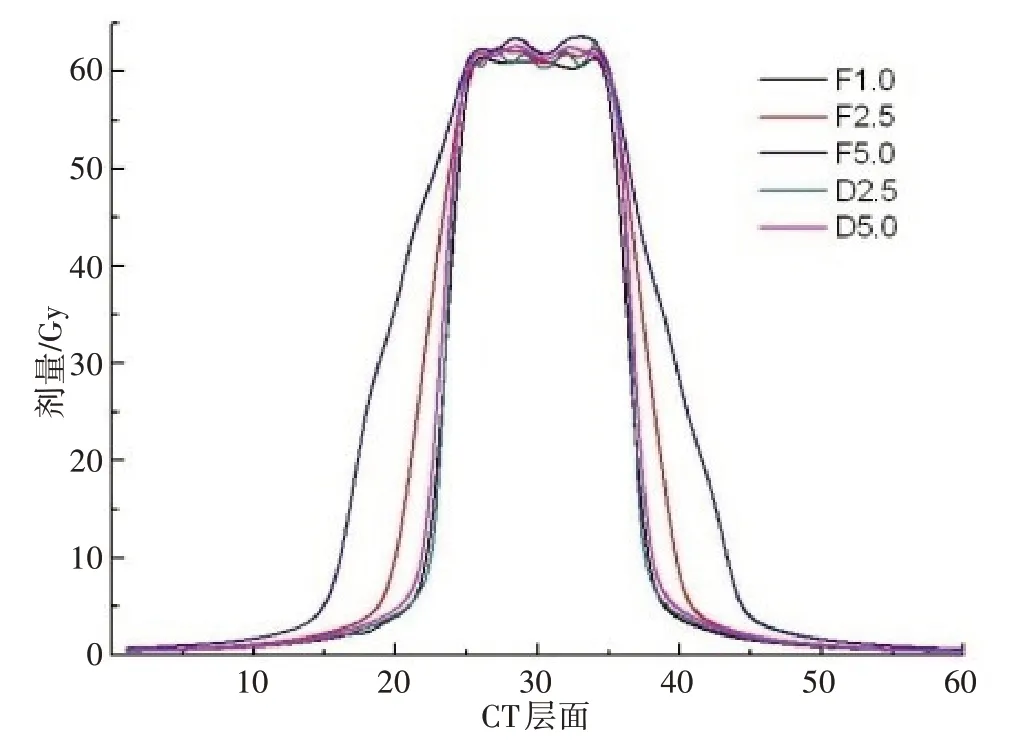
圖3 同一例患者不同計劃冠狀位縱軸劑量分布Fig.3 Dose profiles in the coronal longitudinal axis of different plans for the same patient
2.5 實施效率評價
通過對本組50例計劃的實施效率數據統計可知,FW 大小的選擇是影響計劃實施效率的主要因素,即隨著FW 的增加計劃實施效率明顯提高。如表6所示,在FJ 模式下,F2.5相較于F1.5計劃實施效率提高了54.5%,F5.0相較于F2.5提高了37.3%;在DJ 模式下,D5.0較D2.5則提高了34.6%。而在相同FW下,由于DJ計劃的機架旋轉周期略有增加導致其計劃實施效率有所下降。
3 討論
HT 是臨床中較為先進的放射治療技術之一,在各種常見腫瘤放療中有著普遍應用,尤其針對受照范圍大、形狀復雜以及緊鄰危及器官的腫瘤放療具有顯著優勢[7‐9]。在HT的照射實施過程中,在滑環機架連續旋轉同時治療床在縱軸方向上連續移動以實現旋轉的扇形束射野對靶區的劑量覆蓋,因此照射劑量縱向分布特性與其射野(鉛門)寬度與螺距值的選擇密切相關[10‐11]。對于傳統FJ技術而言,整個治療實施過程中FW 一直保持預設寬度,通過射線束的螺旋疊加以實現對整個靶區的劑量覆蓋,因此在較大FW 條件下,靶區縱向邊緣存在不同程度的劑量延伸現象從而導致縱向毗鄰的組織器官受照劑量增加[12]。雖然可以通過選用較小FW 得到適度的解決,但又帶來了治療時間大幅度增加的問題[13]。
表6 不同計劃組實施效率比較(±s)Tab.6 Comparison of delivery efficiency among different groups(Mean±SD)
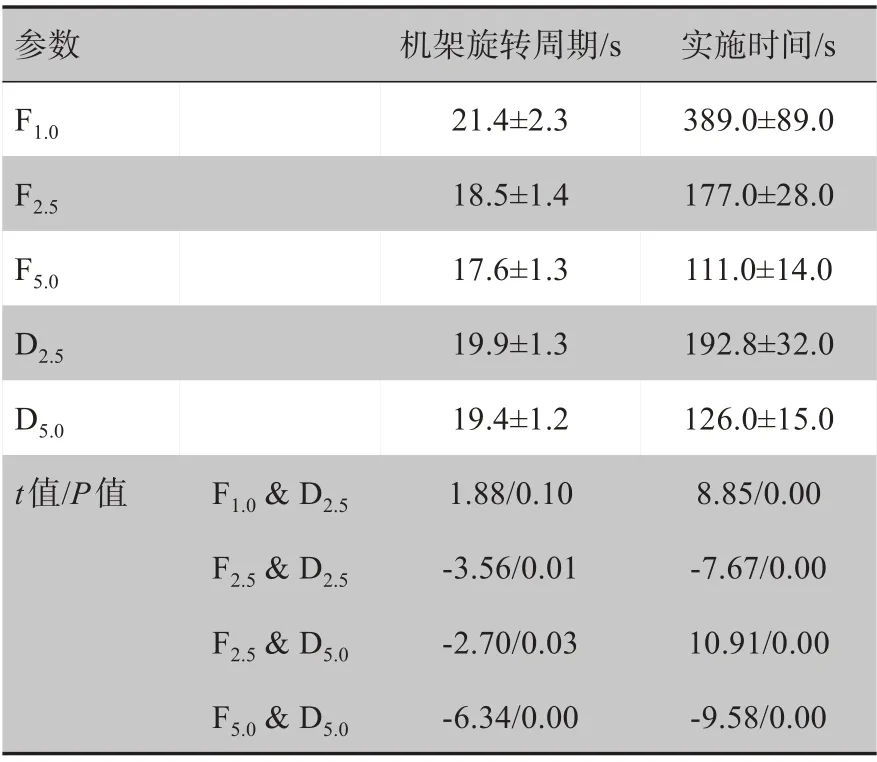
表6 不同計劃組實施效率比較(±s)Tab.6 Comparison of delivery efficiency among different groups(Mean±SD)
參數F1.0F2.5F5.0D2.5D5.0 t值/P值 F1.0&D2.5F2.5&D2.5F2.5&D5.0F5.0&D5.0機架旋轉周期/s 21.4±2.3 18.5±1.4 17.6±1.3 19.9±1.3 19.4±1.2 1.88/0.10‐3.56/0.01‐2.70/0.03‐6.34/0.00實施時間/s 389.0±89.0 177.0±28.0 111.0±14.0 192.8±32.0 126.0±15.0 8.85/0.00‐7.67/0.00 10.91/0.00‐9.58/0.00
為了平衡靶區縱向半影與治療時間的問題,HT在其新機型TomoEdge 上推出了DJ 技術。該技術在投照過程中實現了在靶區縱向邊緣鉛門的調制,即當靶區前端開始進入照射場時,射野起始寬度為1.0 cm,隨著靶區向前移動,前端鉛門隨之逐漸打開直至預設射野寬度,而在靶區后端逐漸離開照射場階段,后端鉛門跟隨靶區移動而使射野逐漸變窄,直至1.0 cm[14‐15]。研究表明,實際臨床應用中很多臨床病例可以通過5.0 cm FW 的DJ 計劃替代2.5 cm FW 的FJ 計劃,在實現相近計劃質量基礎上提高計劃的實施效率[16‐17]。但也有研究指出,在前列腺癌局部加盆腔淋巴引流區照射時,5.0 cm FW 的DJ 計劃相較于2.5 cm FW 的FJ計劃還是明顯增加了膀胱、直腸以及小腸的受照劑量[18],同樣在頭頸部腫瘤累及顱底以上者,也存在著顱腦受照劑量增加的問題,雖然沒有顯著的統計學意義,但研究者認為與臨床相關[19]。而靶區位于視覺系統以下的病例,采用5.0 cm FW 的DJ 計劃同樣可實現晶體的有效保護。由此看出,實際臨床應用中,靶區與危及器官的毗鄰關系是決定鉛門模式和FW選擇的首要考慮因素。
本研究以門脈癌栓病例作為研究對象,應用不同鉛門模式及FW 大小設置進行計劃設計,并在根據靶區與肝臟的解剖關系將肝臟進行分區的基礎上,定量分析不同計劃模式下各肝臟分區的劑量學參數及特性。對于全肝而言,靶區與之屬于內包含關系,其受照劑量與靶區各向邊緣劑量梯度皆密切相關,本研究結果表明,采用D5.0計劃能夠達到F2.5計劃相當的肝臟受照劑量,甚至在低劑量區取得更好的保護效果,這與宋明永等[20]對HT 治療肺癌時不同鉛門模式的應用研究中患側肺的研究結果相類似。肝上段與靶區上緣相毗鄰,其受照劑量直接相關于靶區的縱向劑量梯度,因此為達到較好的保護效果,FJ 模式下的計劃設計只能選擇較小的FW,但這又不可避免地帶來了治療時間明顯增加的問題,而DJ 計劃很好地解決了這個問題。研究結果表明,D5.0計劃在取得比F2.5更好的保護效果同時,將計劃的實施效率提高了37.3%。由此可以看出,對于正常器官與靶區縱向相鄰的病例,應該選擇DJ 模式下的較大FW 進行計劃設計。而肝中段只在橫斷面上與靶區相關,其受照劑量主要受靶區橫向邊緣的劑量梯度影響,因此對其劑量學參數進行評估發現其受照劑量在不同鉛門模式下并無顯著改變,但在相同鉛門模式下,該段劑量還是隨著FW 的增大表現出明顯增加的趨勢,這也說明了FW 的選擇與靶區橫向劑量梯度具有相關性,雖然增加的幅度并不明顯,但在臨床選擇中還是應該予以考慮,特別是對于徑向變化較大的復雜靶區[21]。
4 結論
動態鉛門技術可有效降低由于FW 增加而引起的靶區縱向邊緣劑量延伸,進而提高靶區縱向邊緣的劑量梯度,可在縱軸方向上對肝臟等危及器官及正常組織的受照劑量起到顯著的降低作用。

