文心蘭HSP70基因的克隆及表達分析
馮保云 李蓉 賴鐘雄 林玉玲

摘 ?要:為研究文心蘭熱激蛋白70基因(命名為OnHSP70)的分子特性及表達特點,以文心蘭‘檸檬綠(Oncidium hybridum ‘Honey Angel)為材料,采用RT-PCR技術克隆OnHSP70,利用生物信息學方法分析其分子特性,通過qRT-PCR技術分析其在不同組織及不同非生物脅迫處理下的表達特點。生物信息學分析表明:該基因開放閱讀框為1944 bp,編碼647個氨基酸,翻譯的蛋白為穩定蛋白,屬于HSP70超家族,其蛋白二級結構由41.11%的α-螺旋、17.77%的延伸鏈、7.73%的β-轉角和33.38%的無規卷曲組成,具有2個高度保守的功能域。聚類分析表明:該蛋白與鐵皮石斛和深圳擬蘭的HSP70親緣關系較近。qRT-PCR分析表明:文心蘭HSP70在4種不同組織器官中具有表達差異性,在花中的表達量最高;高溫處理后基因的表達量明顯上升;40 ℃高溫脅迫4 h時表達量達峰值;茉莉酸甲酯及水楊酸處理時表達量呈現下調響應。本研究為后期該基因功能研究及提高文心蘭對高溫的適應性提供理論基礎。
關鍵詞:文心蘭;HSP70;克隆;非生物脅迫;表達分析
中圖分類號:Q786;Q949.718.43 ? ? ?文獻標識碼:A
Abstract: In order to study the molecular characteristics of the heat shock protein gene (named OnHSP70) and its expression patterns in O. hybridum ‘Honey Angel, OnHSP70 was cloned by RT-PCR, its molecular characteristics was analyzed by bioinformatics, and its expression patterns in different tissues and under different abiotic stress treatment were carried out by qRT-PCR. Bioinformatics analysis showed that the open reading frame of the gene was 1944 bp, encoding 647 amino acids, and the translated protein was a stable protein belonging to the HSP70 superfamily. The secondary structure of the protein consisted of 41.11% α-helix, 17.77% extended chain, 7.73% β-turn and 33.38% random coil, and had two highly conserved functional domains. Clustering analysis showed the protein had closely relative to HSP70 from Dendrobium catenatum and Apostasia shenzhenica. qRT-PCR analysis showed OnHSP70 differentially expressed in four tissues and the highest expression level was found in flowers; the expression of OnHSP70 gene increased significantly after high temperature treatment, and reached the peak under 40 ℃ for 4 h treatment; OnHSP70 showed down-regulated under methyl jasmonate and salicylic acid treatment. The study would provide a theoretical basis for studying the gene function and improving the adaptability to high temperature of Oncidium hybridum.
Keywords: Oncidium hybridum; HSP70; cloning; abiotic stress; expression analysis
DOI: 10.3969/j.issn.1000-2561.2020.04.016
文心蘭(Oncidium hybridum)是蘭科(Orchi-daceae)文心蘭屬(Oncidium),又名吉祥蘭、舞女蘭、金蝶蘭等。起源于美洲熱帶地區,喜濕潤和半陰環境,屬于熱帶氣生蘭。植株輕盈、花莖自然下垂、花朵奇特、靜時形似優雅舞者,動又如翩翩金蝶,是世界重要的切花和盆花種類之一,具有較高的經濟價值。商業用文心蘭多為花色優美、常年開花的優良雜交種。文心蘭生長發育進程受溫度影響較大,福建省地處東南沿海,屬于溫暖濕潤的亞熱帶氣候,是文心蘭的適宜栽植區,但不同區域氣候差異性較大。福州等地夏季持續35 ℃以上高溫,極易導致植株生長發育不良,不僅會影響當季切花的質量,而且高溫易造成假鱗莖皺縮[1],從而影響秋、冬季開花的產量和品質,造成巨大的經濟損失,并且隨著溫室效應的加劇,極端高溫天氣頻發,提高文心蘭植株的抗高溫能力是育種與栽培的研究目標之一[2]。
熱激蛋白(heat shock protein, HSP),又稱為熱休克蛋白。當生物有機體受到多種生物(病害等)或非生物脅迫時(如高溫、冷害等)會使其基因表達增強[3-4],是生物有機體最保守的保護機制之一。1962年在果蠅研究中,熱激蛋白被首次發現,之后大量實驗研究結果表明熱激蛋白功能廣泛。一般地,HSPs作為分子伴侶參與蛋白質的折疊與去折疊,協助蛋白質正確裝配,參與蛋白質運輸和降解[5]。按分子量的大小可將HSPs分為:HSP100、HSP90、HSP70、HSP60、HSP40和小分子HSP等6個超基因家族。其中HSP70是在生物體內分布最廣、研究最多且在熱激蛋白家族中進化上最保守的一類熱激蛋白,根據功能不同可將HSP70分為:參與哺乳動物細胞功能的結構型熱激蛋白HSP73、參與多種脅迫響應的誘導型熱激蛋白HSP72、定位于內質網的葡萄糖結合蛋白GRP75以及定位于線粒體的GRP75等[6]。關于植物HSP70的研究起步較晚。近年來發現,HSP70主要分布于細胞質、內質網、線粒體和葉綠體中[7],不僅與植物的生長發育有關[8-12],還參與植物的非生物脅迫及病害脅迫響應[13-15]。通過對HSP70功能的相關研究,有望利用基因工程育種提高作物的抗逆性,但HSP70在植物中的分子伴侶作用機制和脅迫相關響應的機理還有待進一步的探究發現。
HSP70屬于誘導型熱激蛋白,在正常細胞內表達量較低,應激脅迫下能被高度誘導,修復錯誤折疊蛋白或降解已損傷的蛋白質以維持細胞內穩態,提高植物對逆境的耐受性[16-18]。迄今為止,對蘭科植物HSP70的研究均側重于其對冷脅迫的作用。4 ℃低溫脅迫能夠顯著誘導鐵皮石斛[19]和蝴蝶蘭[20]HSP70的表達,且能維持一段時間的高表達量;孔倩倩[21]研究發現,水楊酸處理對高溫脅迫下文心蘭生理生化作用的影響,但文心蘭HSP70對高溫脅迫和激素處理(水楊酸、茉莉酸甲酯)的響應情況尚未見有關報道。因此,本研究以文心蘭‘檸檬綠(Oncidium hybridum‘Honey Angel)為材料,克隆獲得文心蘭HSP70,利用qRT-PCR技術對不同組織部位及不同非生物脅迫處理下文心蘭HSP70進行表達分析,以期為研究文心蘭熱激蛋白功能及其在遭受逆境脅迫過程中的作用奠定基礎。
1 ?材料與方法
1.1 ?材料
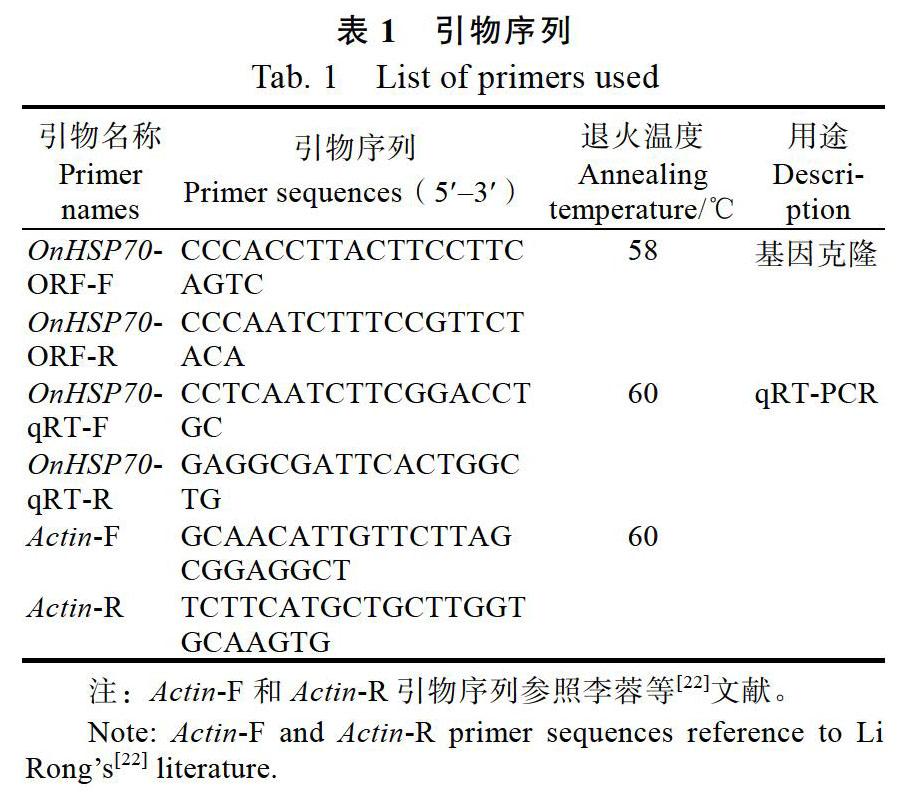
本研究以文心蘭‘檸檬綠為材料(由福建農林大學園藝植物生物工程研究所提供),進行文心蘭開花期不同組織部位和苗期不同脅迫的處理。其中,不同組織部位包括根、假鱗莖、葉片和花;溫度處理為將文心蘭置于25(正常生長溫度)、30、35、40 ℃處理24 h后進行整株取樣;高溫處理為將文心蘭置于40 ℃培養條件下,于處理后0、4、8、24 h后進行整株取樣;水楊酸處理為0.5 mmol/L的SA噴灑文心蘭葉片,于0、1、3、6、12、24、48 h進行葉片取樣;茉莉酸甲酯處理為0.2 mmol/L的MeJA噴灑文心蘭葉片,于0、1、3、6、12、24、48 h進行葉片取樣。上述處理均重復3次,取材后用液氮速凍,并放置?80 ℃冰箱中備用。上述材料處理方法參照李蓉等[22]文獻。
1.2 ?方法
1.2.1 ?文心蘭總RNA提取及其cDNA第一鏈合成 ?參照Invitrogen公司的TRIzol試劑盒說明書分別提取文心蘭的各個組織部位及不同處理的總RNA。采用Thermo超微量核酸檢測儀測定RNA濃度,再用1%瓊脂糖凝膠電泳檢測RNA的純度和濃度。采用SMARTTM RACE cDNA Amplification Kit試劑盒(TaKaRa)和PrimeScriptTM RT Reagent Kit 試劑盒(TaKaRa)逆轉錄合成cDNA,分別用于基因克隆和qRT-PCR分析。
1.2.2 ?OnHSP70基因的篩選與克隆 ?從NCBI數據庫網站獲得1條石斛HSP70的cDNA序列,登錄號為XP_020694708.1。根據此cDNA序列設計引物OnHSP70-ORF-F和OnHSP70-ORF-R(表1)。以文心蘭‘檸檬綠的cDNA為模板進行PCR反應,擴增該基因的ORF序列。以上引物均由福州尚亞生物技術有限公司合成。
PCR擴增體系共25 μL:DreamTaq? Green PCR Master Mix (2) 12.5 μL、ddH2O 9.5 μL、cDNA 1 μL、OnHSP70-ORF-F 1 μL、OnHSP70- ORF-R 1 μL。PCR擴增程序:94 ℃ 5 min,94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸1 min 20 s,循環數為35,最后72 ℃延伸5 min。參照Gel/PCR Extraction Kit試劑盒說明書將獲得的目的片段進行回收,用pMD18-T載體連接10 h后轉入T1中,進行TA克隆并挑選陽性克隆菌落搖菌,然后進行菌液PCR擴增,凝膠電泳比對后將有目的條帶的菌液送至上海鉑尚生物技術有限公司測序。
1.2.3 ?OnHSP70生物信息學分析 ?通過NCBI中CDD在線工具進行OnHSP70保守結構域預測;同源性分析使用DNAMAN 6.0軟件進行氨基酸序列的多重比對,聚類分析時采用 MEGA6.0中的NJ法(Neighbor-joining)進行HSP70基因進化樹的構建。利用ExPASy-ProtParam tool分析蛋白的基本理化性質,用TMHMM Server 分析跨膜結構域,通過 SignalP 4.1 Server預測信號肽,NetPhos預測磷酸化位點,LocTree 3預測蛋白亞細胞定位;利用 SOP-MA預測蛋白質二級結構,用SWISS-MODEL 預測蛋白三級結構[23]。
1.2.4 ?qRT-PCR分析 ?利用羅氏LightCycler 480儀器,通過qRT-PCR檢測OnHSP70基因在文心蘭不同組織部位和不同脅迫處理下的表達情況。根據已獲得序列,按照qRT-PCR引物設計原則,設計特異性引物OnHSP70-qRT-F和OnHSP70- qRT-R(表1)。采用SYBR? Premix Ex Taq? II Kit(TaKaRa)進行qRT-PCR反應,反應體系共20 μL:SYBR II酶10 μL、sdH2O 7.4 μL、cDNA 1 μL、上下游引物各0.8 μL。qRT-PCR反應條件為:95 ℃預變性30 s,95 ℃變性10 s,60 ℃退火30 s,72 ℃延伸15 s,循環數為45次。
1.3 ?數據處理
通過2-?ΔCT法計算獲得OnHSP70的相對表達量[22]。用SPSS 19.0對OnHSP70的表達量進行差異顯著性分析,再用Excel畫圖。
2 ?結果與分析
2.1 ?OnHSP70基因的克隆
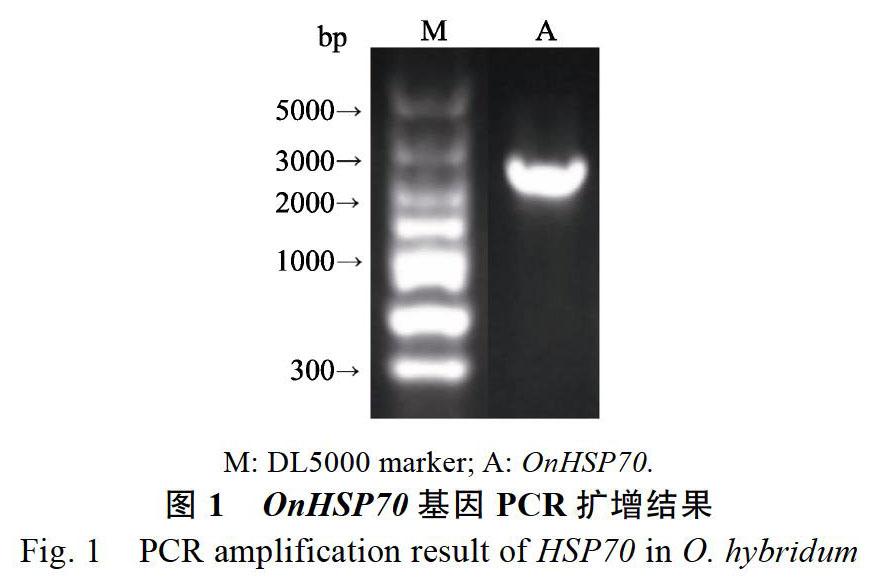
以文心蘭‘檸檬綠cDNA為模板,擴增OnHSP70基因的開放閱讀框,測序結果得到1條1994 bp片段(登錄號:MT133659;圖1),包含以ATG為起始密碼子,以TAG為終止密碼子的ORF共1944 bp,編碼647個氨基酸(圖2)。該基因編碼的氨基酸序列具有3部分HSP70家族的特征序列:IDLGTTYS、IFDLGGGTFDVSLL和VLVGGSTRIPRVQQ;指紋序列VPAYFND以及C末端典型的特征基序EEVD[24]。由克隆得到的基因所推出的氨基酸序列在NCBI上進行BLASTp分析,發現與其它植物的HSP70具有90%以上的相似性;NCBI-CDS預測該蛋白在1~647肽鏈區間具有HSP70和Dnak等結構域,屬于HSP70超家族(圖3),這些結果表明克隆得到的基因為文心蘭的HSP70基因,將其命名為OnHSP70。
2.2 ?OnHSP70聚類分析與氨基酸同源性分析
采用MEGA6.0鄰位歸并法,以文心蘭、鐵皮石斛、鳳梨、煙草和柑橘等20種植物HSP70基因編碼的氨基酸序列為基礎進行聚類分析。結果表明,單子葉植物與雙子葉植物的HSP70在進化方向上沒有顯著差別,OnHSP70在進化上與鐵皮石斛和深圳擬蘭的進化方向一致性較高,但與蝴蝶蘭的進化方向有一定差距(圖4)。將進化樹中蘭科植物(文心蘭、鐵皮石斛、深圳擬蘭和蝴蝶蘭)及模式植物(擬南芥、水稻和煙草)的氨基酸序列進行多重比對后,結果顯示其整體一致性為94.4%,且該蛋白氨基酸序列N端的保守性高于C端,C端最后100個氨基酸變化很大,但C末端均存在高度保守的基序結構EEVD(圖5)。
2.3 ?OnHSP70理化性質的生物信息學分析
OnHSP70理化性質的生物信息學分析表明:HSP70分子式為C3104H5006N856O992S25,原子數為9983個,分子量為70.99 kDa,正電氨基酸(Arg+ Lys)殘基數為82個,負電氨基酸(Asp+Glu)殘基數為102個,理論等電點PI為5.06。平均親水性系數為?0.402,脂溶性系數為83.37,不穩定系數為32.55,屬于親水性的穩定蛋白。SignalP 4.1 Server 預測OnHSP70不含信號肽,表明其不屬于分泌蛋白。LocTree 3預測該蛋白定位于細胞質中(可信度為95%);跨膜螺旋結構預測發現OnHSP70有由內向外4個和由外向內3個跨膜螺旋結構。磷酸化位點分析結果顯示:OnHSP70共有51個磷酸化位點,包括21個Ser位點,23個Thr位點和7個Tyr位點。二級結構分析顯示(圖6):OnHSP70有41.11%的α-螺旋(α-helices),17.77%的延伸鏈(extended strand),7.73%的β-轉角(β-turn)以及33.38%的無規則卷曲(random coil)。蛋白質三級結構如圖7所示。
2.4 ?不同組織器官中OnHSP70的表達分析
以Actin為內參基因,分析了OnHSP70在文心蘭不同組織器官的表達模式。qRT-PCR結果表明,OnHSP70在文心蘭的根、莖、葉和花中均有表達,其在花中的表達量最高,約為其他器官表達量的9~12倍,與其他器官的表達量有顯著差異(圖8)。
2.5 ?溫度處理下OnHSP70的表達分析
以正常培養溫度(25 ℃)的文心蘭為對照,分析高溫條件下OnHSP70的表達情況。結果如圖9所示,以常溫下OnHSP70的表達量為對照,該基因在30 ℃處理時輕微下調響應,但與對照組差異不顯著,而30 ℃到40 ℃時呈顯著上調響應,尤其是40 ℃時該基因表達量為對照的9.5倍(圖9)。40 ℃處理不同時間的文心蘭中,OnHSP70在4 h時表達量達最高值,隨后表達量不斷下降,但是一直處于上調表達狀態(圖10)。
2.6 ?茉莉酸甲酯和水楊酸處理下OnHSP70的表達分析
以未噴施激素的文心蘭葉片作為對照,分析茉莉酸甲酯及水楊酸處理不同時長后的表達情況。用0.2 mmol/L的茉莉酸甲酯處理后,OnHSP70整體呈現下調響應,且6 h的表達量出現波動,整體來看處理時間越長表達量越低(圖11)。0.5 mmol/L的水楊酸處理初期(1 h時)表達量升高,且在處理1 h時有明顯的單峰響應,其相對表達量約為對照組的1.38倍,隨后逐漸下降,隨著處理時長增加相對表達量逐漸下降(圖11)。
3 ?討論
3.1 ?OnHSP70分子特性分析
植物熱激蛋白是植株在應激狀態下產生的一類與抗逆性有關的蛋白。HSP70熱激蛋白是HSPs家族中的重要一員,在自然界所有生物體中廣泛存在并且高度保守[2]。本研究克隆獲得的OnHS?- P??70,與鐵皮石斛和深圳擬蘭的HSP70同源性較高。盡管不同物種在進化上具有顯著差異性,但是HSP70基因在植物中的進化是保守的[25],該家族成員都含有1個N端核酸結合區(nucleotide約45 kDa的核酸結合區,能夠水解ATP,C端存在約25 kDa的底物結合區可以與多肽底物暴露在外部未折疊的疏水域特異性結合,SBD和NBD通過一絞合鏈結構連接,發揮分子伴侶功能[26-28]。在HSP70亞家族中不同定位的蛋白質氨基酸C末端有特定的高度保守序列,如PECDVLDADFT?DSK、PEAEYEEAKK、EEVD和HDEL分別定位于質體、線粒體、細胞質及內質網中。本研究中文心蘭OnHSP70基因編碼蛋白的C末端具有典型的特征基序EEVD,蛋白質定位分析顯示其存在于細胞質中,與細胞質型HSP70蛋白結構特點相一致[29]。推測OnHSP70能夠在逆境脅迫時通過調節細胞的生理功能,作為分子伴侶參與蛋白質的正確裝配,以維持蛋白質的特定構象[30]。
3.2 ?OnHSP70在不同組織器官中的表達具有差異性
熱激蛋白作為看家蛋白參與植物的生長發育過程,因此在不同組織部位中均有表達,但是細胞質型HSP70在不同物種的不同組織器官中的表達量具有較大的差異性。在臘梅成熟葉中HSP70的表達量最高[24];在蝴蝶蘭根中該基因表達水平最高,花中表達水平最低[20];在紫花苜蓿研究中發現,該基因在花中表達量明顯高于其他器官[31]。本研究對OnHSP70表達分析發現,其在文心蘭不同器官中均有表達,在花中響應最顯著。此結果與紫花苜蓿的研究結果相一致,而與同為蘭科的蝴蝶蘭差異較大,原因可能是蝴蝶蘭開花需要進行低溫春化,而文心蘭則在較高溫度仍能正常開花。推測該基因在文心蘭花發育階段起重要作用,參與文心蘭花形態建成。
3.3 ?高溫能顯著誘導OnHSP70的表達
已有大量的研究表明溫度與HSP70的表達密切相關。高溫脅迫能促進小麥[32]、海帶[33]、水稻[34-35]、玉米[36]、花生[37]、豌豆[38]、煙草[39]和紫莖澤蘭[30]等HSP70的表達,說明HSP70在逆境中發揮其分子伴侶作用,通過維持植物生長發育相關蛋白的穩定構象,提高植株應對不利環境的能力。本研究表明,高溫對OnHSP70的表達存在非常明顯的誘導作用,高溫雖不利于有機體大部分蛋白質的合成,但OnHSP70為穩定蛋白,在脅迫初期該基因的應激響應顯著,能通過短時間內的大量表達以修復因高溫變性或合成受阻的蛋白質,從而保護其它蛋白質免受傷害,適應高溫環境,降低植株的損傷[40]。隨著處理時長的增加,OnHSP70后期響應呈現下降趨勢,這與HSP70在其他植物中的研究結果一致。推測原因是熱激基因長時間處于較高的表達狀態不利于植株的生長[41-42]。因此,在緩解了植物高溫脅迫造成的不良影響后,HSP70的表達量就會下降。
3.4 ?水楊酸和茉莉酸甲酯處理OnHSP70的響應情況
水楊酸和茉莉酸甲酯都能夠作為信號分子對逆境作出應答反應,誘導合成、參與和調控植物的多種生理生化過程,從而提高植物的抗逆性。已有研究結果表明,水楊酸與香蕉[43]、水稻[34]、玉米[36]、蝴蝶蘭[44]等幼苗耐熱性的形成有關;水楊酸可以通過調節植物體內脯氨酸含量緩解高溫脅迫對龍須菜產生的不利影響[45-46]。鄒清成等[47]通過對蝴蝶蘭的研究表明,茉莉酸甲酯作為生物調節劑能夠提高幼苗抗逆性;茉莉酸甲酯還可以通過調節水稻葉片胡蘿卜素含量緩解孕穗期的高溫傷害[48]。本研究OnHSP70對茉莉酸甲酯呈現明顯下調響應,在水楊酸誘導1 h時上調響應,之后表達量下降,整體呈現先上調后下調的響應特征。可能是由于水楊酸和茉莉酸甲酯在作為信號分子調節植物抗性作用途徑時相對獨立,且HSP70的抗逆作用機制與水楊酸和茉莉酸甲酯存在協同作用[49]。
綜上所述,OnHSP70由647個氨基酸構成,是穩定蛋白,屬于HSP70超家族,具有1個高度保守的結構域,且C末端存在EEVD序列,蛋白亞細胞定位于細胞質。盡管不同植物的HSP70在進化方向差異較大,但通過同源性分析顯示OnHSP70與其他植物的氨基酸序列具有極高的相似度。OnHSP70表達模式分析表明:該基因在文心蘭的不同組織部位中均有表達,且具有顯著差異性,在花中表達量最高;該基因能夠顯著響應高溫脅迫,尤其在40 ℃處理4 h時表達量達峰值;該基因對水楊酸和茉莉酸甲酯呈現出不同的響應特征,但整體呈現出下調的趨勢。上述結果說明,OnHSP70在文心蘭生長發育過程中發揮作用,且參與文心蘭對環境脅迫的適應性,為該基因功能的研究及提高文心蘭對高溫的適應性提供參考,本試驗研究結果也對后期開展文心蘭耐高溫品種的選育具有積極意義。
參考文獻
[1] 羅遠華, 王振波, 黃敏玲, 等. 高溫脅迫對文心蘭頂葉若干生理指標的影響[J]. 福建農業學報, 2017, 32(6): 625-629.
[2] 楊 ?學, 葉 ?煒, 李永清, 等. 南茜文心蘭軟腐病病原分離鑒定及致病性分析[J]. 亞熱帶植物科學, 2017, 46(3): 201-208.
[3] S Lindquist A, Craig E A. The heat-shock proteins[J]. Annual Review of Genetics, 1988, 22(3): 631-677.
[4] 王明強, 張道遠. 植物熱激蛋白70基因家族及其生物學功能研究進展[J]. 基因組學與應用生物學, 2015, 34(2): 421-428.
[5] Ritossa F. A new puffing pattern induced by temperature shock and DNP in Drosophila[J]. Experientia, 1962, 18(12): 571-573.
[6] Welch W J. Mammalian stress response: cell physiology, structure/function of stress proteins, and implications for medicine and disease[J]. Physiological Reviews, 1992, 72(4): 1063-1081.
[7] 齊 ?妍, 徐兆師, 李盼松, 等. 植物熱激蛋白70的分子作用機理及其利用研究進展[J]. 植物遺傳資源學報, 2013, 14(3): 507-511.
[8] 張毓婷, 王敏華, 陳家棟, 等. 雷蒙德氏棉HSP70基因家族的進化分析及其同源基因在陸地棉中的表達分析[J]. 遺傳, 2014, 36(09): 921-933.
[9] Guo M, Liu JH, Ma X, et al. Genome-wide analysis of the Hsp70 family genes in pepper (Capsicum annuum L.) and functional identification of CaHsp70-2 involvement in heat stress[J]. Plant Science, 2016, 252: 246-256.
[10] Huang XY, Tao P, Li BY, et al. Genome-wide identification, classification, and analysis of heat shock transcription factor family in Chinese cabbage (Brassica rapa pekinensis)[J]. Genetics & Molecular Research, 2015, 14(1): 2189-2204.
[11] Latijnhouwers M, Xu X M, Mller S G. Arabidopsis stromal 70-kDa heat shock proteins are essential for chloroplast development[J]. Planta, 2010, 232(3): 567-578.
[12] Wang Y, Lin S, Song Q, et al. Genome-wide identification of heat shock proteins (Hsps) and Hsp interactors in rice: Hsp70s as a case study[J]. BMC Genomics, 2014, 15(1): 344.
[13] Liu J X, Wang R M, Liu W Y, et al. Genome-wide characterization of heat-shock protein 70s from Chenopodium quinoa and expression analyses of Cqhsp70s in response to drought stress[J]. Genes, 2018, 9(2): 35.
[14] Yer E N, Baloglu M C, Ziplar U T, et al. Drought-responsive Hsp70 gene analysis in Populusat genome-wide level[J]. Plant Molecular Biology Reporter, 2016, 34(2): 483-500.
[15] Duan Y H, Guo J, Ding K, et al. Characterization of a wheat HSP70 gene and its expression in response to stripe rust infection and abiotic stresses[J]. Molecular Biology Reports, 2011, 38(1): 301-307.
[16] 黃小云, 陶 ?鵬, 李必元, 等. 植物熱激轉錄因子基因家族的研究進展[J]. 浙江農業科學, 2014, 1(9): 1323-1332, 1336.
[17] Velazquez J M, Lindquist S. Hsp70: nuclear concentration during environmental stress and cytoplasmic storage during recovery[J]. Cell, 1984, 36(3): 655-662.
[18] Mayer M P, Bukau B. Hsp70 chaperones: cellular functions and molecular mechanism[J]. Cellular and Molecular Life Sciences, 2005, 62(6): 670-684.
[19] 李東賓, 高燕會, 斯金平, 等. 鐵皮石斛HSP70基因的克隆及冷脅迫表達分析[J]. 中國中藥雜志, 2013, 38(20): 3446-3452.
[20] 袁秀云, 許申平, 王默霏, 等. 蝴蝶蘭熱激蛋白基因PhHsp70序列分析及對冷脅迫的響應[J]. 安徽農業大學學報, 2018, 45(3): 519-525.
[21] 孔倩倩. 高溫脅迫下文心蘭對外源水楊酸的生理響應及WRKY基因的克隆[D]. 福州: 福建農林大學, 2017, 21-22.
[22] 李 ?蓉, 吳曉佩, 王雪晶, 等. 文心蘭RFNR的克隆、亞細胞定位及其與LFNR不同的脅迫響應機制研究[J]. 園藝學報, 2018, 45(11): 2164-2176.
[23] 郭艷芳, 王叢巧, 李 ?蓉, 等. 文心蘭PAD4基因克隆及表達分析[J]. 熱帶作物學報, 2018, 39(12): 2436-2445.
[24] 阮文進, 門維婷, 馬 ?婧, 等. 蠟梅熱激蛋白基因CpHSP70-1的克隆、亞細胞定位與表達分析[J]. 西南大學學報(自然科學版), 2016, 38(1): 43-52.
[25] 陳 ?旭, 石 ?壘, 朱 ?璐, 等. 植物HSP70蛋白家族分子進化特征及其表達模式分析[J]. 基因組學與應用生物學, 2017, 36(10): 4282-4294.
[26] Wilbanks S M, Delucaflaherty C, Mckay D B. Structural basis of the 70-kilodalton heat shock cognate protein ATP hydrolytic activity. I.Kinetic analyses of active site mutants [J]. Journal of Biological Chemistry, 1994, 269(17): 12893-12898.
[27] Nelson R J. The translation machinery and 70 kD heat shock protein cooperate in protein synthesis [J]. Cell, 1992, 71(1): 97-105.
[28] Kang P J, Ostermann J, Shilling J, et al. Requirement for hsp70 in the mitochondrial matrix for translocation and folding of precursor proteins [J]. Nature, 1990, 348(6297): 137-143.
[29] 王宇萍, 蔣建東. 熱休克蛋白70的結構和功能[J]. 中國細胞生物學學報, 2010, 32(2): 305-313.
[30] 肖艷萍, 宮偉娜, 萬方浩, 等. 紫莖澤蘭熱激蛋白70基因的克隆與序列分析[J]. 中國農業科技導報, 2010, 12 (1): 111-117.
[31] 栗振義. 紫花苜蓿熱激蛋白基因MsHSP70的克隆及功能分析[D]. 北京: 中國農業科學院, 2015: 25-27.
[32] 安艷秋, 藺瑞明, 馮 ?晶, 等. 小麥熱激蛋白基因TaHSP70克隆及其在植物防衛和抗逆反應中的表達分析[J]. 分子植物育種, 2011, 9(4): 402-409.
[33] 袁艷敏, 劉福利, 梁洲瑞, 等. 海帶hsp70基因的克隆、分析及轉錄水平定量研究[J]. 漁業科學進展, 2018, 39(4): 152-158.
[34] 黃上志, 黃祥富, 林曉東, 等. 熱激對水稻幼苗耐冷性及熱激蛋白合成的誘導[J]. 植物生理與分子生物學學報, 2004, 30(2): 189-194.
[35] 王 ?群, 方榮祥. 水稻熱激蛋白70基因的序列及熱誘導表達[J]. 中國科學(B輯 化學 生命科學 地學), 1995, 25(12): 1263-1272.
[36] 李慧聰, 郭秀林, 王冬梅, 等. 玉米熱激蛋白70基因對溫度脅迫的響應[J]. 河北農業大學學報, 2010, 33 (6): 12-15, 25.
[37] 李 ?翠, 侯 ?蕾, 任 ?麗, 等. 花生熱激蛋白AhHSP70與熱激因子AhHSF基因的克隆及表達分析[J]. 山東農業科學, 2015, 47(4): 1-7.
[38] Zhang L, Zhao H K, Dong Q L, et al. Genome-wide analysis and expression profiling under heat and drought treatments of HSP70 gene family in soybean (Glycine max L.) [J]. Frontiers in Plant Science, 2015, 6: 773-795.
[39] 陳二龍, 范志勇, 王松峰, 等. 煙草Hsp70基因家族的鑒定及NtHsp70Chl基因的表達分析[J]. 中國煙草科學, 2018, 39(2): 8-15, 16.
[40] 張 ?楊, 孫 ?明, 楊海燕, 等. 菊花腦熱激蛋白70基因的克隆及表達分析[J]. 湖南農業大學學報 (自然科學版), 2014, 40(2): 153-156.
[41] 趙真真, 韓瑩琰, 李雅博, 等. 葉用萵苣熱激蛋白LsHsp70-1707基因的克隆及表達分析[J]. 中國農業大學學報, 2015, 20(5): 171-178.
[42] Krebs R A, Holbrook S H. Reduced enzyme activity following Hsp70 overexpression in Drosophila melanogaster[J]. Biochemical Genetics, 2001, 39(1-2): 73-82.
[43] 馮 ?斗, 禤維言, 黃政樹, 等. 茉莉酸甲酯對低溫脅迫下香蕉幼苗的生理效應[J]. 果樹學報, 2009, 26(3): 390-393.
[44] 楊華庚, 顏速亮, 陳慧娟, 等. 高溫脅迫下外源茉莉酸甲酯、鈣和水楊酸對蝴蝶蘭幼苗耐熱性的影響[J].中國農學通報, 2011, 27(28): 150-157.
[45] 顧穎慧. 龍須菜熱激蛋白70(HSP70)基因克隆及熱激下的表達模式分析[D]. 青島: 中國海洋大學, 2011.
[46] 朱招波, 孫 ?雪, 徐年軍, 等. 水楊酸對龍須菜抗高溫生理的影響[J]. 水產學報, 2012, 36(8): 1304-1312.
[47] 鄒清成, 朱開元, 劉慧春, 等. 外源茉莉酸甲酯對非生物脅迫下蝴蝶蘭幼苗葉綠素熒光和抗氧化指標的影響[J]. 植物生理學報, 2011, 47(9): 913-917.
[48] 劉 ?霞, 唐 ?設, 竇 ?志, 等. 茉莉酸甲酯對武運粳24和寧粳3號灌漿早期高溫脅迫生理特性的影響[J]. 中國水稻科學, 2016, 30(3): 291-303.
[49] 陸 ?雯, 潘璐琪, 王雪艷. 水楊酸及茉莉酸介導植物抗病性的研究進展[J]. 貴州農業科學, 2013, 41(10): 40-43.

