電針后血清干預對多裂肌衛星細胞增殖、Collagen I及MMP2表達的影響*
陳玉佩,李曉紅,許 玥,徐 菁,霍則軍,張 莉
(1. 北京中醫藥大學針灸推拿學院 北京 100029;2. 北京市豐臺區南苑醫院針灸按摩科 北京 100076;3. 北京中醫藥大學生命科學學院 北京 100029;4. 北京大學第三醫院中醫科 北京 100191)
腰部多裂肌是穩定腰椎的鋼索,多裂肌形態的改變和功能的紊亂是腰痛的重要誘因[1-2]。骨骼肌受損原因不盡相同,但其再生修復過程基本一致[3],是肌纖維再生和細胞外基質(Extracellular Matrix,ECM)重塑協調發揮作用的結果[4]。ECM 既可以減輕炎癥反應,又可以調控肌衛星細胞(muscle satellite cell,MSCs)的生長環境,促進骨骼肌的再生修復進程[5]。MSCs 是骨骼肌組織的干細胞,它的激活、增殖是受損骨骼肌再生修復的前提條件[6]。
ECM 是存在于細胞間的結締組織,是構成細胞物理結構、調節細胞間生物化學和生物力學信號的重要媒介,約占人體骨骼肌組織重量的10%,也是維持骨骼肌生理功能的關鍵,使骨骼肌能夠應對內、外環境的變化[7]。由此可見,ECM 對骨骼肌生理功能的維持和病理變化的改善具有重要作用[8]。針刺治療腰痛療效顯著,但其機制尚不十分明確。本課題組前期圍繞電針“委中”穴促進損傷多裂肌再生修復的機制做了大量動物實驗,發現電針“委中”干預后血清中磷酸肌酸激酶和白介素17 發生明顯變化[9-10]。因此,本研究以離體培養的腰多裂肌MSCs 為研究對象、以電針“委中”穴后的血清為干預手段,觀察MSCs 的增殖情況和ECM組成成分—Collagen I、MMP2蛋白表達的變化,揭示電針治療腰多裂肌損傷的部分作用機制。
1 材料與方法
1.1 動物及分組
準備25 只SPF 級雄性SD 大鼠,體重120 ± 10g ,購自北京維通利華實驗動物技術有限公司。許可證編號:SCXK(京)2016-0001)。于北京中醫藥大學屏障式實驗動物房適應性飼養7 d,室溫24℃,相對濕度為40%-50%。實驗過程中對動物的處置符合科技部發布的《關于善待實驗動物的指導性意見》。
采用隨機數字表法將其中24只大鼠分為正常組、模型組、電針組,每組8 只。(注:研究發現生理鹽水注射的對照組與正常組之間無統計學差異[10-11],故本研究未設模型對照組。)
1.2 主要試劑及儀器
實驗的主要試劑及儀器為:布比卡因鹽酸鹽(BPVC(B5274-1G),SIGMA);胎牛血清(FBS,杭州四季青公司);DMEM 高糖培養基(Hyclone);兔來源Collagen I 多克隆抗體(ab34710);兔來源MMP2 多克隆抗體(10375-2-AP);鼠單克隆抗體MyoD(ab16148);兔來源Pax7 多克隆抗體(AF7584);鼠多抗GAPDH 抗體、HRP山羊抗兔/鼠二抗、BCA蛋白定量檢測試劑盒、DAPI 染色液(北京索萊寶科技有限公司);Bio-Rad?蛋白質電泳及轉膜系統(BIO-RAD 公司);華佗牌針灸針(0.30 mm×13mm,蘇州醫療用品廠)。
1.3 方法
1.3.1 造模方法
采用單次肌肉注射0.5%的布比卡因建立大鼠腰多裂肌損傷模型。具體制備方法參照已發表文章[12]。如圖1所示。
1.3.2 處理方法
各組的具體處理方法如下:
正常組:與模型組同步抓取、固定、取材,但不造模、予電針治療。
模型組:與電針組同步抓取、固定、取材,但不予電針治療。
電針組:造模后24 h,以《實驗針灸學》[13]實驗動物穴位圖譜為依據,取雙側“委中”穴(膝關節背面正中)進行電針治療,造模后第4 d 取材。電針方法:將大鼠置于固定器上,暴露雙后肢。華佗牌針灸針(0.30 ×13 mm)直刺進針約0.5~1 cm,連接韓式電針儀(HANS-200 A),2/100 Hz 疏密波,1-2 mA 電流強度,20 min/次,1次/d,共3次。
1.3.3 制備針刺血清
造模后的第4 d,10%水合氯醛腹腔注射(350 mg/kg)麻醉,腹主動脈取血5 ml,室溫靜置2 h,3500 r/min離心10 min,取上清,56℃滅活30 min,無菌條件下經0.22 μm微孔濾膜過濾,-20℃保存備用。
1.3.4 原代MSCs的分離、培養、純化
結合Ⅰ型膠原酶消化法和差速貼壁法獲取大鼠腰4-5 節段多裂肌MSCs。具體多裂肌MSCs 分離、培養、純化方法參照已發表文章[14]。
1.3.5 MSCs的鑒定
取第4 代MSCs,以2×104個/孔細胞數接種于6 孔板,待細胞貼壁后,培養24 h 檢測Pax7 的表達,培養72 h檢測MyoD的表達。細胞經PBS清洗3次×5 min,4%多聚甲醛固定30 min,PBS 清洗3 次× 5 min;0.5%Triton X-100 破膜10min,PBS 清洗3 次× 5 min;5%山羊血清封閉1 h,PBS 清洗3 次× 5 min;加1∶100 稀釋的一抗,4℃過夜;吸出一抗,PBS 清洗3 次×5 min,加入1∶100 稀釋的FITC 標記的山羊抗兔/小鼠IgG,37℃避光孵育1 h,PBS 清洗3 次×5 min;加入1∶1000 稀釋的DAPI 染核5 min;PBS 清洗1 次,熒光顯微鏡下觀察染色情況并拍照。細胞鑒定過程重復3次。
1.3.6 指標檢測
CCK-8(Cell Counting kit-8)檢 測 各 組 血 清 對MSCs 增殖的影響:將細胞稀釋成2×105個/mL,以2×104個/孔細胞懸液接種到96 孔板中。隨機分為空白組、正常血清組、模型血清組、電針血清組,每組重復6孔。培養24 h后,空白組加入DMEM培養基,25 μl/孔;其余各組分別加入對應的正常血清、模型血清、電針血清,25 μl/孔。培養24 h后,加入CCK-8溶液,10 μl/孔。培養1 h 后,酶標儀(450 nm 波長)測定各孔平均吸光度(OD)值。CCK-8實驗重復3次。
WB 檢測Collagen I、MMP2 蛋白表達:①將細胞稀釋成2×105個/mL,以1×106/皿接種細胞,隨機分為正常血清組、模型血清組、電針血清組,培養24 h;②棄培養基,加入無血清DMEM 培養基同步化處理24 h;③棄培養基,每皿對應加入含相應血清的培養基,培養24 h;④提取總蛋白并測定蛋白濃度,蛋白變性后,以50 μg/孔蛋白上樣。
WB 操作步驟同已發表文章所述[15]。以GAPDH作為內參對照,計算每個樣本的Collagen I、MMP2 與GAPDH的光密度比值(IDV)。
1.3.7 統計學方法
應用SPSS 20.0統計軟件進行分析。數據以均數±標準差(x±s)表示。服從正態分布,方差齊,組間采用單因素方差分析(one-Way ANONA),兩兩比較用LSD-t 檢驗,不服從正態分布用非參數檢驗。P<0.05為差異有統計學意義,P<0.01為有顯著性差異。
2 結果與分析
表1 各組血清對MSCs增殖的影響(±s)

表1 各組血清對MSCs增殖的影響(±s)
分組空白組正常血清組模型血清組電針血清組N 6666 OD值0.258±0.0031.659±0.113*1.821±0.074*※2.303±0.201*※※▲
2.1 MSCs形態特征及免疫熒光染色鑒定
由圖2 可知,分離培養2d 的細胞呈折光性較強的球形,但貼壁數量少;隨著時間培養時間的推移,貼壁細胞的數量明顯增多,由圓形轉變為梭型或紡錘形。由圖3 免疫熒光染色結果可知,Pax7、MyoD 在細胞增殖過程中呈胞核表達陽性。具體見圖2、圖3。

圖3 MSCs不同時期Pax7、MyoD免疫熒光染色觀察
2.2 CCK-8檢測各組血清對MSCs增殖的影響
與空白組比較,正常血清組模型血清組、電針血清組OD 值明顯增加(P<0.01、P<0.01、P<0.01);與正常血清組比較,模型血清組、電針血清組OD 值升高(P<0.05、P<0.01);與模型血清組比較,電針血清組OD值升高(P<0.01)。見表1、圖4。
2.3 電針血清對Collagen I、MMP2蛋白的表達的影響
與正常血清組比較,模型血清組Collagen I、MMP2蛋白表達升高(P<0.01、P<0.05),電針血清組Collagen I、MMP2 蛋白表達升高(P<0.01、P<0.01);與模型血清組比較,電針血清組Collagen I蛋白表達降低(P<0.01)、MMP2 蛋白表達升高(P<0.01)。見表2、圖5、附圖1。
3 討論
針刺作為腰痛行之有效的治療方法,在世界范圍內被廣泛應用和認可[16-17],這可能與針刺改善局部微循環,提高自由基活性,調節相關細胞因子分泌有關。多裂肌與腰痛發生、發展和復發密切相關,但卻很少受關注。本課題組前期研究發現,針刺可顯著改善腰多裂肌損傷大鼠IGF1R、ERK、PI3K/Akt/mTOR 等多種細胞因子和信號通路的表達[18-20]。由于難以克服在體實驗多因素的影響,其具體機制尚不十分明確,因此本實驗采用電針血清作為干預手段,觀察大鼠腰多裂肌MSCs增殖情況及ECM中Collagen I、MMP2表達量的變化,從血清學角度探究針刺治療腰痛的部分作用機制。
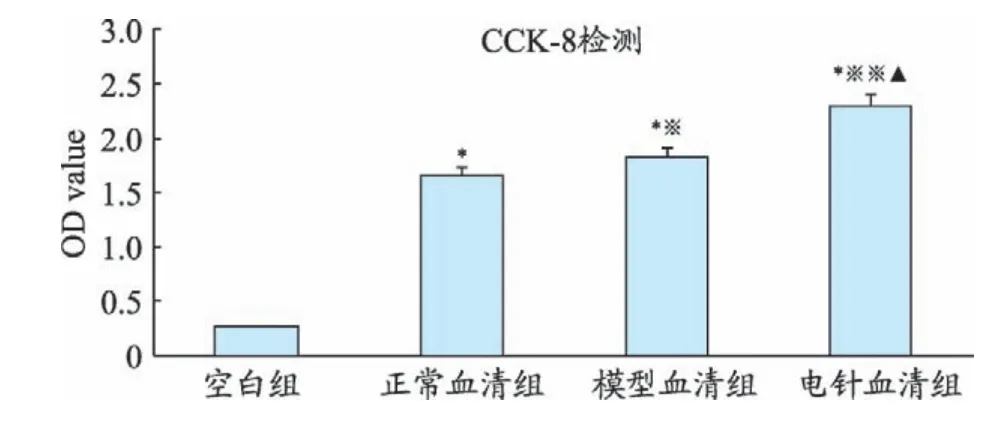
圖4 CCK-8檢測各組血清對MSCs增殖的影響
表2 各組血清對MSCs中Collagen I、MMP2蛋白表達的影響(±s)(單位:光密度比值)

表2 各組血清對MSCs中Collagen I、MMP2蛋白表達的影響(±s)(單位:光密度比值)
分組正常血清組模型血清組電針血清組Collagen I 0.223±0.0220.356±0.023**0.261±0.007**※MMP20.566±0.0370.613±0.014*0.738±0.043**※

圖5 WB檢測各組MSCs中Collagen I、MMP2蛋白表達水平

附圖1 各組Collagen I、MMP2蛋白表達條帶圖
MSCs 和鄰近其他細胞共同參與完成骨骼肌損傷后的再生修復[21-22],其中ECM 為MSCs提供結構支架和信號傳遞,通過信號傳導系統直接影響MSCs 的激活、增殖、分化,調控骨骼肌重塑功能的正常發揮。由此可見,ECM 可能對損傷多裂肌的再生修復發揮重要作用。目前,針刺治療骨骼肌損傷的研究集中于觀察MSCs的自身變化,而忽視了ECM 對MSCs影響的重要性。因此,本研究著重從血清學角度觀察電針后,血清干預對多裂肌MSCs增殖及ECM相關成分的影響。
ECM 是由Collagen、層粘連蛋白和蛋白聚糖等大分子物質組成的動態網狀結構,表現為ECM 的沉積、重構和降解等[23-24]。其中Collagen I的沉積是導致骨骼肌纖維化的主要原因[25],也是形成膠原纖維并發揮作用的前提條件[26]。有研究發現,針刺可能通過抑制Collagen I 的含量減輕纖維化程度[27]。通過透射電鏡發現,針刺可以減輕損傷骨骼肌中膠原纖維的沉積和增生程度[28-29]。本研究發現由于電針后血清的干預,ECM 中Collagen I 含量下降;CCK-8 結果表明MSCs 增殖能力提高,表明針刺可能通過抑制Collagen I的表達促進MSCs的增殖。
MMPs(Matrix Metalloproteinases,MMPs)可以降解ECM 中膠原的沉積,與骨骼肌再生、肌纖維增殖和ECM 重建關系密切[30-31]。骨骼肌再生修復過程中MMP2 含量增加[32-33]。MMP2 含量的增加、Collagen I 的減少可能是肝纖維化程度減輕的原因[34-35]。本研究發現,電針后血清干預使MMP2 含量增加,Collagen I 表達下降,這可能是腰多裂肌MSCs 增殖的原因。由此可知,電針“委中”穴可能通過調節ECM 中與骨骼肌纖維化有關的Collagen I、MMP2 的蛋白表達,加快MSCs的增殖速度,促進損傷多裂肌的再生修復,但電針“委中”穴是通過血清中的哪些成份發揮對多裂肌再生修復的良性調節作用,仍需進一步的深入研究,這可能是揭示電針促進骨骼肌再生修復機制的關鍵所在。

