η-Al2O3與-Al2O3在CS2催化水解反應中的性能比較
馮 昊,李金金,常宏崗,肖植煌,劉思琴,李 平*
(1.華東理工大學化學工程聯合國家重點實驗室,上海 200237; 2.中國石油天然氣股份有限公司西南油氣田公司天然氣研究院,四川 成都 610213;3.國家能源高含硫氣藏開采研發中心,四川 成都 610051)
二硫化碳(CS2)普遍存在于水煤氣、焦爐氣、煉廠氣以及天然氣等化學工業生產過程中[1-2]。CS2的存在不但會導致下游金屬催化劑失活[3-5],其排放還會造成環境污染,危害人類健康。工業上脫除CS2最有效的方法是催化水解[3-9]。CS2水解催化劑主要有TiO2、Al2O3、ZnO和ZrO2等氧化物[6-9],以及活性炭負載型催化劑等[10]。Aboulaytd A等[9]研究發現,四種氧化物催化劑活性依次為ZrO2>Al2O3>TiO2>ZnO。常規Al2O3廉價易得、比表面積高,同時具有較好的催化活性,因此在工業CS2水解過程中得到廣泛應用[3-9,11]。
本文旨在對比η-Al2O3和γ-Al2O3在CS2催化水解反應中的性能差異,通過分析兩者的形貌、比表面積以及表面酸堿性等特質,揭示影響不同Al2O3材料對CS2水解催化作用的關鍵因素。
1 實驗部分
1.1 催化劑制備
η-Al2O3前驅體湃鋁石的制備:取一定量的 Al2(SO4)3·18H2O配制成不同濃度的溶液,以5.0 mL·min-1速率向Al2(SO4)3溶液中滴加氨水,至溶液終點pH值為一定值時停止,滴加過程中持續攪拌并控制溫度為30 ℃,沉淀產物在原溶液中老化一定時間,隨后離心分離沉淀并用去離子水多次洗滌,再于110 ℃下干燥12 h,冷卻取出后研磨得到湃鋁石,標記為B-x-y-z,其中B表示湃鋁石,x表示終點pH值,y表示鋁離子濃度,z表示老化時間。
γ-Al2O3前驅體勃姆石的制備:取一定量的 Al2(SO4)3·18H2O和NaAlO2分別配成57 g·L-1Al2(SO4)3溶液和64 g·L-1NaAlO2溶液,各自以1.0 mL·min-1和1.2 mL·min-1速率同時滴加到燒杯中形成沉淀,過程溫度為65 ℃、pH=8.0,沉淀產物于原溶液中老化1 h后過濾,用去離子水及乙醇交替洗滌,濾餅于200 ℃下干燥12 h后得到勃姆石。
η-Al2O3和γ-Al2O3的制備:分別將得到的湃鋁石和勃姆石以1 ℃·min-1速率從室溫升至500 ℃,焙燒6 h后自然降至室溫即得。
1.2 樣品表征
采用Rigaku D/max2550VB/PC型X射線衍射儀分析樣品的晶體結構,CuKα,λ=0.154 32 nm,工作電壓40 kV,工作電流100 mA,掃描范圍2θ=10° ~ 80°(部分樣品至90°),掃描速率2°·min-1,再將樣品的衍射結果與JCPDS標準卡片對比。
采用美國Micromeritics 公司ASAP2020型全自動物理吸附儀對樣品比表面積、孔徑分布進行分析。樣品經200 ℃脫氣8 h,于-196 ℃液氮環境下進行N2的等溫吸附和脫附測試,采用BET方程計算比表面積,用BJH方法計算孔徑分布。
采用美國FEI公司Nova NanoSEM 450型場發射掃描電子顯微鏡分析樣品形貌,電鏡分辨率為1.8 nm@3kV。
采用自制吸附儀對樣品進行NH3-TPD和CO2-TPD測試,分析其表面酸、堿位特性。樣品經Ar氣吹掃后在室溫下吸附NH3或CO2,隨后以10 ℃·min-1的速率升溫至800 ℃,同時用熱導檢測器(TCD)檢測記錄脫附NH3或CO2的濃度信號,得到脫附曲線。
1.3 CS2水解反應
CS2水解反應在連續式固定床反應器上進行,反應壓力為大氣壓,反應溫度(200~450) ℃。CS2和H2O采用在一定溫度下鼓泡的方式,由N2攜帶進入反應器床層,兩種原料氣的濃度由鼓泡器溫度和N2流量調變,氣時空速為(9 000~18 000) h-1。產物組成由氣相色譜儀在線取樣檢測,采用PQ填充柱和TCD檢測器,H2為載氣,流量為 30 mL·min-1,分析時柱箱溫度由90 ℃程序升溫至200 ℃。樣品氣體出峰順序為:N2(0.47 min)、CO2(0.85 min)、H2O(1.90 min)、H2S(1.98 min)、COS(3.05 min)和CS2(9.35 min)。
CS2轉化率以反應器進出口氣體中CS2的濃度差為依據進行計算,并與出口氣體中的CO2、H2S及COS等成分進行物料衡算,確認實驗中的CS2轉化系由催化反應引起,非吸附所致。
2 結果與討論
2.1 湃鋁石制備因素考察
湃鋁石是制備高純度η-Al2O3的重要前驅體,而湃鋁石本身通常需要自行制備。本實驗以硫酸鋁與氨水為原料制備了湃鋁石,并對其沉淀過程中的溶液終點pH值、鋁離子濃度及沉淀老化時間等關鍵因素進行考察,圖1(a) 、(b) 和(c)分別為不同終點pH值、鋁離子濃度以及老化時間得到的湃鋁石樣品XRD圖。
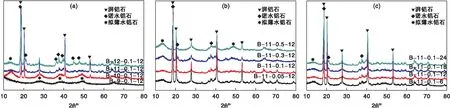
圖1 不同制備條件下湃鋁石樣品的XRD圖Figure 1 XRD patterns of bayerite samples using different preparation conditions
通過圖1(a)可以看出,終點pH值為9.0時得到的產品晶相組成主要為擬薄水鋁石(PDF#21-1307),提高終點pH至10.0時產品中出現了湃鋁石成分(PDF#20-0011),同時仍含有一定量的擬薄水鋁石,當終點pH值升高至11.0時產品中幾乎不含有擬薄水鋁石,再繼續升高則會出現一定量的諾水鋁石相(PDF#72-0623),因此在終點pH值為11.0條件下得到的湃鋁石樣品純度最高。由圖1(b)中14.0、38.2等處分別歸屬于擬薄水鋁石和諾水鋁石晶相的特征峰可以看出,鋁離子濃度對湃鋁石樣品純度的影響主要體現在這兩種雜質的含量上,其中B-11-0.1-12樣品在這幾處出峰最不明顯,說明雜質含量最少,因此湃鋁石的純度最高。從圖1(c)則可以看出老化時間對湃鋁石樣品純度的影響,與鋁離子濃度對其影響類似,老化時間為12 h得到的樣品B-11-0.1-12中擬薄水鋁石和諾水鋁石的含量都最少,而減少或延長老化時間會使擬薄水鋁石或諾水鋁石的含量增多,因此有一個最佳的老化時間。根據以上分析,選用B-11-0.1-12樣品用于η-Al2O3的制備。
2.2 η-Al2O3和γ-Al2O3的表征
圖2分別為η-Al2O3、γ-Al2O3及其前驅體樣品的XRD圖。由圖2可見,η-Al2O3與γ-Al2O3在XRD圖上差別不明顯。從兩者JCPDS卡片上標準數據可知,編號分別為#04-0875的η-Al2O3與#10-0425的γ-Al2O3兩者在19.3、31.9、37.4、39.7、46.0、60.9、66.7和85.0這八處的特征峰位置幾乎全部重疊,僅在79.1°處存在微弱差異,前者在此位置有一小峰而后者沒有。也有研究者指出,η-Al2O3在46.0附近的衍射峰是單峰,而γ-Al2O3為雙峰;此外,在19.3處,η-Al2O3的衍射峰較尖銳,而γ-Al2O3的峰較彌散[19]。圖2中η-Al2O3與γ-Al2O3兩者衍射峰的差異都吻合所述特征,說明制備的兩種氧化鋁樣品具有不同的晶相。
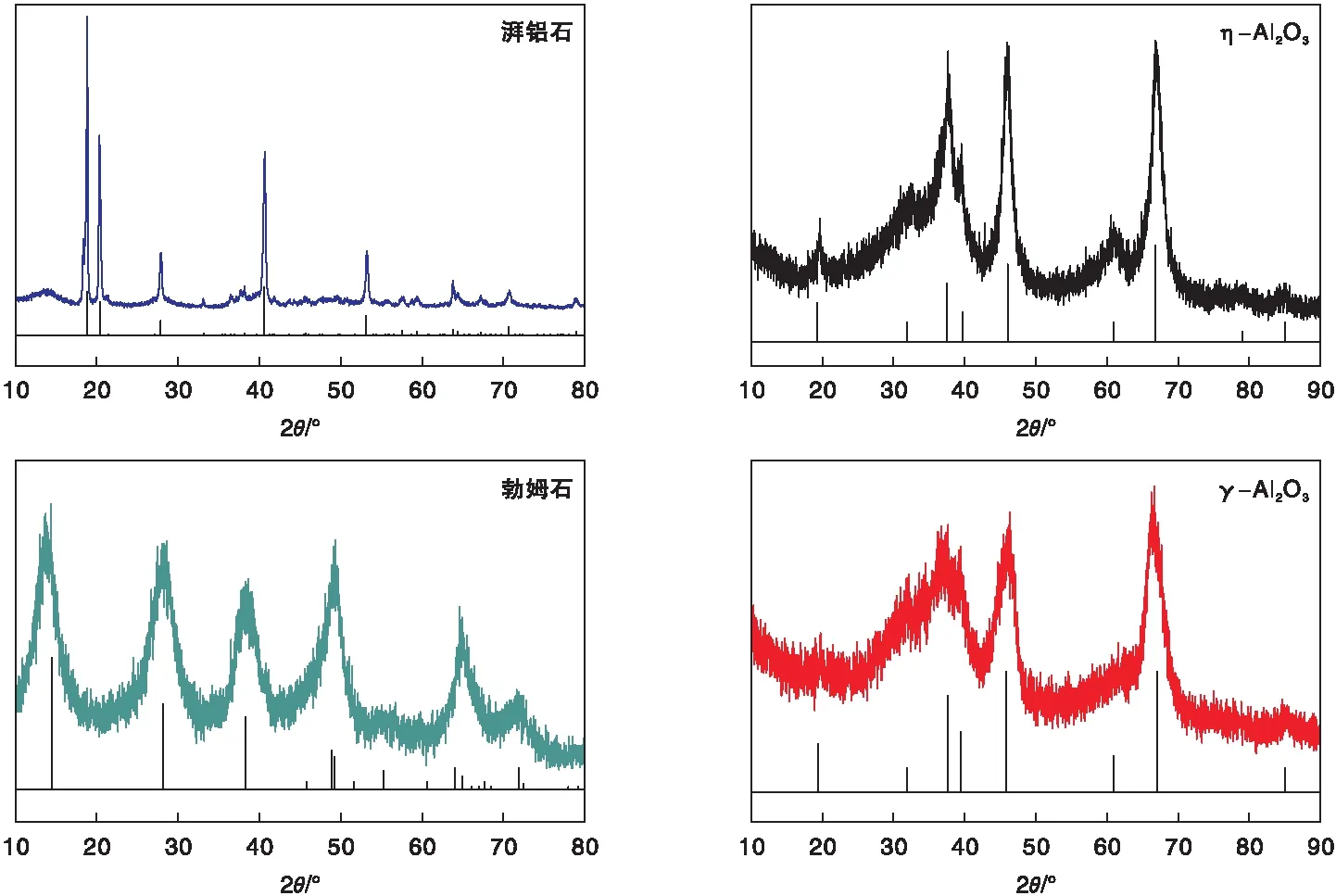
圖2 η-Al2O3、γ-Al2O3及其前驅體樣品的XRD圖Figure 2 XRD patterns of η-Al2O3,γ-Al2O3 and their precursors
圖3為η-Al2O3和γ-Al2O3樣品的N2物理吸附-脫附等溫曲線,其比表面積、孔容和平均孔經數據見表1。從圖3可以看出,η-Al2O3呈現H3型滯后環形狀,表明存在狹縫孔結構,而γ-Al2O3的滯后環為H2型,說明具有“墨水瓶”形孔結構,因此兩者的織構也大不相同。從表1可以看出,η-Al2O3和γ-Al2O3的比表面積較為接近,但γ-Al2O3的孔容是η-Al2O3的兩倍,其平均孔徑也略大于后者。
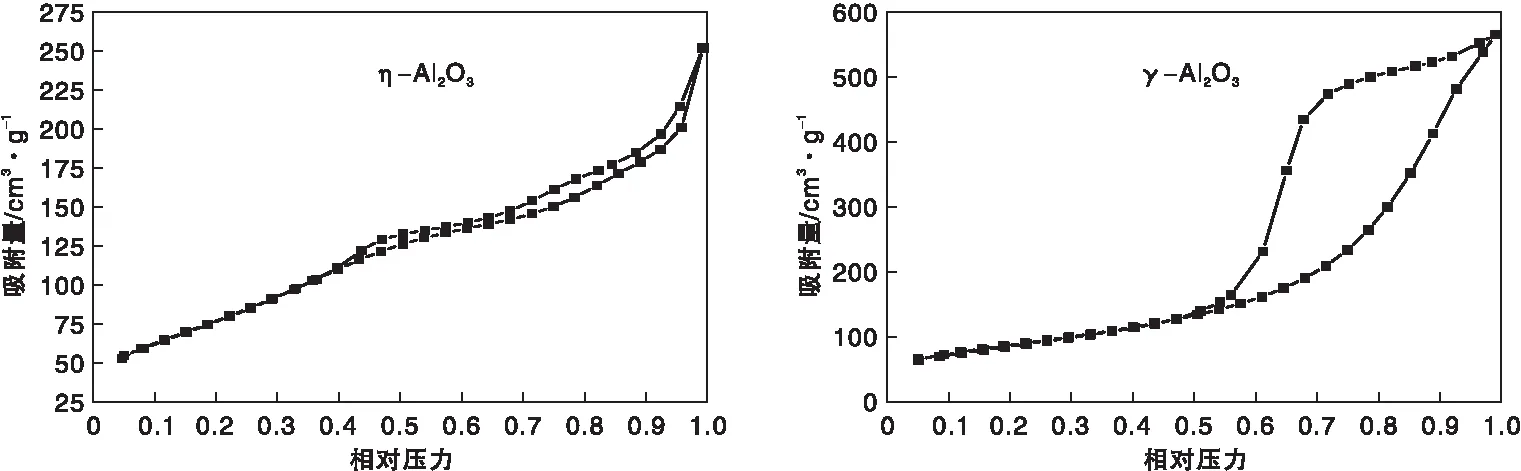
圖3 η-Al2O3和 γ-Al2O3樣品的N2物理吸附-脫附等溫曲線Figure 3 N2 adsorption-desorption isotherms of η-Al2O3 and γ-Al2O3 samples

表1 η-Al2O3和γ-Al2O3的比表面積、孔容以及平均孔徑
圖4為η-Al2O3和γ-Al2O3樣品的掃描電鏡照片。從圖4可以看到,η-Al2O3表面呈現不規則的小顆粒堆積狀,而γ-Al2O3表面則具有疏松多孔網絡結構,兩者在表面形貌上差異顯著。

圖4 η-Al2O3和γ-Al2O3樣品的掃描電鏡照片Figure 4 SEM images of η-Al2O3 and γ-Al2O3 samples
圖5為η-Al2O3和γ-Al2O3樣品的NH3-TPD曲線。由圖5可見,在低溫(100~200) ℃范圍內,-Al2O3和γ-Al2O3都有較大的NH3脫附峰,表明兩種樣品都存在大量的弱酸位。同時,-Al2O3樣品在(300~400) ℃之間有一峰形寬大的脫附峰,而γ-Al2O3樣品在相同溫度區間的脫附峰較弱,反映出-Al2O3表面上的中等強度酸性位尤為豐富。此外在(600~700) ℃區域,-Al2O3和γ-Al2O3還具有較明顯的脫附峰,說明兩者都還存在強酸位,且數量相當。
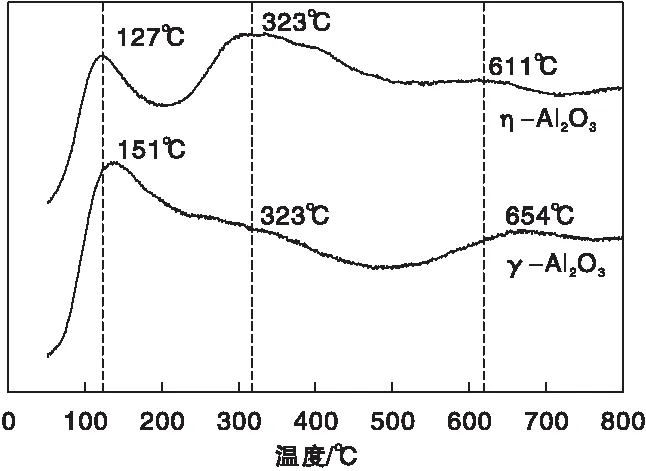
圖5 η-Al2O3和γ-Al2O3樣品的NH3-TPD曲線Figure 5 NH3-TPD curves of η-Al2O3 and γ-Al2O3 samples
圖6為η-Al2O3和γ-Al2O3樣品的CO2-TPD曲線。從圖6可以看出,-Al2O3和γ-Al2O3的堿強度分布比較相似,兩者在低溫(50~100) ℃與高溫(600~700) ℃兩處均有CO2脫附峰,前處表示弱堿位,后處為強堿位,因低溫處的峰面積都大于高溫處,因此在數量上兩者的弱堿位要多于強堿位,其中-Al2O3上不同堿強度的數量對比更為顯著,其強堿位的數量更少。同時,與γ-Al2O3相比,-Al2O3上低溫CO2脫附峰的峰頂溫度偏向更低溫,表明其弱堿位的堿性也更弱。
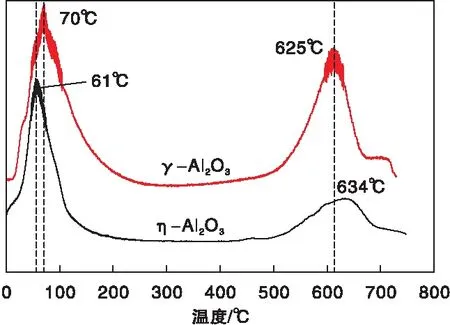
圖6 η-Al2O3和γ-Al2O3樣品的CO2-TPD曲線Figure 6 CO2-TPD curves of η-Al2O3 and γ-Al2O3samples
2.3 η-Al2O3和γ-Al2O3上CS2水解反應性能
在反應氣體體積組成為φ(CS2)=0.55%,φ(H2O)=13.26%,φ(N2)=86.19%時,空速分別為9 000 h-1與18 000 h-1條件下,η-Al2O3和γ-Al2O3催化劑上CS2轉化率隨床層溫度的變化曲線如圖7所示。從圖7可以看出,在相同空速下,CS2轉化率均隨反應溫度的升高呈現出上升趨勢,而相同溫度下,η-Al2O3上的CS2轉化率始終高于γ-Al2O3。在空速9 000 h-1下,330 ℃時η-Al2O3上的CS2轉化率就超過了97%,而在γ-Al2O3上需溫度達415 ℃時轉化率才超過97%;當空速為18 000 h-1及床層溫度為415 ℃時,η-Al2O3上的CS2轉化率可達92.0%,γ-Al2O3上則為83.8%,充分說明了η-Al2O3具有比γ-Al2O3更優異的催化CS2轉化性能。
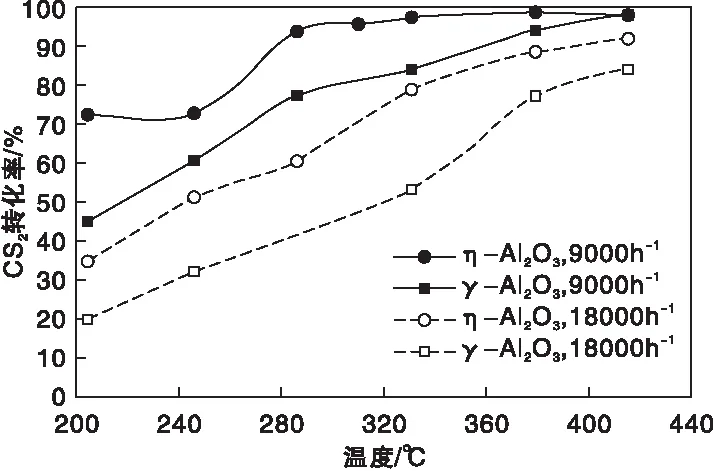
圖7 η-Al2O3和γ-Al2O3催化劑上不同空速下CS2轉化率隨床層溫度的變化曲線Figure 7 CS2 conversion versus bed temperature over η-Al2O3 and γ-Al2O3 catalysts under different GHSV
圖8為η-Al2O3和γ-Al2O3催化劑上CS2水解轉化率隨其體積分數的變化曲線,測試時H2O的體積分數保持為13.26%,N2為平衡氣,反應床層溫度為310 ℃,空速為9 000 h-1。
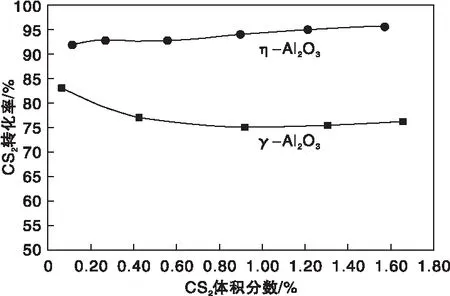
圖8 η-Al2O3和γ-Al2O3催化劑上CS2水解轉化率隨其體積分數的變化曲線Figure 8 CS2 conversion versus CS2 volume fraction over η-Al2O3 and γ-Al2O3 catalysts
由圖8可知,隨著CS2體積分數的增加,η-Al2O3上CS2轉化率有所上升,而在γ-Al2O3上則呈現下降趨勢,特別當CS2體積分數較低時下降較為明顯。后者的表現行為與文獻[11]報道的規律一致,反映出η-Al2O3催化劑對CS2水解的作用機制與γ-Al2O3不盡相同。
2.4 構效關系探討
關于CS2水解的催化作用機制,文獻中已有諸多討論,但至今并未形成統一的認識[3-4]。一般認為,CS2水解是堿催化的反應,在Al2O3上堿性的-OH位是催化活性中心,因此,添加堿金屬和堿土金屬能增加Al2O3上堿性位的數量,從而提高對CS2的水解活性。如王曉鵬[20]研究發現,采用浸漬方法在Al2O3上負載K2O后,在300 ℃時催化CS2水解的活性明顯增強,進一步對K2O負載前后的Al2O3進行CO2-TPD測試,發現未負載的Al2O3上存在兩個脫附峰,分別位于(50~150) ℃與(200~400) ℃,高溫脫附峰面積是低溫峰的近6倍,負載K2O后低溫脫附峰的面積增加了近5倍,而高溫脫附峰變化不大,由此認為低溫脫附峰所代表的弱堿中心在催化水解中發揮著重要作用,而堿強度并非越高越好。但也有研究者發現,添加較多的Na2O可使Al2O3催化劑上的CS2水解轉化率降低[21]。此外,催化劑的孔隙結構與比表面積對水解活性也有影響,所以當比較具有不同織構的催化劑時,往往難以將活性變化歸結于單一因素[3-4]。
結合本實驗η-Al2O3與γ-Al2O3的結構表征結果與兩者催化CS2水解的活性變化規律來看,雖然η-Al2O3的孔容與孔徑均小于γ-Al2O3,但由于CS2水解涉及的各種反應物、中間體及產物的分子尺寸都不大,且反應溫度較高,因此產生與孔徑及孔容有關的擴散阻礙問題的可能性較小[22],同時由于η-Al2O3與γ-Al2O3的比表面積相當,所以主導兩者活性差異的因素唯有表面酸堿位的數量及強度。與η-Al2O3相比,γ-Al2O3雖然弱堿位數量與之接近,但強堿位數量則多出數倍,同時總酸性位較少。正如文獻指出,催化劑表面上的強堿位會對水解產物CO2和H2S產生強吸附[20],由此阻礙水解反應的進行,這可能是γ-Al2O3的水解活性低于η-Al2O3的原因之一。值得一提的是,本實驗表示兩種氧化鋁弱堿位的CO2低溫脫附峰位于(50~100) ℃范圍內,其實被認為是物理吸附所致[23],而CS2水解反應的溫度區域選取為(200~450) ℃,顯然兩者的溫度區間并不匹配,低溫吸附位可能難以成為較高溫下反應時的有效活性中心。
另一方面,如圖8所示,在相同溫度及水量下,CS2在η-Al2O3與γ-Al2O3催化劑上反應時的濃度效應明顯不同,前者表現為一級或以上響應,而后者低于一級。據文獻[3-4]報道,Al2O3催化劑上CS2水解一般符合一級反應動力學規律,遵循Eley-Rideal機理,即氣相或弱吸附的CS2與已吸附的水分子之間發生反應。結合本文實驗結果推測,在反應溫度下,由于η-Al2O3上較多酸中心以及較少堿中心的存在,CS2在絕大多數部位上的吸附可能都比較弱,所以反應極可能遵照Eley-Rideal機制;而在γ-Al2O3上,由于大量強堿中心的存在導致CS2極易被強吸附,從而在表面上快速形成飽和吸附層,使得反應降低對CS2濃度的依賴性,表現為隨著CS2濃度增加,反應轉化率下降,并且CS2與產物的強吸附還導致γ-Al2O3的催化活化能力受限,這可能是γ-Al2O3活性遜色于η-Al2O3的重要原因。
3 結 論
通過優化制備高純度的前驅體湃鋁石,獲得了理想的η-Al2O3材料,比較了與γ-Al2O3在表面形貌、織構及酸堿性能方面的差異,結果顯示,η-Al2O3具有較小的平均孔徑與孔容,但比表面積與γ-Al2O3相當,同時具有更弱的弱堿位與較少的強堿位,以及豐富的中等強度酸性位。
將η-Al2O3與γ-Al2O3作為催化劑應用于CS2中溫水解反應過程,結果表明,相同溫度下,η-Al2O3上的CS2轉化率始終較高,改變空速對此規律沒有影響,說明η-Al2O3是一種比γ-Al2O3更佳的CS2水解催化劑。并且,兩種催化劑上CS2反應的濃度效應明顯不同,η-Al2O3上表現為一級或以上響應,而γ-Al2O3上反應低于一級。推測兩種催化劑因酸堿性質存在差異,影響了對CS2的吸附能力,從而導致水解反應遵循不同的機制。

