食管癌術后再發胸胃癌的外科治療
江萬里 曾文慧 王新 宋恒雅 楊森 黃杰 謝頌平
食管癌切除術后,胃常被提入胸腔進行消化道重建。隨著治療技術的不斷改進及療效的不斷提高,早期食管癌病人生存期較前延長。食管癌病人術后再次患有胸胃癌(thoracic gastric cancer,TGC)病例的報道逐年增加。胸胃癌病人的治療對于胸外科醫生是一個挑戰:之前存在食管切除前行新輔助放化療或食管切除術后縱隔區域的放療,導致其治療方案受限[1]。初次手術改變了局部解剖結構,能否根治性切除并成功重建消化道成為影響此類病人的重要因素。我們對7例食管癌術后再發胸胃癌病人的臨床資料進行總結。
對象與方法
一、對象
2013年6月~2018年12月我院會診或收治食管癌術后再發胸胃癌病人7例。所有病人術前均行肺功能、動脈血氣分析、心電圖、心臟彩超等檢查評估心肺功能;胸、腹部平掃+增強CT評估病灶大小、外侵范圍;PET-CT檢查排除遠處轉移。完善相關檢查后進行由胸外科、腫瘤科、放療科等組成的多學科討論,制定治療方案。7例病人的臨床資料見表1。
二、方法
7例病人的治療方法及術中情況見表2。
結 果
全組手術切緣均為陰性,R0切除率均為100%,無死亡和切口相關并發癥發生。所有病人術后常規給予抗生素預防感染,并給予祛痰、抑酸劑等對癥處理。根據肺部復張和引流情況拔除胸管。術后第8天開始進水。術后并發肺部感染2例,心律失常1例;頸部吻合口瘺1例,經切開換藥治療后好轉。
7例病人術后1年隨訪飲食正常,體重較術前無下降;行胸部加上腹部CT平掃加增強、頭顱MRI和ECT骨掃描等檢查,未見復發和轉移征象。

表1 7例病人的臨床資料
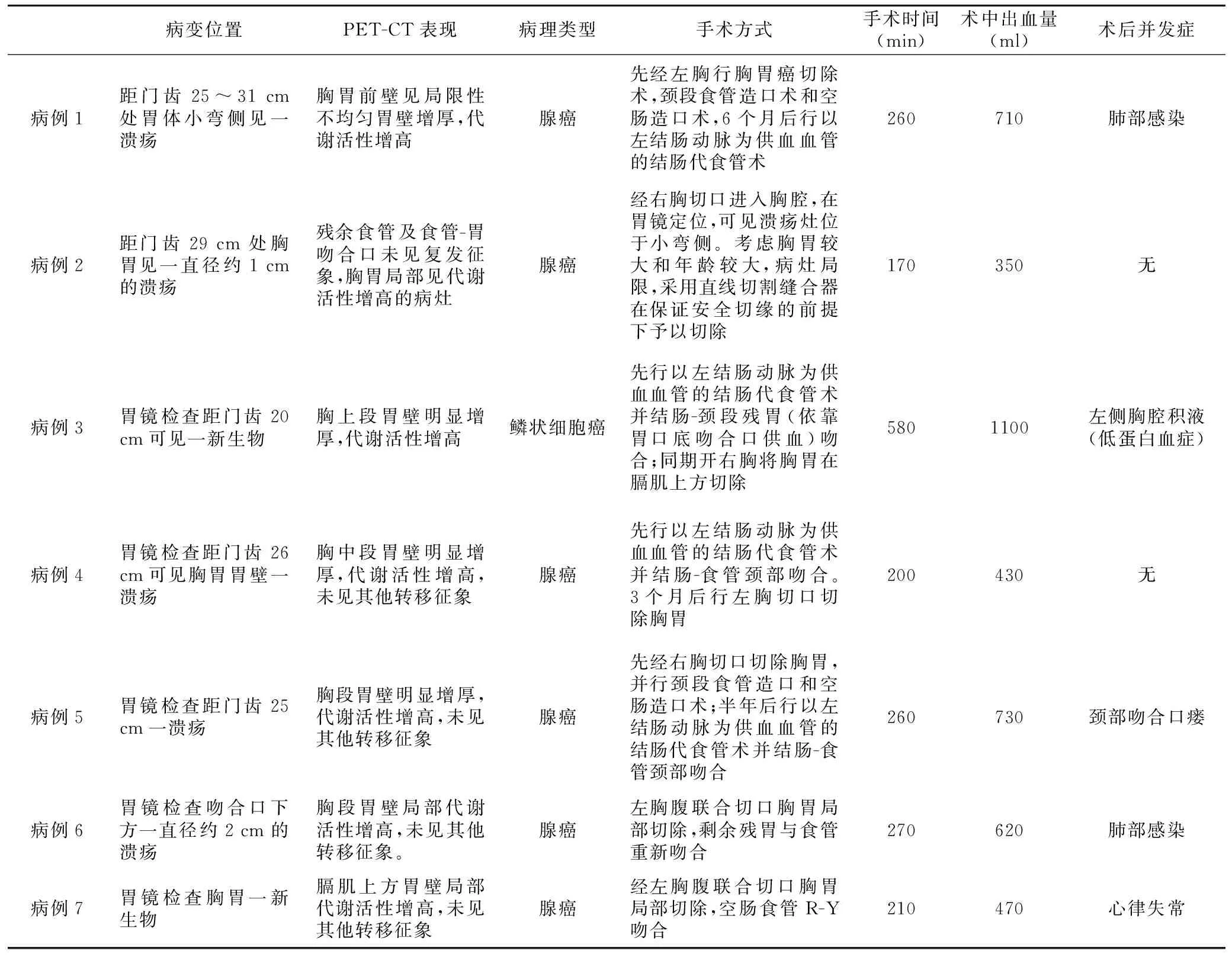
表2 7例病人的治療方法及術中情況
討 論
食管癌切除術后再發胸胃癌常常被認為食管癌合并發生的異時性雙源癌[2]。異時性胸胃癌的診斷標準:(1)距上次食管癌手術時間大于6個月;(2)首次食管手術切除標本為鱗狀細胞癌;(3)胃鏡活檢或手術切除的病理標本為腺癌[3]。食管癌術后存在膽汁和胰液反流,造成黏膜上皮細胞溶解,增強黏膜細胞增殖活性,加速細胞分裂,破壞胃黏膜的屏障作用,使胃更多地接觸致癌物和促癌物,誘發胃癌的發生[4]。本組病例絕大多數為腺癌,符合異時性胸胃癌的診斷標準。也有研究認為,胸胃癌的發生是癌殘留食管床復發浸潤胸胃所致,或是因為首次手術時就發生了黏膜下或淋巴結轉移所致[5]。本組病人中有1例病人,既往因下咽癌行食管拔脫術上提管胃,此次再發胸胃癌的位置為胸上段,病檢結果為鱗癌。
胸胃癌的早期癥狀往往不典型,中晚期可出現腹部疼痛、黑便、嘔血、嘔吐、貧血等胃癌相關癥狀,有時會被認為食管癌術后癥狀,易造成漏診及誤診。本組病例中有部分病人是通過食管癌術后行胃鏡檢查發現的。胃鏡下早期胸胃癌與吻合口潰瘍、殘胃炎等表現類似,誤診率較高,宜找準活檢取材的位置,以避免漏診。臨床醫生應提高胸胃癌的認識和警惕性,建議食管癌術后病人每年1次胃鏡檢查和上消化道鋇餐檢查;胃鏡發現黏膜有粗糙、糜爛或顆粒樣改變時,可胃鏡下取多處病變組織病理學檢查。
胸胃癌一經確診,治療原則應以手術切除為主,輔以化療、放療等綜合治療[6],早期效果較佳。應充分掌握首次手術方式,腫瘤的部位、大小和侵犯深度,是否存在其他部位轉移以及病人的全身狀態。選擇再次手術切除胸胃癌的消化道重建,應仔細認真的探查。(1)對于較早的胸胃癌,可采用內鏡下黏膜切除術或內鏡粘膜下剝離術(endoscopic submucosal dissection,ESD),切除的成功率常常依賴于腫瘤的浸潤深度;而ESD切除術后的并發癥為狹窄、食物殘留和出血等[7]。(2)對于胸胃未行管狀胃,且病變較為局限時,可采用局部切除手術方式。本組病人中有1例年齡較大的病人采用此術式,恢復較為順利。(3)胸胃癌多發生于胸段中或下三分之一。Saito等[8]報道,對于遠端胸胃癌的病人,切除遠端胸胃和胃網膜右血管及血管弓,保留近端胸胃(通過胃-食管吻合口供血),采用近端胸胃-空腸R-Y吻合的方式重建消化道,獲得成功。此手術方式的優點是避免游離胃食管吻合口和殘余食管,減少喉返神經的損傷;吻合口低,采用空腸重建即可完成,創傷相對較小。本組有1例病人頸部吻合口的近端為殘胃,殘胃血供來源于胃-口底吻合口,術后恢復較好,證實來源于吻合口的血供可滿足需要。(4)對于胸胃腫塊的位置較高時,可采用結腸重建消化道。如果病人的體質較弱,可采取分期手術的方式。一期先行胸胃癌切除術,頸部造口和空腸造口術;二期再進行結腸重建消化道。這樣有利于縮短手術時間,促進快速康復[9]。本組病人中有3例病人采用分期手術的方法,有2例先切除胸胃癌,擇期進行消化道重建,有1例病人先進行消化道重建,擇期切除胸胃癌;病人術后均恢復較為順利。
綜上所述,要提高對胸胃癌發生的認識,對食管癌切除術后的病人定期隨訪;結合胃鏡和上消化道鋇餐爭取做到早期診斷;根據病人的整體情況,采取以手術治療為主的綜合治療手段,提高病人的生活治療和生存率。

