嬰兒血管瘤長鏈非編碼RNA與mRNA表達譜分析
楊開穎 代詩懿 邱桐 周江元 陳思源 吉毅
1四川大學華西醫院小兒外科,成都610041;2四川大學華西醫院重癥醫學科,成都610041
嬰兒血管瘤(infantile hemangioma,IH)是嬰幼兒最常見的良性腫瘤,發病率為4%~5%[1]。絕大多數IH 可自然消退,但仍有10%~15%的IH 可引起嚴重并發癥[2]。研究表明,血管發生與血管生成均參與IH的發病過程,但確切機制尚不清楚[3]。目前,長鏈非編碼RNA(long noncoding RNA,lncRNA)已被證實在內皮細胞分化及血管生成等方面發揮重要調控作用[4]。本研究旨在通過基因芯片技術分析增殖期與消退期IH的lncRNA差異表達情況,并利用生物信息學技術分析lncRNA 參與調控IH發病的機制。
對象與方法
一、對象
2019年1-3月在四川大學華西醫院小兒外科行手術切除治療(在向所有患兒家屬介紹如口服普萘洛爾等非手術治療的前提下,家屬綜合考慮后首先選擇手術切除治療)的8 例IH 組織(表1),所有患兒在術前均未采取過任何治療措施。術中將切下標本組織分成兩份,一份立即轉運至-80 ℃冰箱長期儲存;另一份用于病理診斷及分期。經HE 染色(圖1)和免疫組化葡萄糖轉運蛋白1(GLUT-1)染色(圖2)分析,結合臨床特征,依據文獻[5]確診增殖期與消退期各4 例。其中,增殖期IH 顏色鮮艷,瘤體會逐漸生長并凸出體表,表面張力大;消退期IH顏色暗紅,瘤體逐漸縮小變軟,中心可以緩慢退化變白。本研究獲得四川大學華西醫院倫理委員會批準(批件號:2017414),取材前所有患兒家屬簽署知情同意書。
二、方法
1.RNA提取和lncRNA與mRNA表達譜芯片制備:采用Trizol試劑(美國Thermo Fisher Scientific公司)提取組織中總RNA,采用miRNeasy Minikit試劑盒(美國Qiagen 公司)將RNA 提純,使用Nano Drop 2000(美國Thermo Fisher Scientific 公司)分光光度計對RNA 進行定量,同時進行瓊脂糖凝膠電泳質檢,最終將制備的RNA樣本儲存于-80 ℃液氮中備用。采用Affymetrix GeneChip Human Transcriptome Array 2.0二代高通量芯片(美國賽默飛世爾科技公司)分析增殖期與消退期IH lncRNA與mRNA的差異表達譜,包含245 000余條mRNA探針和40 000余條lncRNA探針。每個標本都進行標準化的芯片上樣處理。基因芯片探針設計由上海其明科技有限公司完成。

表1 8例嬰幼兒局灶性混合型血管瘤臨床相關資料

圖1 嬰兒血管瘤皮損病理表現(HE×400) 1A:增殖期血管瘤內皮細胞高度增殖,血管管腔密集,罕見脂肪組織;1B:消退期血管瘤內皮細胞逐漸成熟,血管團塊逐漸形成管腔結構,血管管腔粗大肥厚,脂肪組織浸潤增多 圖2 免疫組化檢查(葡萄糖轉運蛋白1 染色×400) 2A:增殖期血管瘤血管內皮細胞染色陽性且豐富表達;2B:消退期血管瘤血管內皮細胞表達葡萄糖轉運蛋白1,但表達強度減少
2.生物信息學分析:①通過基因芯片篩選得到差異表達的lncRNA 與mRNA(篩選標準:P <0.05,差異倍數>1.5);②對差異表達mRNA 進行GO 功能和KEGG 通路富集分析;③構建lncRNA-mRNA共表達網絡,以相關系數>0.97 或<-0.97 及P <0.05 為標準進行lncRNA 靶基因篩選,并用Cytoscape 軟件對其進行可視化處理;④對lncRNA靶基因進行GO和KEGG分析,以預測lncRNA功能作用。以上分析在上海其明公司GCBI(https://www.gcbi.com.cn/)平臺完成。
3. 實時熒光定量PCR(qRT-PCR)驗證:采用SYBR Green qPCR方法,驗證增殖期與消退期IH組織中部分差異lncRNA 與mRNA 的表達,重復3次。采用TRIzol 試劑提取組織中總RNA 后進行核酸定量,參照cDNA 合成試劑盒說明書進行反轉錄,選用甘油醛-3-磷酸脫氫酶(GAPDH)作為內參基因,引物序列詳見表2。qPCR(美國賽默飛世爾科技公司)實驗反應條件為:95 ℃30 s;95 ℃15 s,60 ℃30 s共40個循環,最后做熔解解曲線分析。每份樣品重復檢測3次,采用2-△△Ct法計算差異lncRNA 與mRNA的相對表達量。
4.統計學分析:采用SPSS 23.0 軟件進行數據統計分析,連續性變量用±s 表示,采用獨立樣本t 檢驗比較組間差異(P <0.05,差異倍數≥1.5)。P<0.05認為差異有統計學意義。
結 果
一、增殖期和消退期IH差異表達的lncRNA與mRNA
以消退期IH 組織為參照組,增殖期IH 中共篩選出405條差異lncRNA,其中108條下調,297條上調,同時篩選出772 條差異mRNA,其中107 條下調,665 條上調(圖3)。前20 條差異lncRNA 與前30條差異mRNA分別見表3和表4。
二、增殖期和消退期IH差異mRNA的GO功能與KEGG通路富集分析
GO 功能分析顯示,差異mRNA 主要參與血管凝固、軸突導向、血管生成和細胞黏附以及對缺氧反應、凋亡過程、細胞增殖負調控等生物過程;KEGG 通路分析發現,差異mRNA 主要富集在代謝通路、細胞局部黏附、肌動蛋白細胞骨架調控、白細胞跨內皮遷移、磷脂酰肌醇-3-激酶/絲蘇氨酸蛋白激酶(PI3K-Akt)、血管平滑肌收縮等信號通路(圖4)。
三、增殖期和消退期IH lncRNA-mRNA 共表達網絡
經Cytoscape 可視化處理后生成的lncRNAmRNA 共表達網絡由370 個節點及1 244 條關系組成。為更好地展示lncRNA-mRNA 共表達網絡關系,選取度值(degree,一個點的度指圖中該點所關聯的邊數)≥15的差異lncRNA和mRNA構建相互作用網絡,該網絡由81個節點(23條mRNA和58條lncRNA)及269條關系組成。從此網絡中可知,1條lncRNA 可同時與多條mRNA 發生相互作用關系(圖5)。
四、增殖期和消退期IH lncRNA靶基因預測
結合lncRNA-mRNA共表達網絡,對lncRNA進行靶基因順式作用(cis)預測。通過尋找lncRNA上下游10 kb 范圍之內的mRNA,以相關系數>0.97或<-0.97 及P <0.05 為標準共篩選出18 對lncRNA-mRNA(表5)。對這些lncRNA預測的靶基因進行GO 功能及KEGG 通路分析,發現這些基因主要富集在“正向調控神經元分化”、“正向調控細胞分化”及“細胞膜電位調控”等生物過程以及“胰腺分泌信號通路”與“環腺苷酸信號通路”等。

表2 實時熒光定量PCR引物序列

圖3 增殖期和消退期嬰兒血管瘤差異表達的lncRNA(3A)與mRNA(3B)聚類圖 P:增殖期;I:消退期。在增殖期血管瘤中表達上調的lncRNA或mRNA均要比消退期多

表3 增殖期和消退期嬰兒血管瘤前20條差異(P <0.001)表達的lncRNA

表4 增殖期和消退期嬰兒血管瘤前30條差異(P <0.001)表達的mRNA
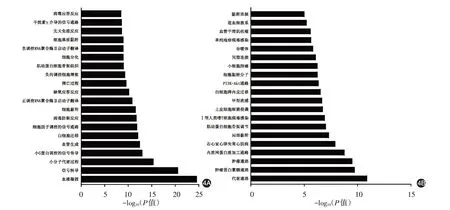
圖4 增殖期和消退期嬰兒血管瘤前20條差異表達的mRNA GO功能(4A)及KEGG通路(4B)富集結果

圖5 度值(degree)≥15 的lncRNA-mRNA 共表達網絡圖●代表mRNA,代表lncRNA;紅色代表上調,黃色代表下調。1條lncRNA可同時與多條mRNA發生相互作用關系
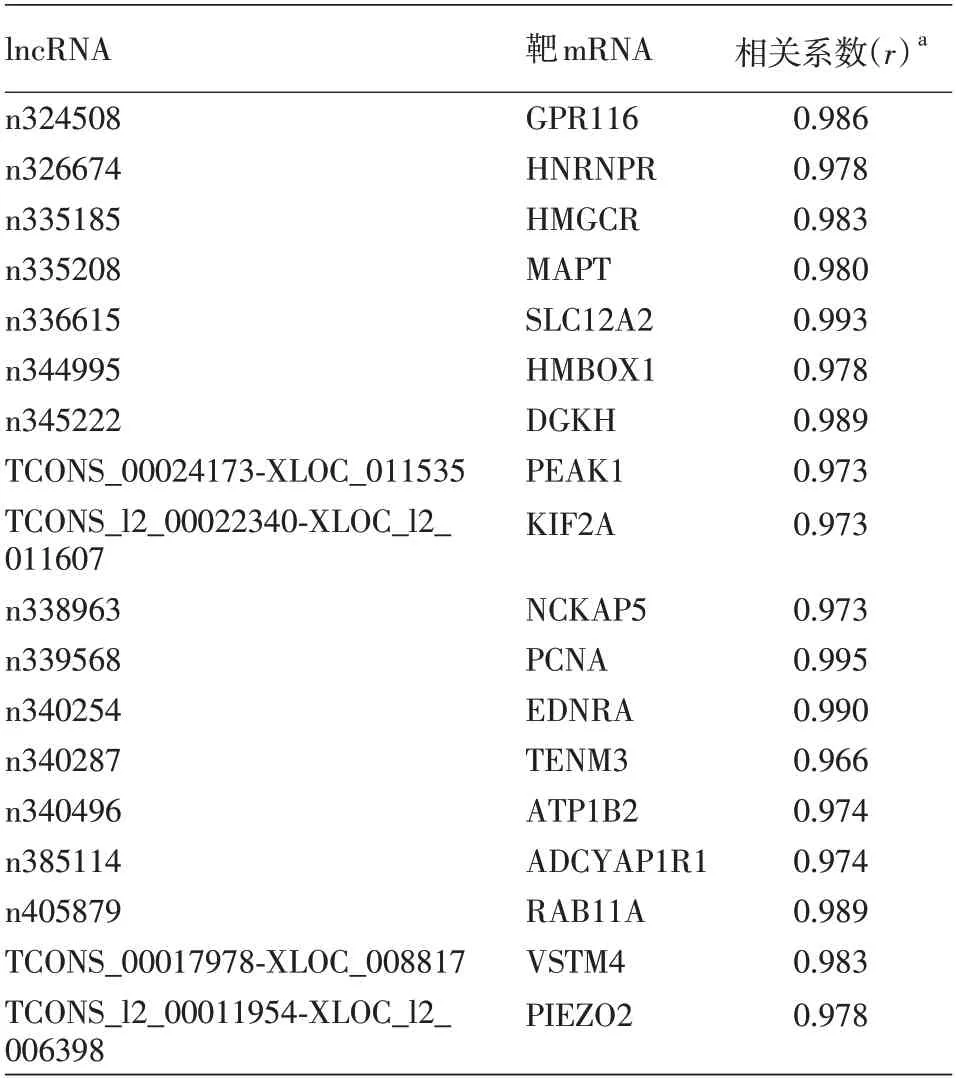
表5 增殖期和消退期嬰兒血管瘤差異表達的lncRNA靶基因預測
五、qRT-PCR驗證結果
隨機選擇差異表達的4 條lncRNA(n335248、ENST00000450864、n333319 和n335185)與4 條mRNA(EDNRA、IFI6、HK2 與ITGA1)進行qPCR 驗證,結果與芯片檢測結果一致。見圖6、表6。
討 論

圖6 qRT-PCR 結果驗證增殖期和消退期嬰兒血管瘤差異表達的lncRNA 與mRNA 1:IFI6;2:HK2;3:ITGA1;4:EDNRA;5:n335248; 6:n333319; 7:n335185; 8:ENST00000450864。Microarray:基因芯片;qRT-PCR:實時熒光定量PCR
表6 實時熒光定量PCR檢測增殖期和消退期嬰兒血管瘤差異表達的lncRNA與mRNA(±s)

表6 實時熒光定量PCR檢測增殖期和消退期嬰兒血管瘤差異表達的lncRNA與mRNA(±s)
注:n=3
mRNA/lncRNA IFI6 HK2 ITGA1 EDNRA n335248 n333319 n335185 ENST00000450864增殖期1.25±0.20 0.93±0.14 0.47±0.38 1.20±0.19 0.54±0.46 0.50±0.36 1.16±0.21 1.33±0.30消退期0.68±0.33 1.51±0.83 0.29±0.04 0.66±0.17 0.18±0.09 0.25±0.21 0.98±0.46 2.32±0.99 t值3.13-1.39 0.80 4.12 1.70 1.11 0.58-2.37 P值0.020 0.254 0.455 0.006 0.126 0.304 0.583 0.398
IH 是嬰幼兒時期最常見的良性腫瘤,具有典型的生長特征,即先快速增殖后緩慢消退[2]。研究表明,多條通路及多種基因參與IH 的發病過程[6],但是IH 從增殖期向消退期演化的機制仍然不明。隨著二代測序技術的發展,基因芯片越來越廣泛地用于輔助臨床疾病的診斷與治療。lncRNA 是長度>200 個核苷酸的分子,不具有編碼蛋白質功能。研究表明lncRNA 可以參與多種生物學功能,如在轉錄前、轉錄后調控mRNA 表達,從而影響細胞增殖、分化、凋亡和遷移,發揮調控血管生成的作用[7-8]。然而,lncRNA在IH中的表達情況及其所發揮的功能目前仍不清楚。為了更好地研究IH 中lncRNA 的作用,我們通過對比增殖期與消退期IH組織中lncRNA 與mRNA 的差異表達情況,結合生物信息學技術,篩選出與IH 發生發展相關的lncRNA 與mRNA,同時構建lncRNA-mRNA 共表達網絡。該共表達網絡表明,lncRNA 與mRNA 之間的聯系并不是簡單的一一對應關系。1 條mRNA可以由多條lncRNA共同調節,同樣地,1條lncRNA也可以作用于多條mRNA。這進一步佐證了IH 發病機制及發生發展過程的復雜化。通過lncRNAmRNA 共表達網絡,我們對lncRNA 靶基因進行預測,如lncRNA n405879靶基因RAB11A可以通過調控表皮生長因子的表達影響細胞分化[9],這為進一步深入探討血管瘤的發病機制提供了新方向。
本研究中,共篩選出445 條差異lncRNA 與772 條差異mRNA,這些差異基因不僅包括已經被證實參與調控IH 發病機制的重要基因,如DLL4、HIF1A、JAG1、HEY1 及PDGFRB 等[10-11],可參與Notch 信號通路,調控血管內皮細胞的增殖與遷移[6],還包括許多尚未發現與IH 相關的基因,如與血管生成相關的基因LEPREL1、RAMP2 及SERPINE1 等[12-14],它們可能在IH 發生發展過程中調控血管瘤內皮細胞的增殖、分化等,從而調控IH血管生成。GO 功能富集顯示,差異基因除了富集在血管生成、細胞黏附、對缺氧刺激反應等所熟知的參與IH發病機制的功能外[3],還富集在一些尚未在IH 領域內被深入研究的新的生物功能,如血液凝固與血小板激活及肌動蛋白細胞骨架等。既往研究顯示,消退期IH 比增殖期IH 中Ⅲ型膠原蛋白和層黏連蛋白大量沉積[15],普萘洛爾可以通過降低細胞外基質蛋白(基質金屬蛋白酶9)的表達,從而抑制血管瘤內皮細胞血管生成[16],這些功能均有報道與腫瘤生長存在聯系[17-18]。
同樣,本研究中KEGG 通路分析顯示,差異基因除富集在局部黏附通路、PI3K-Akt信號通路及細胞黏附分子通路等已知的與IH發生發展相關的通路外,還富集在代謝通路、肌動蛋白骨架調控通路、血管平滑肌收縮通路及胰島素信號通路等尚未在IH發病機制中被深入研究的通路。如參與代謝通路的HK2基因,其作為糖酵解通路的關鍵酶之一,可以通過促進乳酸產生從而調控腫瘤生長與遷移[19],同時研究顯示,PI3K-Akt 信號通路可以通過調控HK2的表達發揮抑制細胞凋亡和促進腫瘤生長的作用[20],這表明HK2 所參與的糖代謝通路很有可能也在IH發生發展過程中發揮作用。以上結果表明,多種差異基因可能參與多個生物過程以及多條信號通路,共同發揮對IH 發生發展過程的調控。
利益沖突所有作者均聲明不存在利益沖突

