氨基羥基脲脈沖輻解研究
郭建華,肖松濤,葉國安,歐陽應根,趙 晶
中國原子能科學研究院 放射化學研究所,北京 102413
核燃料后處理工藝的研究與發展對于核能的推廣與應用具有重要意義,PUREX流程作為目前世界上應用最為廣泛的核燃料后處理流程,其基礎工藝的改進對后處理技術具有重要推動作用,而無鹽有機還原劑的開發是改進工藝的主要研究方向之一。優異的還原劑不僅能提高U/Pu分離效率和產品質量,保證其氧化和輻解產物對其它工藝條件基本無影響,且實現試劑無鹽化,可大幅降低運行成本、提高安全系數。
氨基羥基脲(HSC,分子式N2H3CONHOH)是近幾年開發的具有“還原-支持還原-絡合”性能的無鹽有機還原劑,具有良好的親水性,可快速還原Pu(Ⅳ)到Pu(Ⅲ),還可與亞硝酸快速反應,替代單甲基肼作為體系中的支持還原劑,同時因含有羰基具有一定的絡合性,可與三價、四價陽離子形成絡合物。HSC作為弱堿性試劑(pH=8.0),只需極少量的硝酸中和,故可降低鹽析效應對Pu(Ⅲ)萃取分配的影響,且符合C、H、N、O無鹽原則,減少最終固體廢物量,降低核燃料后處理對環境的影響。但HSC在輻照和化學作用下會發生輻射降解等反應,這將引起有效濃度的降低,影響流程的正常運行。因此HSC的輻照穩定性就成為決定其是否可用的重要因素。
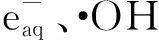
1 實驗部分
1.1 試劑
氨基羥基脲(HSC),純度99%,實驗室合成;叔丁醇(t-BuOH)、Na2CO3、KOH,均為色譜純,麥克林試劑公司;實驗用水為超純水,自制;N2和N2O氣體,純度大于99.99%,市售;其它試劑均為市售分析純。
1.2 實驗裝置
本實驗采用中國科學院上海應用物理研究所的納秒級脈沖輻解裝置,如圖1所示,電子直線加速器能量為10 MeV,脈沖寬度為8 ns,單脈沖吸收劑量10~40 Gy連續可調,時間分辨吸收光譜系統采用500 W氙燈為分析光源,分析光與電子束成垂直方向透過光程為10 mm的石英樣品池,經44 W的單色儀分光、濱松R928光電倍增管檢測,經反饋補償后由Lecroy wavepro7數字示波器轉換成數字信號,并記錄存儲于計算機中,以自編軟件進行動力學數據處理。
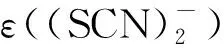
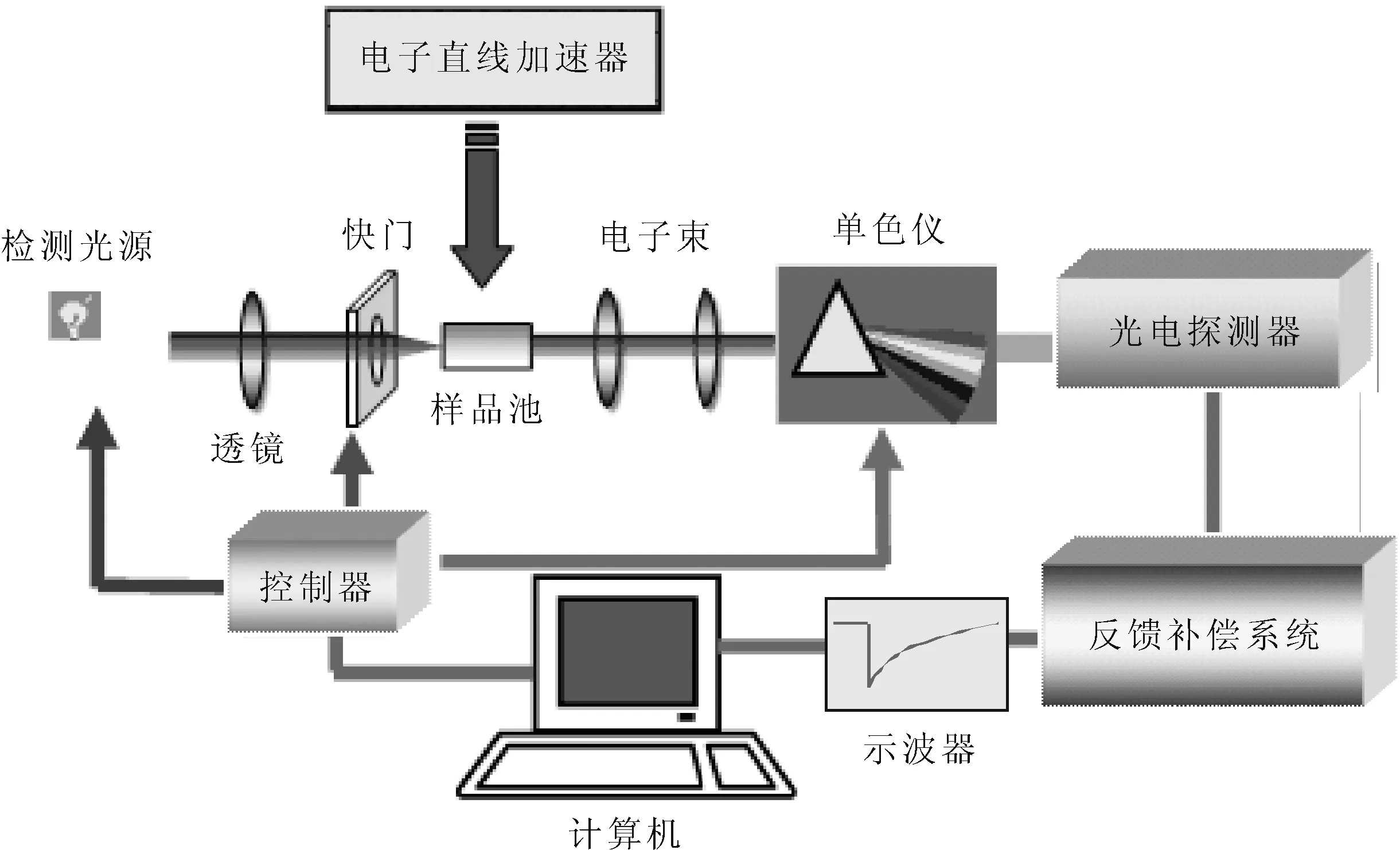
圖1 脈沖輻解裝置示意圖Fig.1 Schematic diagram of pulse radiolysis equipment
1.3 實驗方法
在本輻射實驗中,水作為溶劑吸收了大部分能量,產生了一定數量的活性粒子,其快速與HSC分子反應,所產生的瞬態粒子(自由基等)可由瞬態吸收光譜(時間分辨吸收光譜)裝置記錄,從而了解反應的中間產物并推斷其反應機理。
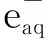
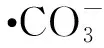
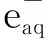
(2)
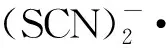
(3)
HSC、SCN-與·OH發生競爭反應時,該反應各參數存在如下關系:
1+k(·OH)c(HSC)/(k(SCN-)c(SCN-))
(4)
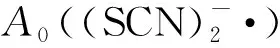
(5)
瞬態產物·C6H6OH在紫外-可見光區有強吸收。將HSC加入到上述溶液中,HSC與·H發生反應,從而減弱了·C6H6OH的吸收強度:
(6)
HSC、C6H5OH與·H發生競爭反應時,該反應各參數存在如下關系:
A0(·C6H6OH)/A(·C6H6OH)=
1+k(·H)c(HSC)/(k(PhOH)c(PhOH))
(7)
其中:A0(·C6H6OH)為無HSC時最大瞬態吸收波長處·C6H6OH的吸光度;A(·C6H6OH)為加入HSC后最大瞬態吸收波長處·C6H6OH的吸光度;k(·H)為HSC與·H反應的速率常數;k(PhOH)為C6H5OH與·H反應的速率常數。監測不同HSC濃度下的瞬態吸收光譜,利用競爭反應公式,以A0(·C6H6OH)/A(·C6H6OH)-1對c(HSC)/c(PhOH)作圖得到一條直線,利用該直線的斜率及k(PhOH)即可得到HSC與·H反應的速率常數k(·H)。
2 結果與討論
2.1 HSC與的反應
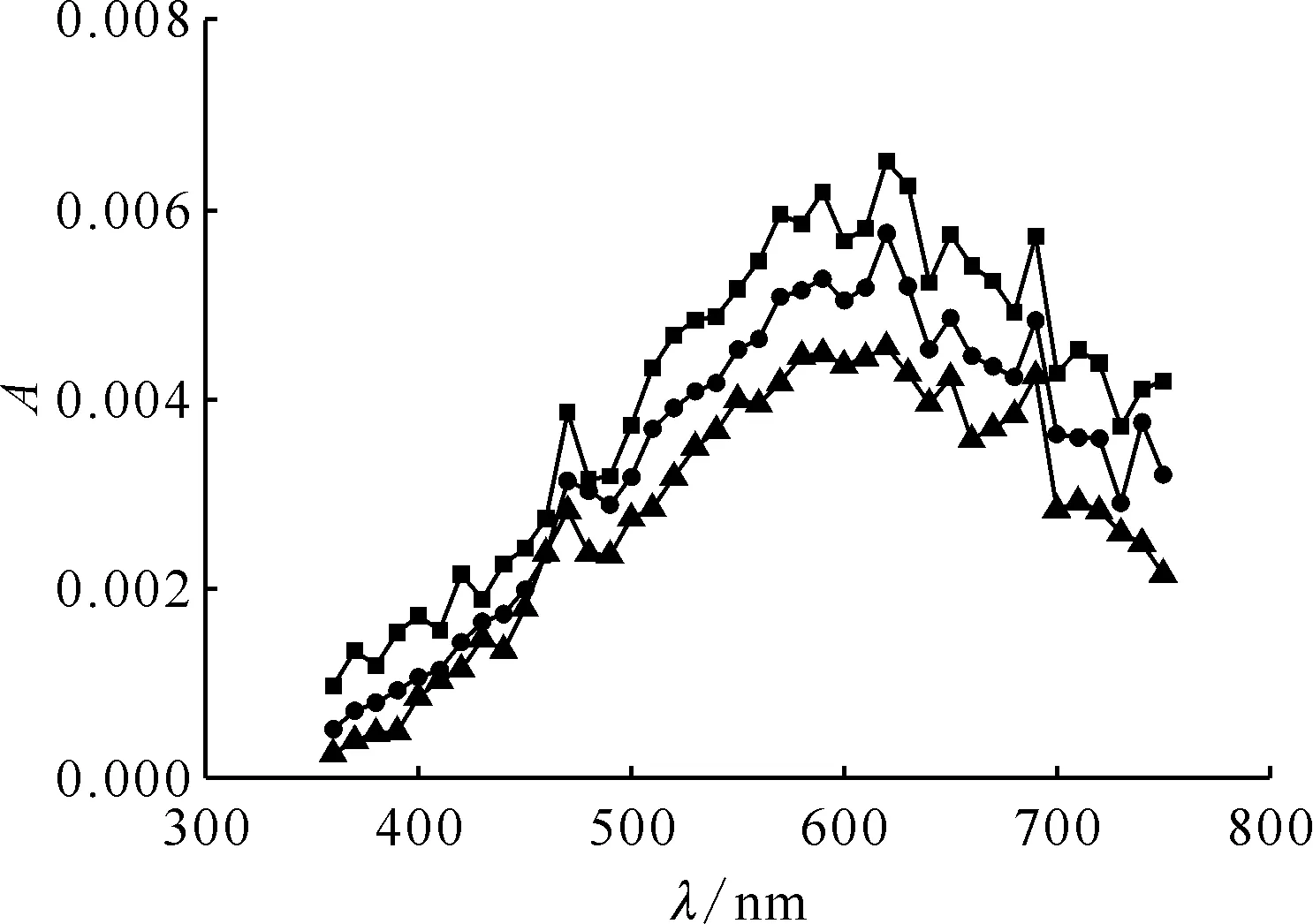
pH=10.0,c(HSC)=8.0 mmol/L,c(t-BuOH)=0.1 mol/L■——0.025 μs,●——0.055 μs,▲——0.100 μs圖2 N2飽和的HSC溶液脈沖輻解光譜圖Fig.2 Transient spectra of HSC solution saturated with N2 after pulse radiolysis
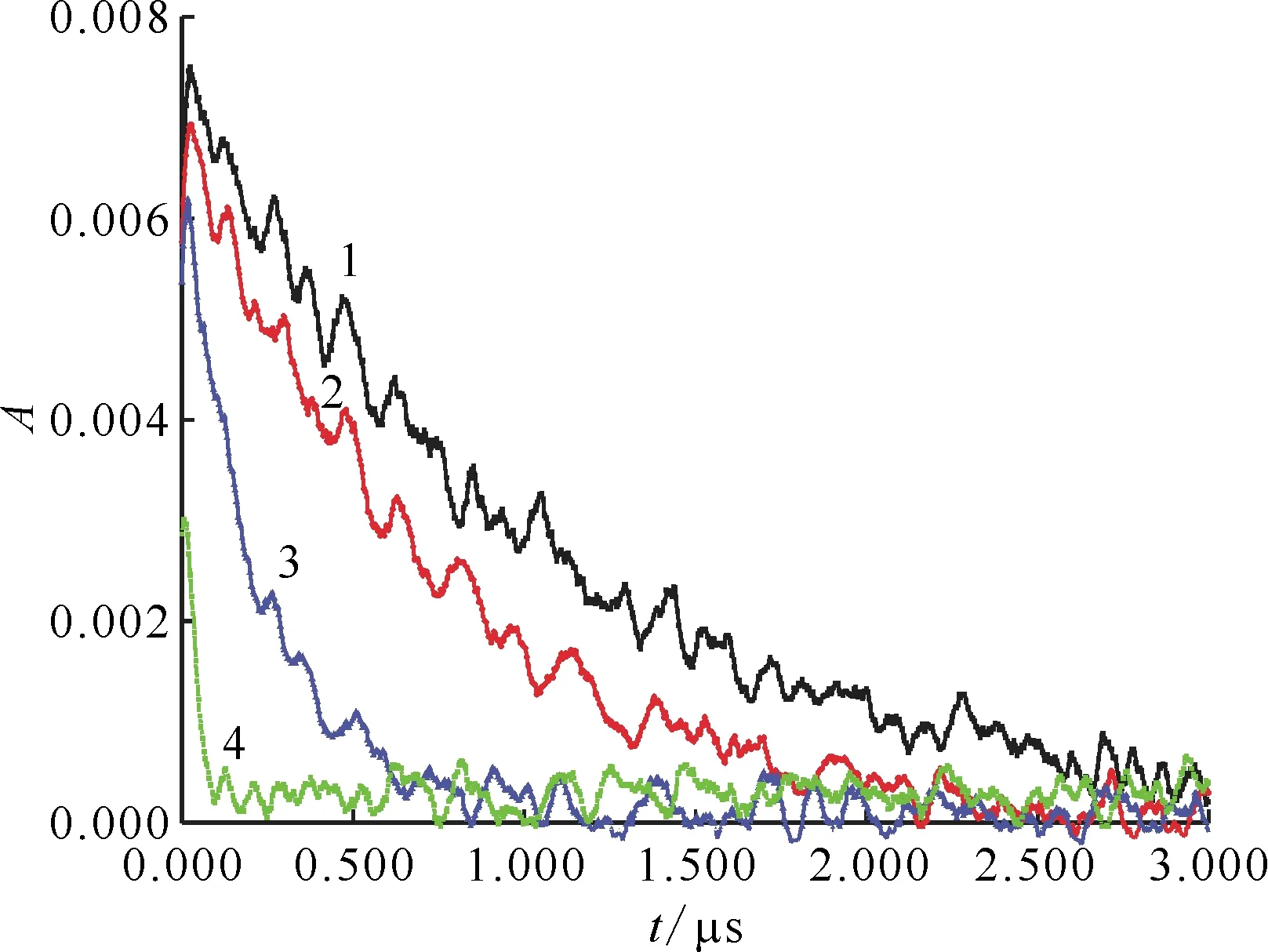
pH=10.0,c(t-BuOH)=0.1 mol/L1——0.6 mmol/L HSC,2——4.0 mmol/L HSC,3——10.0 mmol/L HSC,4——40.0 mmol/L HSC圖3 620 nm處吸光度隨時間變化的動力學衰減譜Fig.3 Kinetic attenuation spectrum of absorbance over time at 620 nm
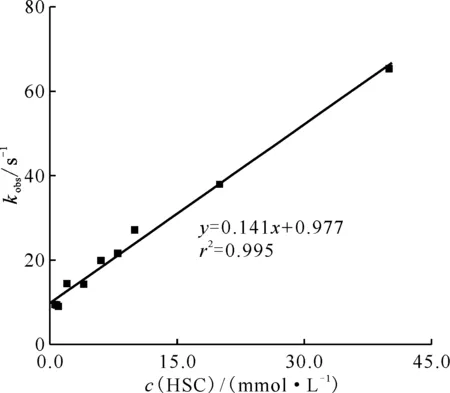
圖與HSC反應的表觀速率常數同HSC濃度的關系Fig.4 Relationship between apparent reaction rate constant of -HSC and HSC concentration
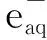
(8)
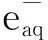
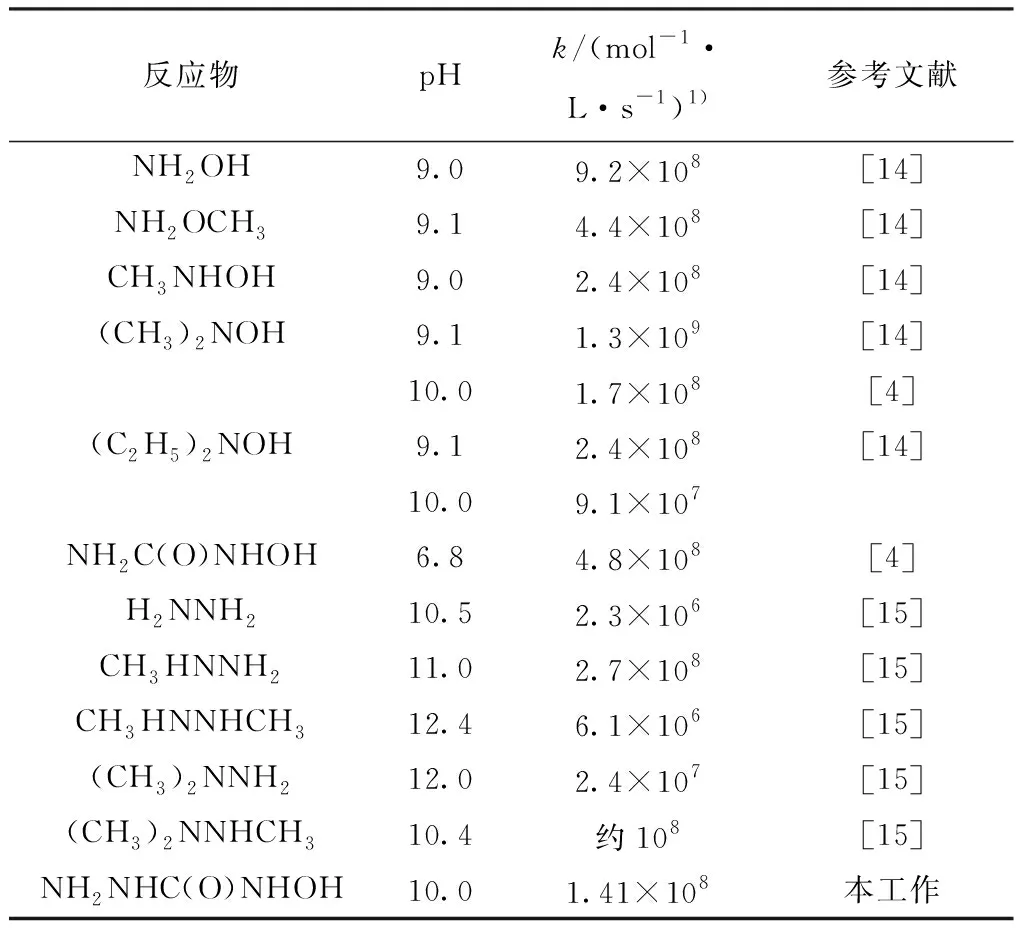
反應物pHk/(mol-1·L·s-1)1)參考文獻NH2OH9.09.2×108[14]NH2OCH39.14.4×108[14]CH3NHOH9.02.4×108[14](CH3)2NOH9.11.3×109[14]10.01.7×108[4](C2H5)2NOH9.12.4×108[14]10.09.1×107NH2C(O)NHOH6.84.8×108[4]H2NNH210.52.3×106[15]CH3HNNH211.02.7×108[15]CH3HNNHCH312.46.1×106[15](CH3)2NNH212.02.4×107[15](CH3)2NNHCH310.4約108[15]NH2NHC(O)NHOH10.01.41×108本工作
2.2 HSC與單電子氧化劑的反應
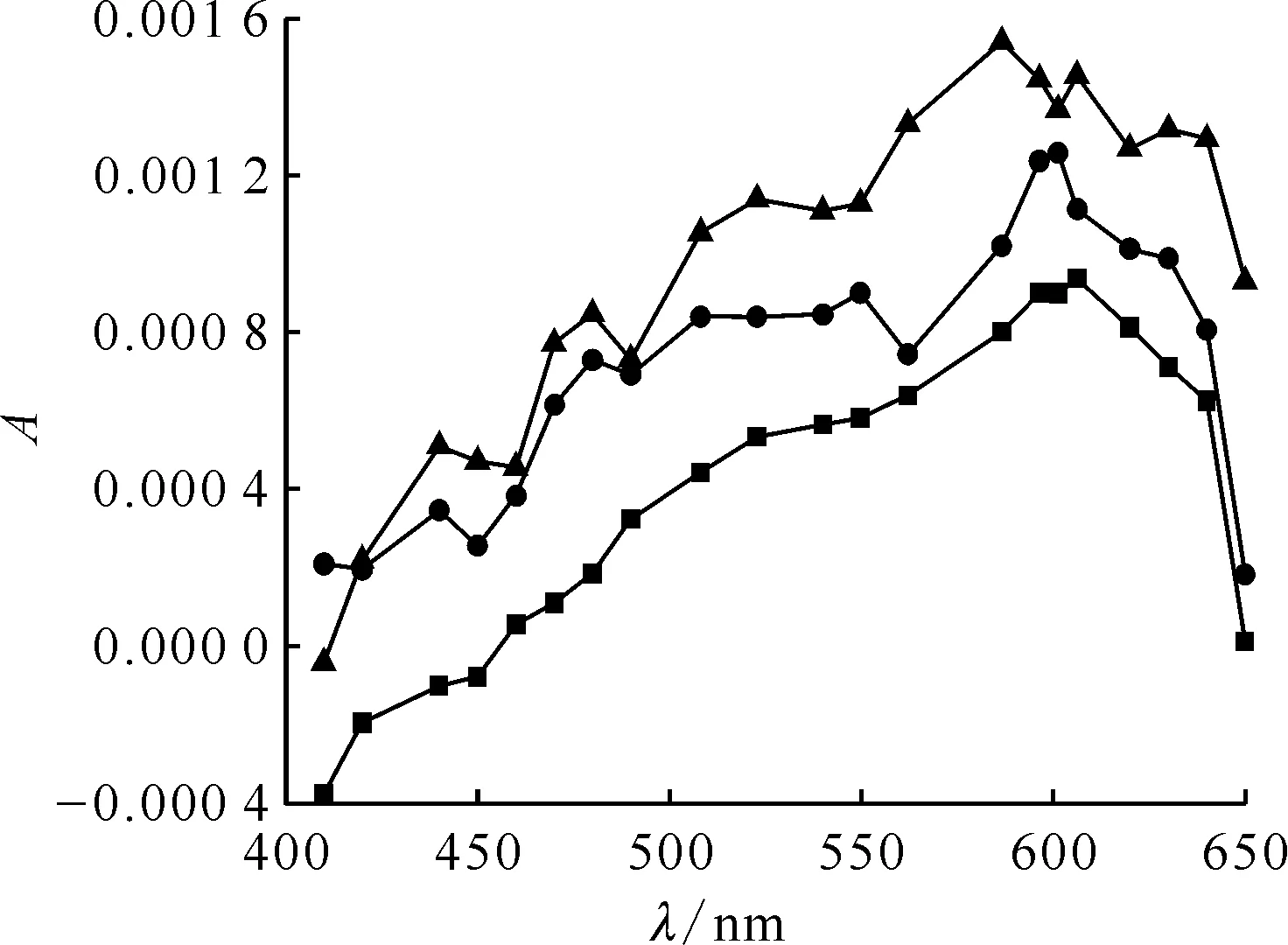
pH=10.0,c(HSC)=0.4 mmol/L,c(Na2CO3)=0.1 mol/L■——0.035 μs,●——0.050 μs,▲——0.500 μs圖5 N2O飽和的HSC溶液脈沖輻解光譜圖Fig.5 Transient spectra of HSC solution saturated with N2O after pulse radiolysis
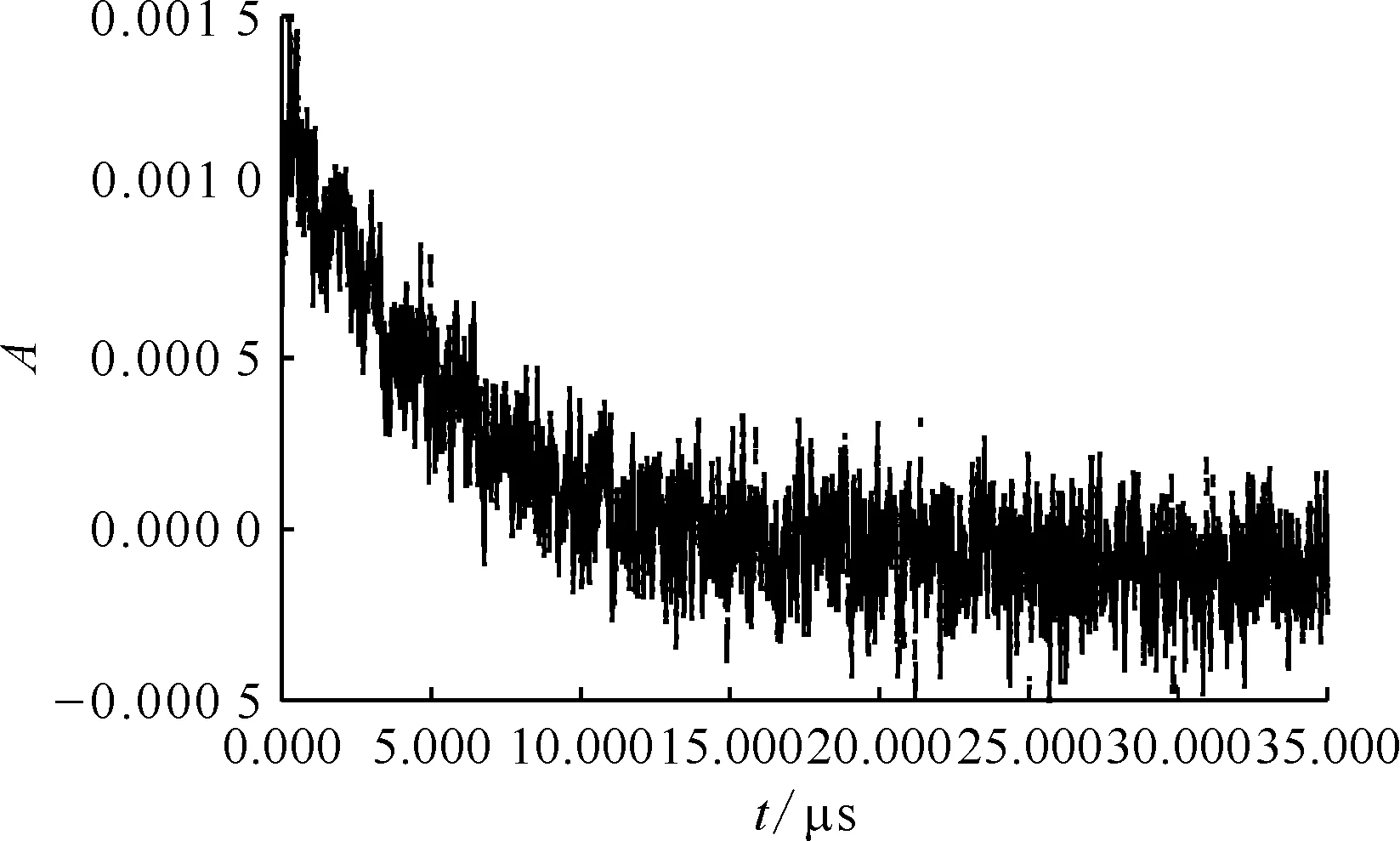
圖6 600 nm處吸光度 隨時間變化的動力學衰減譜Fig.6 Kinetic attenuation spectrum of absorbance over time at 600 nm
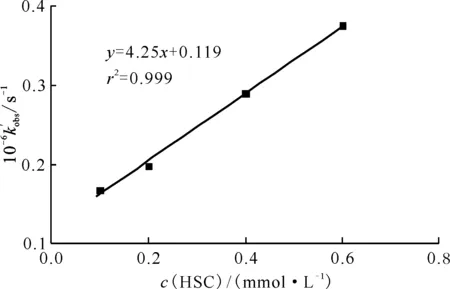
圖與HSC反應的表觀速率常數同HSC濃度的關系Fig.7 Relationship between apparent reaction rate constant of and HSC concentration
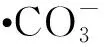
(9)

反應物pHk/(mol-1·L·s-1)1)參考文獻(CH3)2NOH10.03.9×107[4] (C2H5)2NOH10.04.2×107[4]NH2NHC(O)NHOH10.04.25×108本工作
2.3 HSC與·OH 的反應
2.3.1吸收光譜 配制10 mmol/L的KSCN溶液,向其中加入KOH溶液,使溶液pH=10.0,通入N2O約20 min,進行脈沖輻解實驗,得到KSCN與·OH反應的瞬態吸收譜圖示于圖8。從圖8可看出,KSCN水溶液在經電子束輻照后在470 nm處出現最大吸收峰。
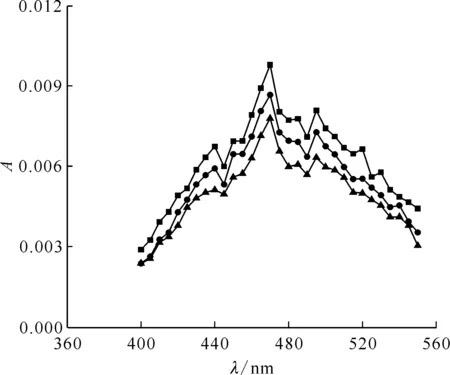
c(KSCN)=10 mmol/L,pH=10.0■——0.500 μs,●——1.000 μs,▲——2.000 μs圖8 N2O飽和的KSCN溶液脈沖輻解光譜圖Fig.8 Transient spectra of KSCN solution saturated with N2O after pulse radiolysis
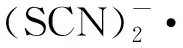
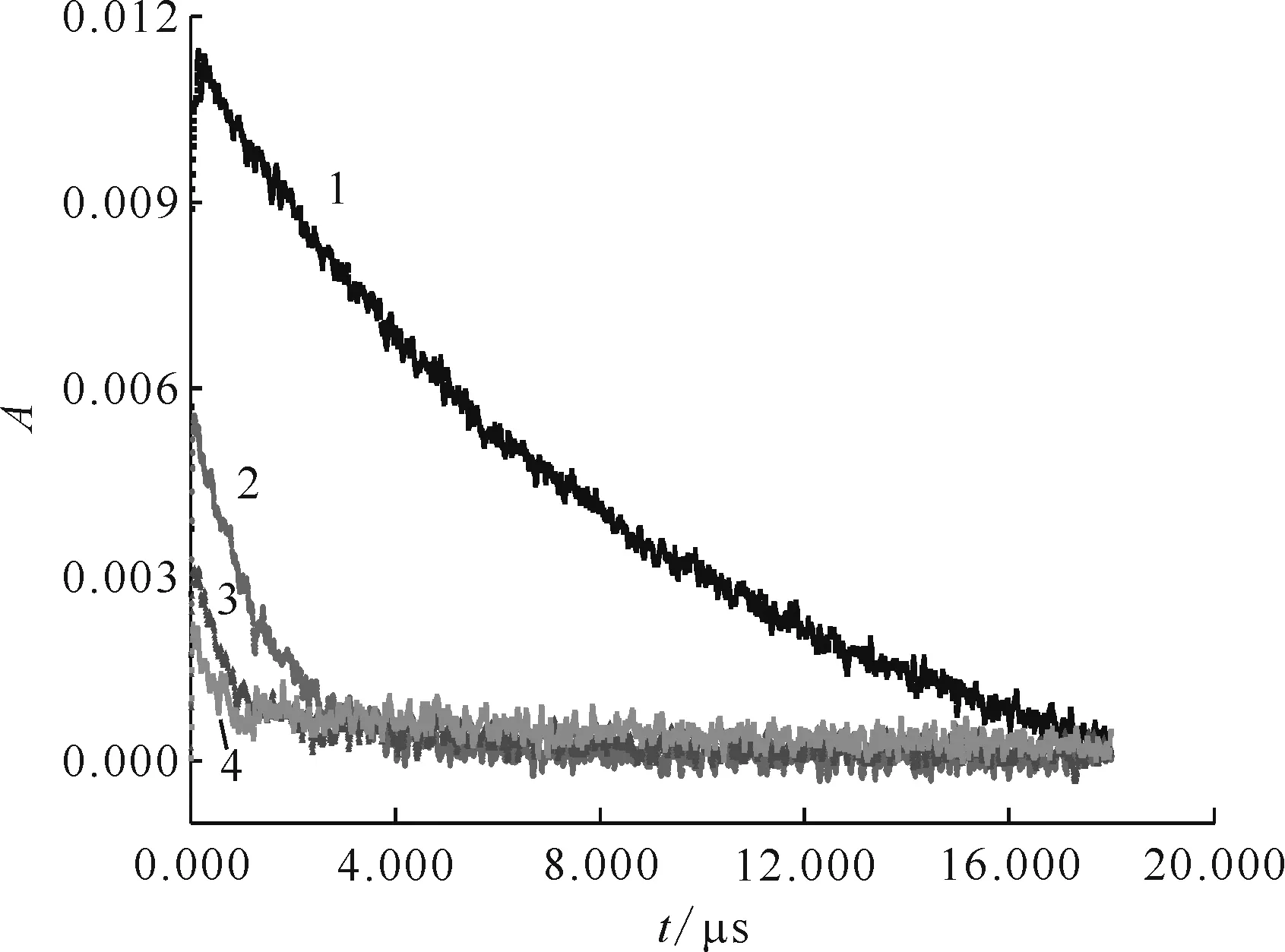
pH=10.01——10 mmol/L KSCN,2——10.0 mmol/L HSC-10 mmol/L KSCN,3——20.0 mmol/L HSC-10 mmol/L KSCN,4——40.0 mmol/L HSC-10 mmol/L KSCN圖9 470 nm處吸光度隨時間變化的動力學衰減譜Fig.9 Kinetic attenuation spectrum of absorbance over time at 470 nm
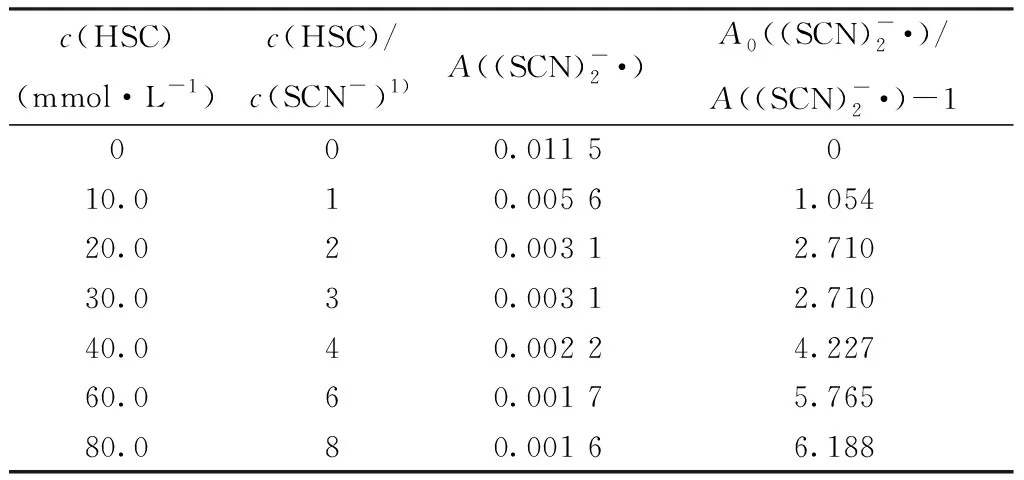
c(HSC)(mmol·L-1)c(HSC)/c(SCN-)1)A((SCN)-2·)A0((SCN)-2·)/A((SCN)-2·)-1000.011 5010.010.005 61.05420.020.003 12.71030.030.003 12.71040.040.002 24.22760.060.001 75.76580.080.001 66.188
注:1) c(KSCN)=10 mmol/L,pH=10.0,470 nm
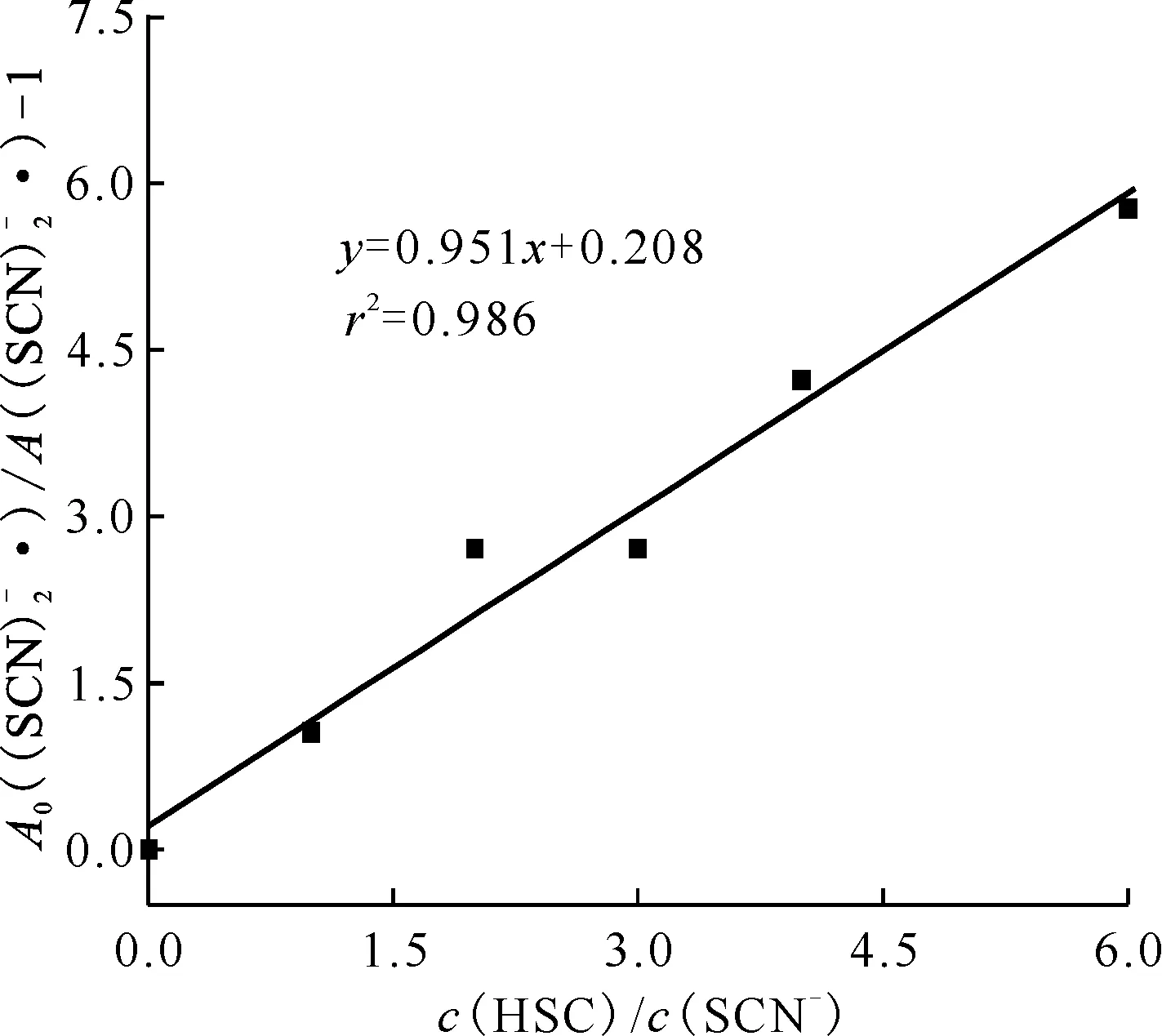
圖與c(HSC)/c(SCN-)的關系圖 vs. c(HSC)/c(SCN-)
2.3.3反應機理分析 ·OH具有較強的氧化性,其與肼和羥胺衍生物既發生氧化反應也發生抽氫反應[4]:
(10)
通過文獻[14-15]獲取羥胺及其衍生物、肼及其衍生物與·OH反應的速率常數列于表4。由于不同實驗室的結果具有較大差異,故文獻數據僅供參考,難以進行精確量化比較。由文獻[14-15]可知,肼和羥胺衍生物未質子化時與·OH的反應速率相當,可能是由于·OH氧化電位較高,導致其速率常數差距不明顯。而HSC與·OH的反應速率與羥胺衍生物及肼衍生物與·OH反應速率相當,其內在規律有待進一步研究。
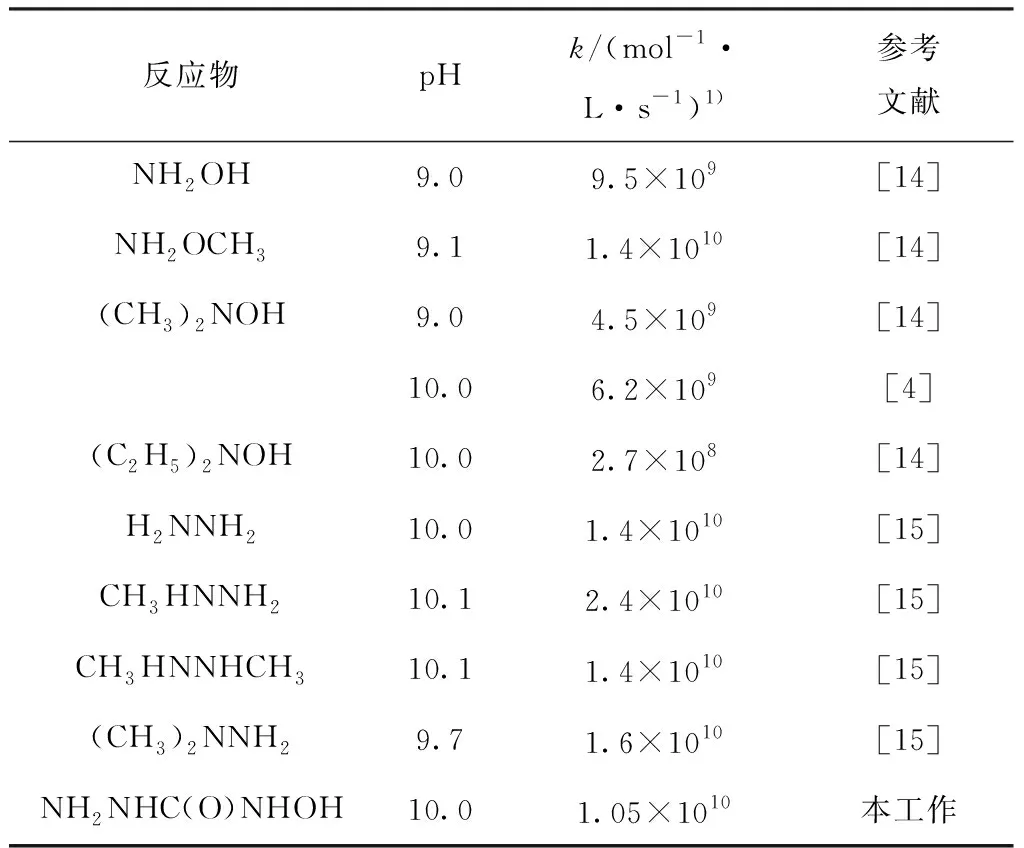
表4 羥胺、肼及其衍生物與·OH反應速率常數Table 4 Reaction rate constants of ·OH with hydroxylamines and hydrazines in aqueous solution
2.4 HSC與·H 的反應
2.4.1吸收光譜 配制20 mmol/L的PhOH溶液,向其中加入HClO4溶液,使溶液pH=2.0,通入N2O約20 min后進行脈沖輻解實驗,得到PhOH與·H反應的瞬態吸收譜圖示于圖11。由圖11可看出,310 nm、340 nm及400 nm處有三個明顯的最大吸收峰,其中310 nm和340 nm峰值較大,而340 nm干擾更小,故選擇340 nm作為最大瞬態吸收峰波長,研究PhOH與·H的反應動力學。在340 nm處,PhOH與·H反應瞬態產物典型的動力學衰減譜圖示于圖12,對衰減部分做反應級數擬合,經計算得到PhOH與·H的反應速率常數k(PhOH)=9.3×106L/(mol·s)。
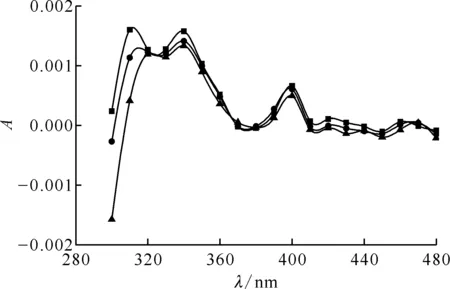
c(PhOH)=20 mmol/L,c(t-BuOH)=0.1 mol/L,pH=2.0■——0.070 μs,●——0.080 μs,▲——0.090 μs圖11 N2O飽和的PhOH溶液脈沖輻解光譜圖Fig.11 Transient spectra of phenol solution saturated with N2O after pulse radiolysis
2.4.2反應動力學 配制0、10.0、30.0、40.0、60.0、80.0 mmol/L HSC-8 mmol/L PhOH溶液,向上述溶液中分別加入HClO4溶液,使溶液pH=2.0,通入N2O約20 min后進行脈沖輻解實驗,獲得樣品在最大瞬態吸收波長340 nm處的動力學衰減示于圖13。加入HSC后,c(HSC)/c(PhOH)、340 nm處PhOH吸光度及A0(·C6H6OH)/A(·C6H6OH)-1值列于表5。根據HSC、PhOH與·H發生競爭反應關系式(7),以A0(·C6H6OH)/A(·C6H6OH)-1對c(HSC)/c(PhOH)作圖得到一條直線示于圖14,如圖14所示,直線斜率k(·H)/k(PhOH)=0.028 8,k(PhOH)=9.3×106L/(mol·s),由此可求得HSC與·H反應的速率常數k(·H)=2.68×105L/(mol·s)。
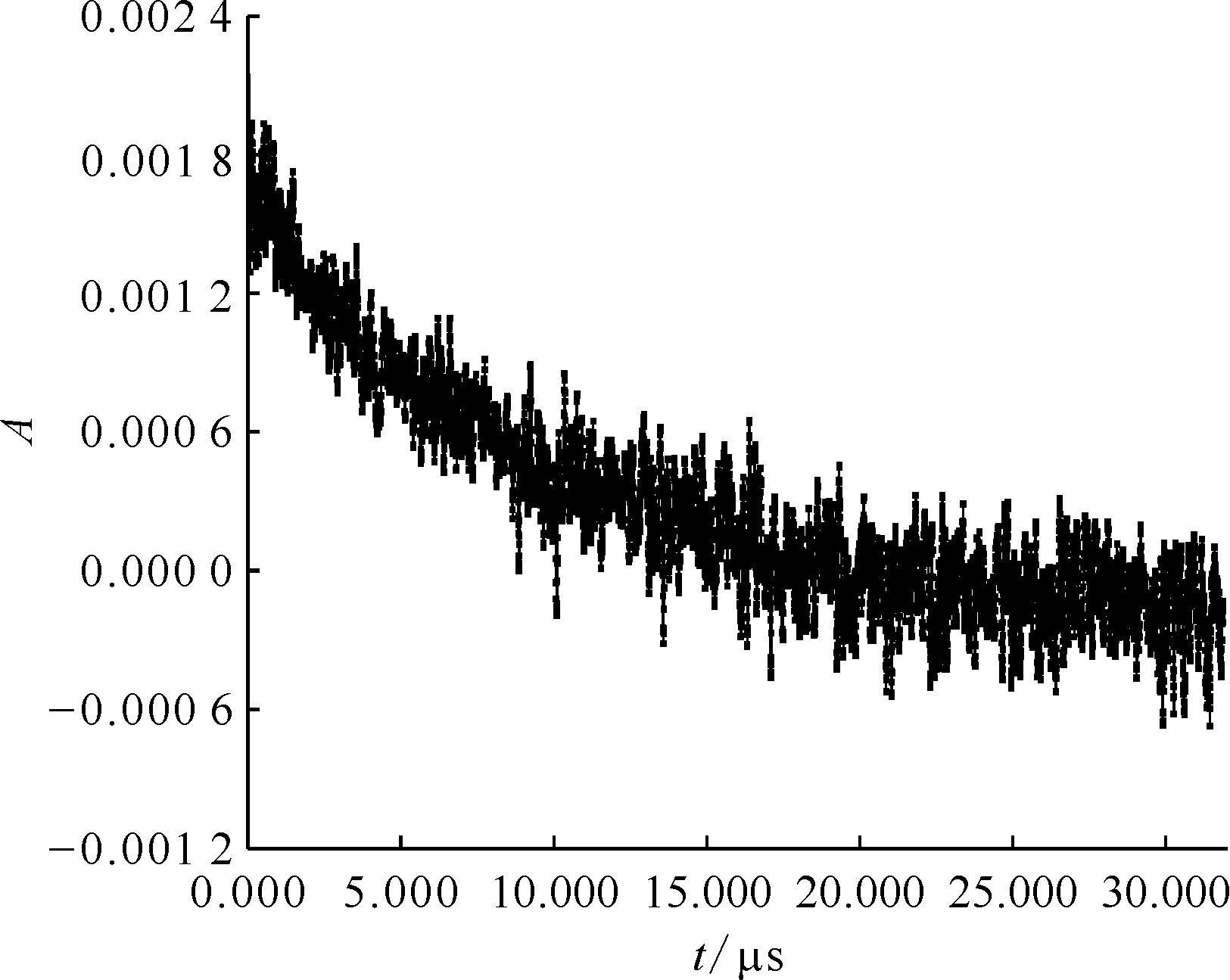
20 mmol/L PhOH,pH=2.0圖12 340 nm處·C6H6OH吸光度隨時間變化的動力學衰減譜Fig.12 Kinetic attenuation spectrum of ·C6H6OH absorbance over time at 340 nm
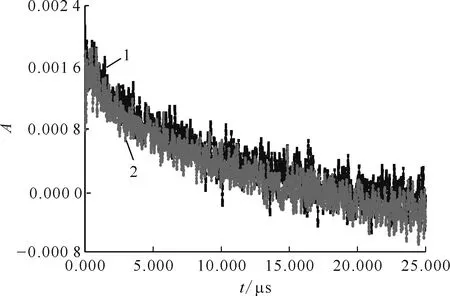
pH=2.01——8 mmol/L PhOH,2——10.0 mmol/L HSC-8 mmol/L PhOH圖13 有HSC時340 nm處·C6H6OH吸光度隨時間變化的動力學衰減譜Fig.13 Kinetic attenuation spectrum of ·C6H6OH absorbance over time at 340 nm with HSC
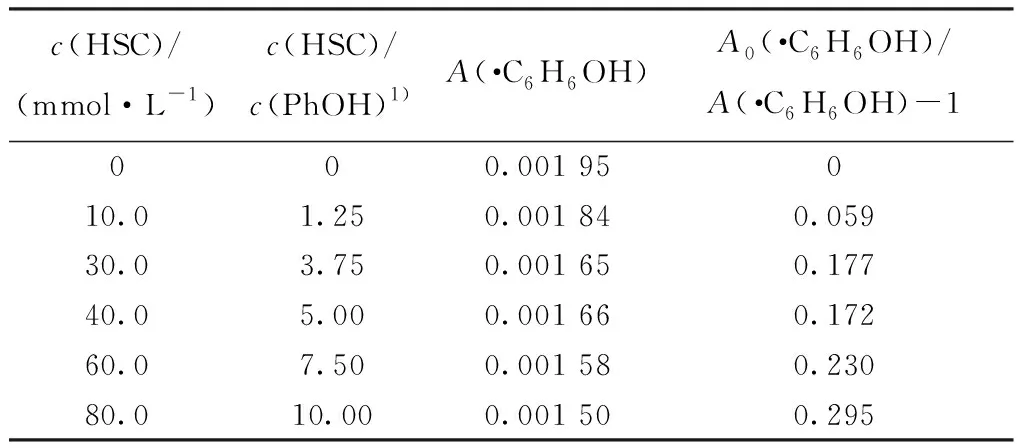
表5 PhOH吸光度及A0(·C6H6OH)/A(·C6H6OH)-1的值Table 5 Absorbance of PhOH and value of A0(·C6H6OH)/A(·C6H6OH)-1
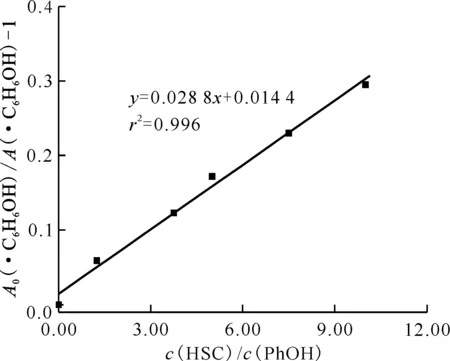
圖14 A0(·C6H6OH)/A(·C6H6OH)-1與c(HSC)/c(PhOH)的關系圖Fig.14 A0(·C6H6OH)/A(·C6H6OH)-1 vs. c(HSC)/c(PhOH)
(11)
通過文獻[4]獲取羥胺及其衍生物與·H反應的速率常數列于表6。由表6數據可知,直支鏈羥胺衍生物與·H的反應速率相當,而HSC與·H的反應速率略快,其內在規律有待進一步研究。

表6 羥胺及其衍生物與·H反應速率常數Table 6 Reaction rate constants of ·H with hydroxylamines in aqueous solution
3 結 論

-dc(HSC)/dt=1.05×1010c(HSC)c(·OH)
-dc(HSC)/dt=2.68×105c(HSC)c(·H)
(2) HSC與活性粒子之間存在競爭反應。比較各反應速率常數可知,HSC與·OH反應速率常數較大,而與·H反應速率常數較小,因此當1BX、2BX料液受到輻照后,HSC與·OH反應為其主要反應。

