鐵錳氧化物復合吸附劑的制備及其對多種離子的吸附性能試驗研究
李勝英,馮建海,蔣鵬杰,李俊宇,張暉英
(河池學院 化學與生物工程學院,廣西 宜州 546300)
廢水中的重金屬污染具有致毒性、隱蔽性、長期性、不可降解性等特點[1],已引起廣泛關注。目前,在國內外處理廢水重金屬污染的方法中,吸附法因原料來源廣、價格低廉、效率高,已成為研究熱點之一[2-4]。
鐵、錳氧化物復合吸附劑在吸附治理污水方面性能優異[5-8]。Mn3O4和Fe3O4都屬于由M2+和M3+組成的尖晶石型結構氧化物[9],用于污染處理方面的研究有很多[10-14]:添加Mn3O4的復合材料對Pb2+和Cu2+的吸附量比單碳成分材料提高2.2倍和6.1倍[14];用酸改性的Fe3O4除氟效果更佳,適用的pH范圍更寬[15]。Mn3O4、Fe3O4或二者的復合材料可以人工制備[16-19],但有關復合材料用于吸附廢水中的重金屬離子的研究鮮見報道。
根據氧化還原原理,試驗采用一步真空法制備鐵錳氧化物復合吸附劑,并將其用于吸附廢水中的單一金屬離子和混合離子(mixCu2+、mixZn2+、mixCd2+),探討了不同溫度及離子濃度條件下該吸附劑對金屬離子的吸附效果,以期為治理含重金屬離子的廢水找到一種適合的吸附劑。
1 試驗部分
1.1 儀器與試劑
FA1004B型電子天平(上海越平科學儀器有限公司),DHG-9245A電熱鼓風干燥箱(上海凱朗儀器設備廠),DF-101S集熱式恒溫加熱磁力攪拌器(河南省予華儀器有限公司),NICOLET6700傅立葉紅外變換光譜儀(美國賽默飛世爾),200FEG場發射環境掃描電鏡(荷蘭飛利浦公司),X射線衍射儀(深圳市萊雷科技發展有限公司),GGX-800原子吸收光譜儀(北京海光儀器有限公司),雙層恒溫培養震蕩器(上海智城分析儀器制造有限公司)。
FeSO4·7H2O(廣東汕頭市西隴化工廠),KMnO4(西隴化工股份有限公司),3CdSO4·8H2O(天津市光復精細化工研究所),CuSO4·5H2O(天津市光復科技發展有限公司),Zn(NO3)·6H2O(西隴化工股份有限公司),KBH4(國藥集團化學試劑有限公司),Cu、Zn、Cd標準溶液(國家有色金屬及電子材料分析測試中心,1 000 μg/mL),均為分析純。
1.2 鐵錳復合吸附劑的制備
取20 mL一定質量濃度的FeSO4·7H2O溶液于特制圓底燒瓶中,用抽濾泵持續抽濾模擬真空環境,在一定溫度下水浴加熱,緩慢加入10 mL一定質量濃度硼氫化鉀溶液,水浴反應0.5 h后緩慢加入30 mL一定質量濃度高錳酸鉀溶液,繼續反應適宜時間,得到灰黑色產物;將產物過濾,水洗至溶液pH不再變化,80 ℃下干燥24 h,得到鐵錳氧化物復合吸附劑。
1.3 鐵錳氧化物復合吸附劑樣品的表征
鐵錳氧化物復合吸附劑表面官能團、微觀形貌和晶體結構分別采用NICOLET6700傅立葉紅外光譜儀(美國賽默飛世爾科技有限公司)、200FEG場發射環境掃描電鏡(荷蘭飛利浦公司)、X射線衍射儀(深圳市萊雷科技發展有限公司)進行分析。
1.4 鐵錳氧化物吸附劑對金屬離子的吸附
分別配制100 mL質量濃度為100 mg/L的Cu2+、Zn2+、Cd2+溶液及質量濃度各為100 mg/L的Cu2+、Zn2+、Cd2+混合溶液,并向各溶液中加入0.100 0 g鐵錳氧化物復合吸附劑,置于搖床中,分別在25、35、45 ℃下以150 r/min速度恒溫振蕩。取振蕩不同時間的吸附液,過濾,用原子吸收光譜法測定各金屬離子質量濃度,按式(1)計算金屬離子吸附量(qt)。
(1)
式中:qt—復合吸附劑對金屬離子的吸附量,mg/g;ρ0—金屬離子初始質量濃度,mg/L;ρt—吸附t時間后金屬離子質量濃度,mg/L;V—溶液體積,L;m—復合吸附劑質量,g。
在25 ℃下,控制3種離子溶液中離子質量濃度、混合溶液中金屬離子質量濃度分別為80、120 mg/L, 重復上述步驟,測定吸附劑對金屬離子的吸附量。
2 試驗結果與討論
2.1 復合吸附劑的表征
2.1.1 SEM表征
圖1為鐵錳氧化物復合吸附劑在不同倍率下的SEM照片。可以看出:復合吸附劑的形貌為片狀或類球狀,進而相互疊加形成“串狀結構”,顆粒大小相對較均一。

a—20 000倍;b—50 000倍。
2.1.2 FT-IR表征
綜上所述,壓力超負荷和容量超負荷分別作用于心動周期的不同時段,引起向心性和離心性心臟肥大。但是,由于均為機械應力超負荷誘發,壓力超負荷和容量超負荷心臟肥大在病因和病理改變上,并非涇渭分明的兩類心臟重構,而是呈現相互交叉的特點,且在病變的不同階段呈現動態變化。本文揭示了一些肥大相關信號在兩類超負荷心臟重構中的差異,并初步提出了CaN和Akt信號通路可能分別是針對兩類超負荷精準化治療的靶點。其上下游調控因子在兩類超負荷心臟重構中的調控差異,尚需進行深入研究。
圖2為鐵錳氧化物復合吸附劑的FT-IR分析結果。可以看出:在3 550 cm-1處的吸收峰對應—OH伸縮振動峰;840 cm-1處的吸收峰為摻雜水分的雜峰;1 480 cm-1處的2個弱峰對應M—O鍵的彎曲振動峰;1 645 cm-1和538 cm-1處的峰對應Fe—O彎曲振動吸收峰;668 cm-1處的峰對應Mn—O特征吸收峰[20]。
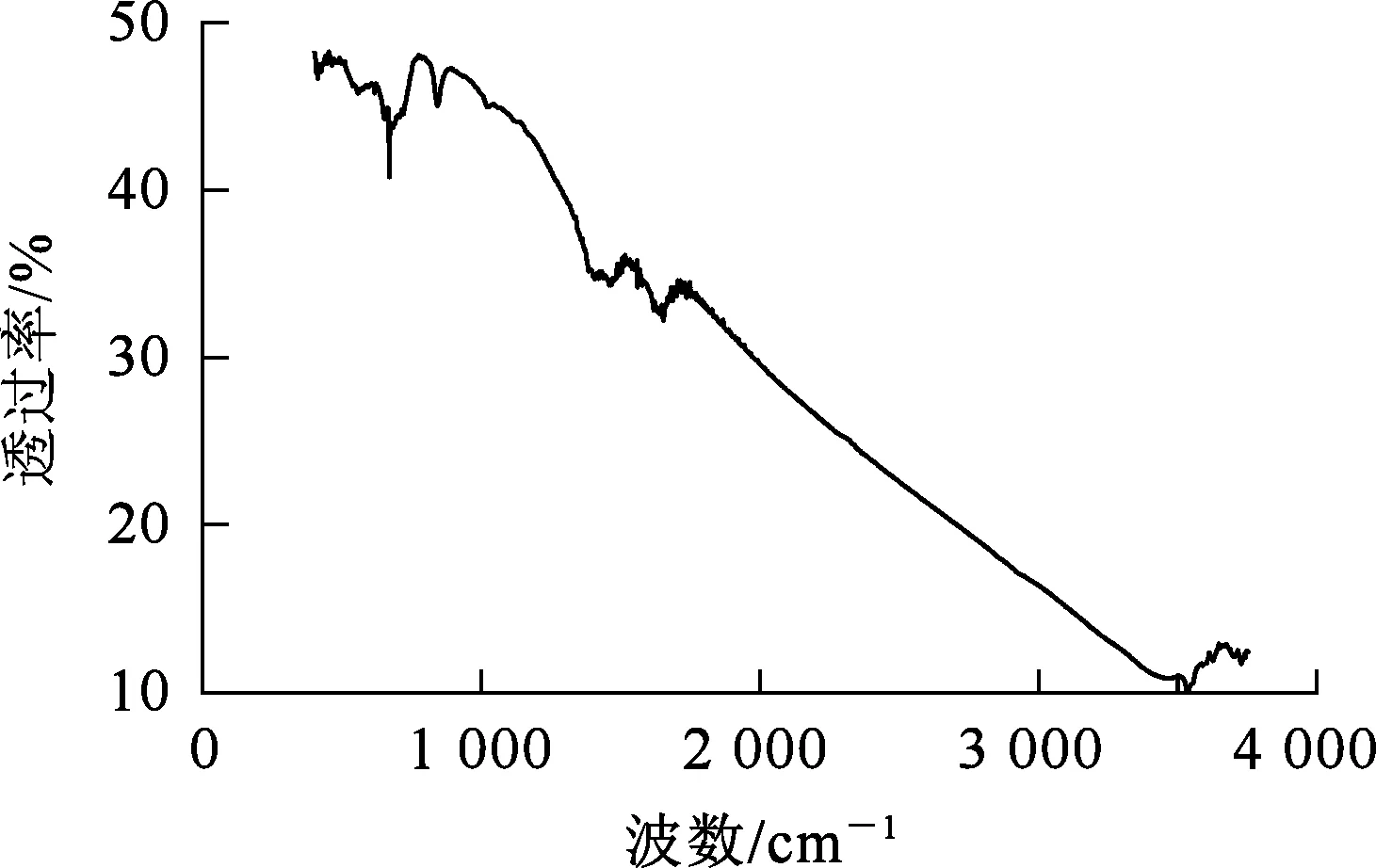
圖2 鐵錳氧化物復合吸附劑的FT-IR分析結果
2.1.3 XRD表征
圖3為鐵錳氧化物復合吸附劑的XRD分析結果。標準物質Mn3O4的特征峰(JCPSD 13-0162)在2θ分別為18.24°、29.96°、35.3°、43.0°、53.3°、56.78°、62.3°處出現衍射峰,分別對應(111)、(220)、(331)、(400)、(422)、(511)和(440)晶面;標準物質Fe3O4(JCPSD 65-3107)的特征峰在2θ分別為18.3°、30.1°、35.5°、37.08°、43.1°、53.5°、57.0°、62.6°分別對應(111)、(220)、(311)、(222)、(400)、(422)、(511)和(440)晶面。

圖3 鐵錳氧化物復合吸附劑的XRD分析結果
所制備的鐵錳氧化物復合吸附劑的XRD圖譜與Mn3O4、Fe3O4的標準卡片圖譜對比可知,二者衍射峰出現位置(2θ為35.3°)基本吻合,推斷所制備材料基本成分為Mn3O4和Fe3O4,但峰出現位置略有偏移,可能是所制備材料晶相成分互相干擾且有其他錳、鐵氧化物雜質所致。
2.2 復合吸附劑對金屬離子的吸附
2.2.1 溫度對金屬離子吸附量的影響
溶液中金屬離子質量濃度均為100 mg/L,溫度對復合吸附劑吸附不同溶液中金屬離子的影響試驗結果如圖4所示。
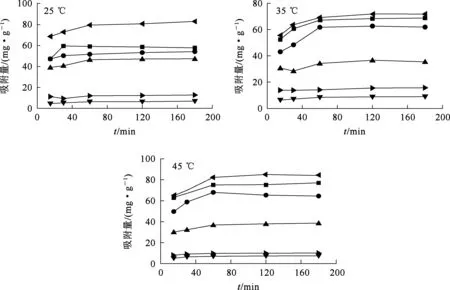
—?—Cu2+;—■—Cd2+;—●—mixCu2+;—▲—Zn2+;—?—mixCd2+;—▼—mixZn2+。圖4 溫度對復合吸附劑吸附不同溶液中金屬離子的影響
由圖4看出:吸附反應在吸附1 h后基本達到平衡;溫度對吸附劑吸附單一和混合溶液中各金屬離子的影響并無明顯規律;不同溫度下,吸附劑對金屬離子的吸附量大致排序為qe(Cu2+)>qe(Cd2+)>qe(mixCu2+)>qe(Zn2+)>qe(mixCd2+)>qe(mixZn2+);吸附劑對單一溶液中Cd2+和Cu2+的吸附量較為相近,對Zn2+的吸附量較低;而對混合溶液中Cu2+的吸附量較高,遠高于對Cd2+和Zn2+的吸附量,說明Cu2+的存在對吸附Cd2+、Zn2+有抑制作用。復合吸附劑對單一溶液中金屬離子的吸附量均高于對混合溶液中金屬離子的吸附量,對Cu2+的吸附效果較好。
2.2.2 金屬離子初始質量濃度對吸附量的影響
在25 ℃下,用0.1000 g復合吸附劑從溶液中吸附金屬離子,金屬離子質量濃度對吸附量的影響試驗結果如圖5所示。可以看出:復合吸附劑對溶液中金屬離子吸附量隨離子質量濃度變化不明顯;但相同質量濃度下,吸附劑對金屬離子的吸附量大致排序為qe(Cu2+)>qe(Cd2+)>qe(mixCu2+)>qe(Zn2+)>qe(mixCd2+)>qe(mixZn2+);復合吸附劑對單一溶液中金屬離子的吸附量較高且較為接近,對混合溶液中的Cu2+有選擇性吸附,說明Cu2+的存在對Cd2+、Zn2+的吸附有較大抑制作用。
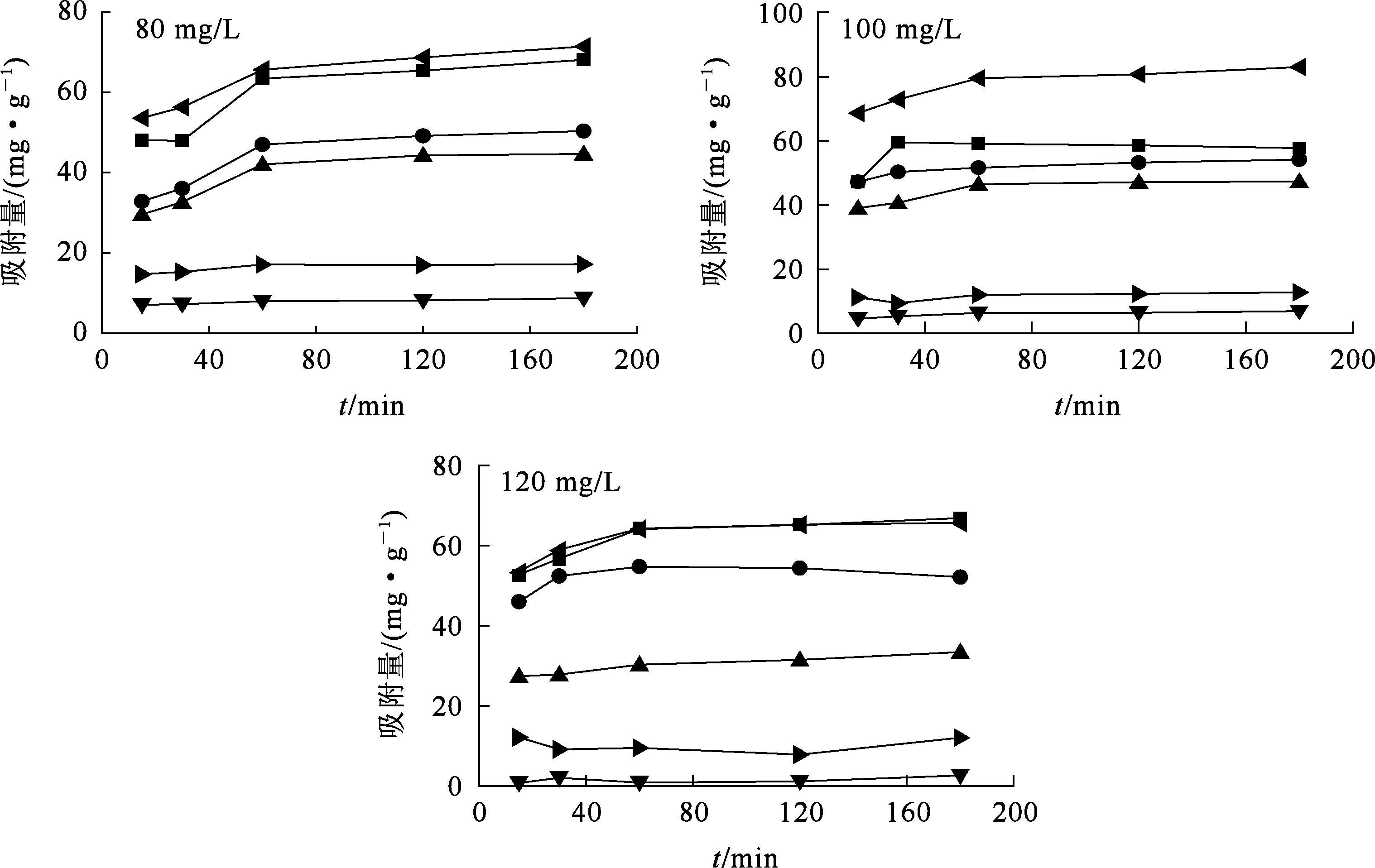
—?—Cu2+;—■—Cd2+;—●—mixCu2+;—▲—Zn2+;—?—mixCd2+;—▼—mixZn2+。圖5 金屬離子初始質量濃度對復合吸附劑吸附金屬離子的影響
2.3 等溫吸附方程
采用Langmuir方程(見式(2))和Freundlich方程(見式(3))擬合不同溫度下鐵錳氧化物復合吸附劑對3種金屬離子的吸附等溫線。
(2)
(3)
式中:qm—飽和吸附量,mg/g;qe—平衡吸附量,mg/g;ρe—吸附平衡時溶液金屬離子的質量濃度,mg/L;b—Langmuir吸附常數,L/mg;kF—Freundlich吸附常數;n—Freundlich吸附強度系數。
等溫吸附模型擬合結果見表1。可以看出:Langmuir等溫模型的相關系數高于Freundlich等溫模型的相關系數;根據Langmuir等溫模型計算出的最大吸附量與試驗所得的吸附量相一致。表明鐵錳氧化物復合吸附劑對3種金屬離子的吸附不僅存在單分子層吸附,還存在多分子層吸附,但以單分子層吸附為主[21]。
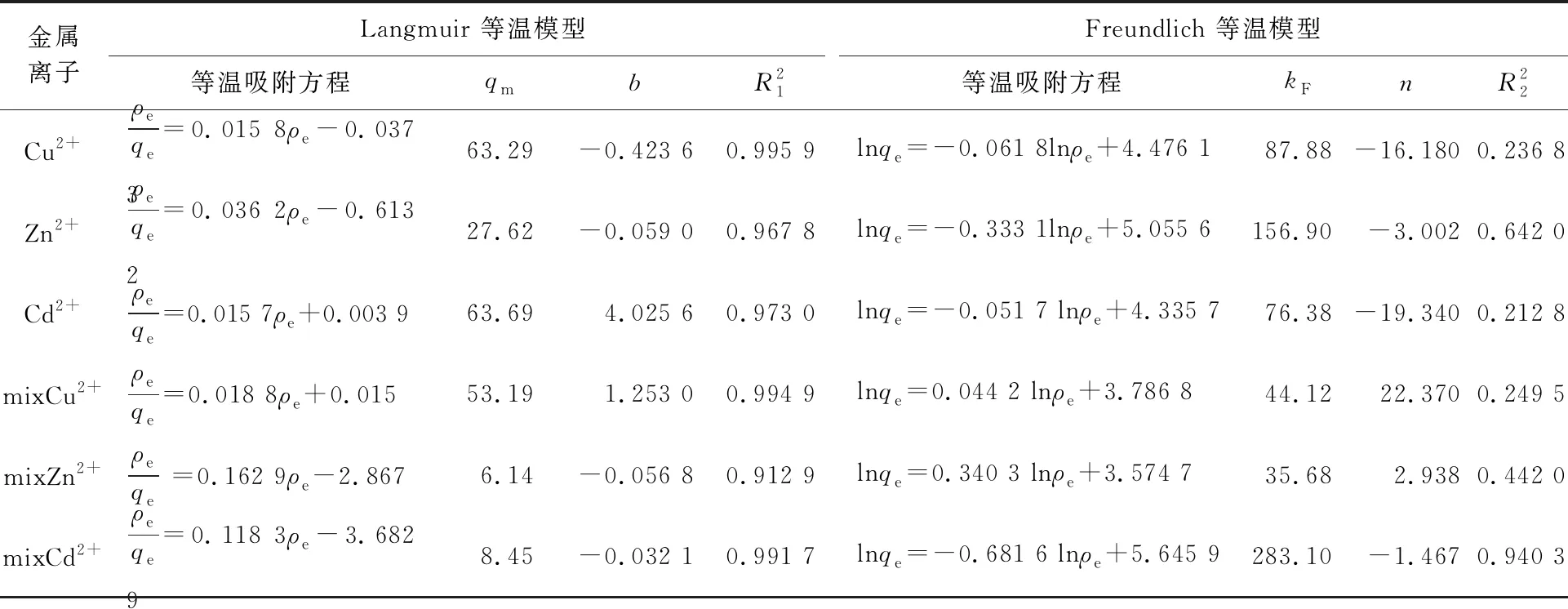
表1 等溫吸附模型的擬合結果
2.4 吸附動力學
通過吸附動力學模型對數據進行擬合,可以判斷復合吸附劑對金屬離子的吸附速度,推理吸附機制。用以下2種動力學模型對溫度35 ℃、金屬離子質量濃度100 mg/L條件下的試驗數據進行擬合,試驗結果見表2。
準一級動力學方程為
ln(qe-qt)=lnqe-k1t;
(4)
準二級動力學方程為
(5)
式中:qt—吸附時間t時吸附量,mg/g;qe—吸附平衡時吸附量,mg/g;k1—準一級擴散系數;k2—準二級擴散系數;t—吸附時間,min。
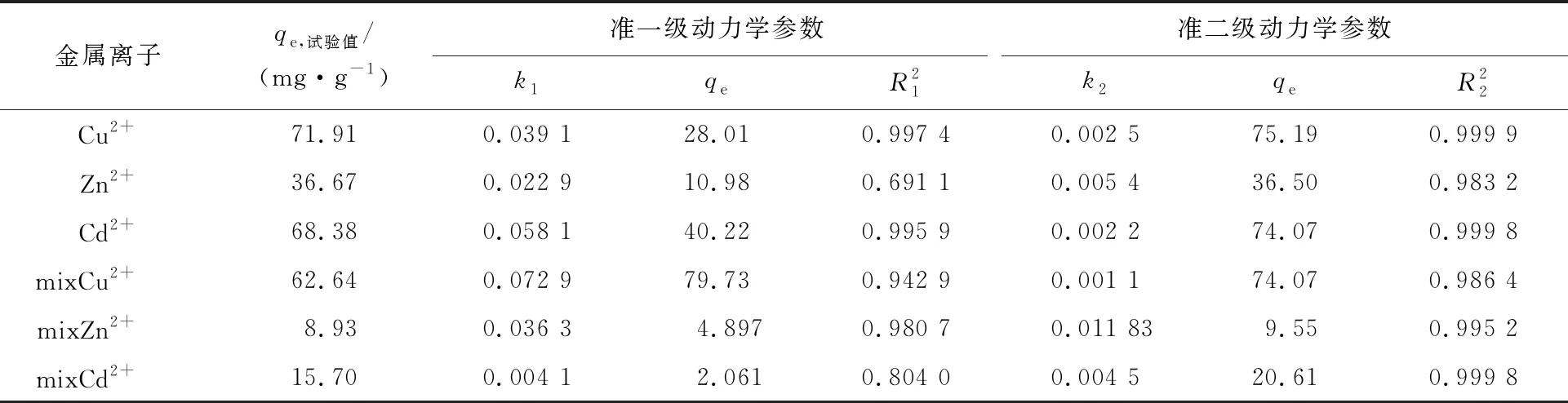
表2 動力學方程擬合結果
由表2看出:吸附動力學模型相關系數均有一定相關性;準二級動力學方程擬合結果更佳,其線性相關系數接近1,且qe也與試驗值接近。表明復合吸附劑對這3種金屬離子的吸附過程較為符合準二級動力學模型,吸附過程中既有物理吸附又有化學吸附,但以化學吸附為主[22-23]。
3 結論
以FeSO4、KBH4和KMnO4為原料,在模擬真空水浴環境下,通過氧化還原法制備了鐵錳氧化物復合吸附劑。SEM、FT-IR和XRD表征結果表明,復合吸附劑為串珠狀結構,主要成分為Fe3O4和Mn3O4;對金屬離子的吸附量排序為qe(Cu2+)>qe(Cd2+)>qe(mixCu2+)>qe(Zn2+)>qe(mixCd2+)>qe(mixZn2+),單一溶液中對Cu2+和Cd2+的吸附量較接近,且前者略大于后者,對Zn2+的吸附量較低;混合溶液中,對Cu2+的吸附較優;Cu2+的存在對Cd2+和Zn2+的吸附有抑制作用,且兩者吸附量較一致。鐵錳氧化物復合吸附劑吸附Cu2+、Zn2+、Cd2+的行為更符合Langmuir等溫吸附模型,以單分子層吸附為主;其吸附過程更符合準二級動力學模型,吸附機制為化學吸附控制反應步驟。

