自發性肥胖癥雌性ob/ob小鼠糖脂代謝和卵泡超微結構的研究
張巧利,劉英,賈嬋維,劉艷君,卜曉萌,王樹玉
(首都醫科大學附屬北京婦產醫院生殖醫學科,北京 100026)
相關數據顯示,截止2014年,全球有超過6億成年人肥胖,其中女性占15%,是1980年數據的2倍多[1]。英國政府數據顯示,1993至2012年女性重度肥胖的發病率由15%升至25%[2];一項世界性調查發現我國女性肥胖的發病率為10%[3],肥胖在育齡女性中越來越普遍。眾所周知,肥胖會影響女性的月經和排卵[4],可引起胰島素抵抗,導致復發性流產等不良妊娠結局[5],因此肥胖對女性生殖健康的影響是目前研究的熱點。
肥胖和各種不健康的生活方式有直接關系,研究表明肥胖也可以多基因遺傳,內生的DNA變異使得一些人群易感肥胖[6]。肥胖自發突變的純合子小鼠(Lepob,通常為ob/ob)為自發性肥胖,背景為C57BL/6J,因瘦素(leptin)基因點突變導致leptin信號通路發生障礙,是自發性肥胖癥動物模型。ob/ob小鼠出生大約4周時可看到表型,純合子突變小鼠表現為體重迅速增加,可達野生型對照鼠正常體重的3倍。突變鼠除了肥胖以外還表現出攝食過量、糖尿病樣高血糖綜合征、生殖力降低,以及垂體和腎上腺激素水平升高。本文以ob/ob小鼠為研究對象,觀察其糖和脂代謝,探索卵泡超微結構變化,以揭示人群中具有同樣基因異常問題的自發性肥胖癥女性的卵泡發育狀況,為這類人群的生殖健康研究提供實驗室依據。
材料與方法
一、實驗動物與試劑
1.實驗動物:15只4周齡雌性C57BL/6J小鼠(批號:XAJT2013-035)由西安交通大學動物實驗中心提供,體重9.6~17.0 g;15只4周齡雌性ob/ob小鼠(批號:BCM059F2013-052)購自北京百奧賽圖公司,體重20.5~30.5 g。小鼠飼料購自北京科澳協力飼料有限公司。所有小鼠于SPF清潔級環境普通飼料飼養120 d,5只/籠,飼養環境為恒溫20~25℃,相對濕度60%,12 h明暗周期,所有小鼠均自由進食和飲水,定期更換墊料,每隔2周用電子秤清晨9時測小鼠體重。動物實驗獲得西安交通大學醫學院倫理委員會批準。
2.試劑與儀器:小鼠血清胰島素(Insulin,INS)、雌二醇(E2)和睪酮(T)ELISA檢測試劑盒購自美國ALPCO公司;四氧化鋨購自英國Johnson Matthey Chemicals公司;環氧樹脂購自美國SPI Supplies Division of Structure Probe公司;醋酸雙氧鈾購自加拿大Ted Pella公司;血脂檢測試劑盒(甘油三酯、總膽固醇、高密度脂蛋白膽固醇、低密度脂蛋白膽固醇)購自上海盈公生物技術有限公司;血糖試紙購自上海強生制藥有限公司;毛細玻璃管購自北京優尼康生物科技有限公司;其他試劑均為國產分析純。
LKB-Ⅴ型超薄切片機購自瑞典LKB公司;JEM-100SX透射式電子顯微鏡購自日本電子公司;IX70倒置顯微鏡和SZX9解剖鏡購自日本Olympus公司;自動染色機、樣品處理機購自德國Leica公司;多功能酶標儀購自瑞士Tecan公司;臺式低溫高速離心機購自美國Thermo公司;MDF-382E超低溫冰箱購自日本SANYO公司;強生血糖測試儀購自上海強生制藥有限公司。
二、小鼠標本的獲取
兩組小鼠喂食100 d時進行葡萄糖耐受試驗(GTT),5 d后進行胰島素釋放試驗(ITT)。兩組小鼠喂食120 d時,禁食12 h,早晨先用血糖測試儀測空腹血糖(FBG),之后采用苯巴比妥腹腔注射麻醉小鼠,摘眼球取血獲得血樣,室溫靜置2 h,以3 000 r/min離心15 min,分離血清,-80℃冰箱凍存,后期進行INS、血脂和性激素(E2和T)檢測。
小鼠摘眼球取血完畢,打開腹腔摘取雙側卵巢,剝離卵巢周圍的脂肪組織,稱量并記錄。
三、小鼠糖代謝指標檢測
1.葡萄糖耐受試驗:對C57BL/6J小鼠和ob/ob小鼠進行GTT,小鼠禁食過夜(16 h),按照2 g/kg體重的量腹腔注射葡萄糖,測0、30、60、90、120 min時的血糖。
2.胰島素耐受試驗:GTT試驗5 d之后進行ITT,小鼠禁食4 h,按照0.75 U/kg體重的量腹腔注射胰島素,測0、30、60、90、120 min時的血糖。
3.小鼠空腹血糖檢測:兩組小鼠喂食120 d于處死當天,禁食12 h,清晨使用血糖試紙收集小鼠剪尾后的血液進行FBG檢測,在血糖測試儀上讀數并記錄。
4.小鼠胰島素水平檢測:按照小鼠胰島素ELISA檢測試劑盒說明書測定各組小鼠血清INS水平,并計算胰島素抵抗指數(HOMA-IR)=空腹胰島素×空腹血糖/22.5。
四、小鼠血脂水平檢測
采用酶法進行總膽固醇(TC)和甘油三酯(TG)測定,采用磷鎢酸-鎂沉淀法進行高密度脂蛋白膽固醇(HDL-C)檢測,采用聚乙烯硫酸沉淀法檢測低密度脂蛋白膽固醇(LDL-C)水平,以上指標檢測的操作步驟均按試劑盒說明書進行。
五、性激素水平檢測
運用ELISA法檢測兩組小鼠血清標本E2和T水平。
六、小鼠卵巢組織透射電鏡觀察
將小鼠卵巢組織切成1 mm3的小塊,置于2.5%的戊二醛固定液中4℃固定2 h以上(固定液內含有0.1 mol/L磷酸緩沖液、4%多聚甲醛);0.1 mol/L磷酸緩沖液浸洗30 min,1%四氧化鋨固定液4℃后固定2 h(固定液內含有0.1 mol/L磷酸緩沖液),0.1 mol/L磷酸緩沖液浸洗10 min,乙醇梯度脫水(30%乙醇10 min,50%乙醇10 min,70%乙醇10 min),70%乙醇醋酸雙氧鈾塊染2 h或過夜;90%乙醇10 min×2次,100%乙醇10 min×3次,還氧丙烷置換10 min;環氧樹脂Epon812浸透、包埋,聚合后作半超薄切片1~2 μm,美蘭染色后光學顯微鏡下定位;超薄切片機進行超薄切片50~70 nm,醋酸鈾、檸檬酸鉛染色;透射式電子顯微鏡下觀察、拍照。
七、統計學分析

結 果
一、體重曲線變化
兩組小鼠正常喂食120 d,體重曲線變化見圖1。ob/ob組小鼠出生4周時體重顯著高于對照組C57BL/6J小鼠(P<0.01)。此后直至喂食結束,ob/ob組小鼠體重每次測量均較對照組小鼠重,差異有統計學意義(P<0.001)。
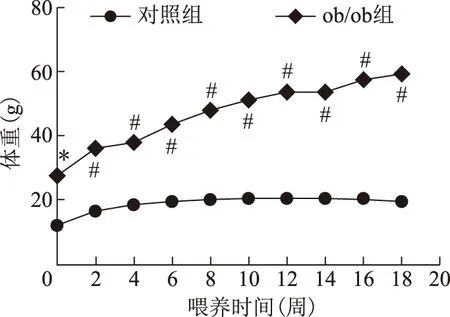
與對照組比較,*P<0.01,#P<0.001圖1 兩組小鼠體重曲線變化
二、糖代謝指標比較
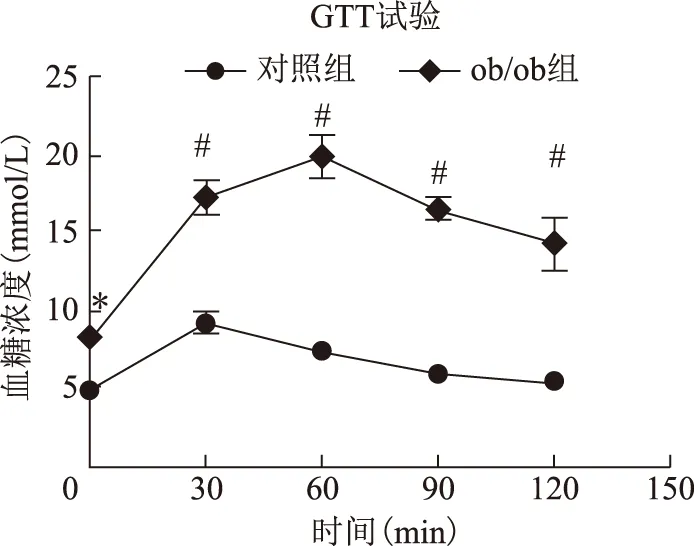
喂食120 d后,ob/ob小鼠的FBG、INS以及HOMA-IR均較對照組小鼠顯著升高(P<0.05)(表1)。GTT和ITT試驗顯示,ob/ob小鼠血糖濃度分別在檢測時間點0、30、60、90和120 min時均較對照組C57BL/6J小鼠顯著升高(P<0.01),而且GTT和ITT的AUC也均較對照組小鼠顯著升高(P<0.001)(圖2~5)。
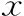
表1 兩組小鼠糖代謝指標的比較(-±s)
三、血脂水平比較
喂食結束后,ob/ob小鼠的血脂水平(TG、TC、HDL-C和LDL-C)均較正常對照組小鼠顯著升高(P<0.05)(表2)。
與對照組比較,*P<0.01,#P<0.001圖2 兩組小鼠GTT曲線圖
與對照組比較,*P<0.01,#P<0.001圖3 兩組小鼠ITT曲線圖
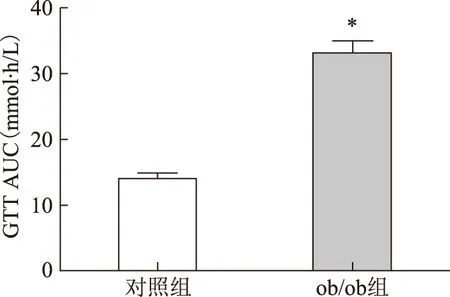
與對照組比較,*P<0.001圖4 兩組小鼠葡萄糖耐受試驗AUC
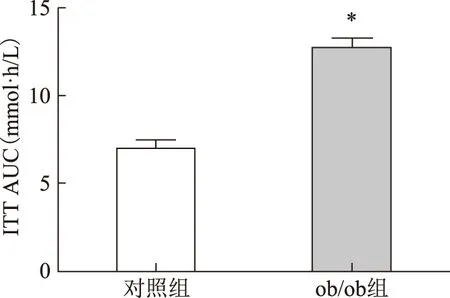
與對照組比較,*P<0.001圖5 兩組小鼠胰島素釋放試驗AUC
表2 兩組小鼠血脂水平的比較(-±s)
四、性激素和性腺脂肪的變化
與對照組C57BL/6J小鼠相比,ob/ob組小鼠血清T水平下降(P<0.05),但E2水平無顯著變化(表3);ob/ob組小鼠卵巢周圍脂肪組織(性腺脂肪)重量及其占體重的比列顯著高于對照組(P<0.001)(圖6、7)。
表3 兩組小鼠性激素水平的比較(-±s)
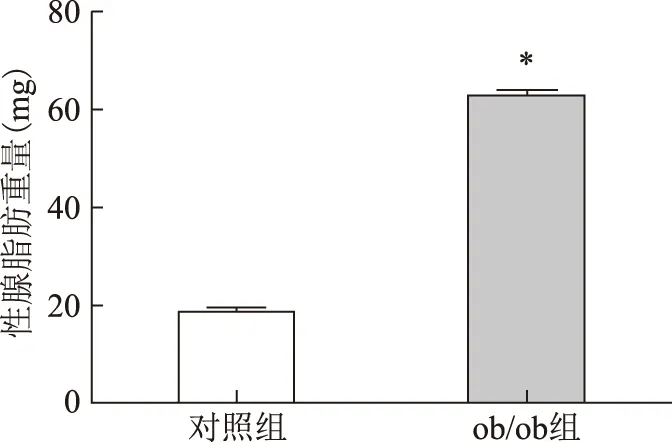
與對照組比較,*P<0.001圖6 兩組小鼠性腺脂肪重量的比較
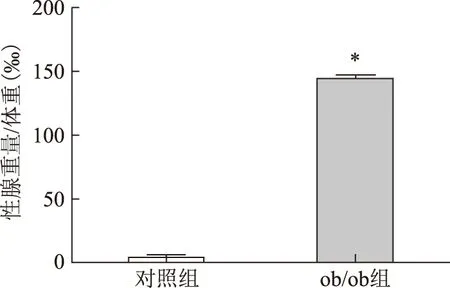
與對照組比較,*P<0.001圖7 兩組小鼠性腺脂肪重量/體重的比較
五、小鼠卵泡超微結構改變
對照組C57BL/6J小鼠卵泡超微結構表現:電鏡下見到原始卵泡的卵母細胞核內染色質分布均勻,核仁可見,其周圍可見單層扁平的卵泡細胞。初級卵泡及次級卵泡中的卵母細胞體積較大,細胞核較小,形狀不規則(圖A,10 000×),核內常染色質豐富,核膜上的核孔清晰可見(圖B,30 000×)。卵母細胞質內核糖體豐富(圖C,30 000×),滑面內質網呈板層或環形排列,線粒體呈圓形,細胞質內還可見到粗面內質網、高爾基復合體(圖D,30 000×)及皮質顆粒;卵母細胞周圍的顆粒細胞由單層變為多層,其間可見卵母細胞的微絨毛及顆粒細胞的突起(圖E,30 000×)。卵母細胞和顆粒細胞,結構完整,透明帶電子密度均勻(圖F,3 000×)。
相較于對照組C57BL/6J小鼠,ob/ob小鼠原始卵泡中卵母細胞質內線粒體腫脹(圖G,30 000×);初級卵泡及次級卵泡中的卵母細胞核形狀不規則,核內染色質疏松,核仁可見(圖H,3 000×);細胞質內細胞器不多,線粒體內灶狀溶解且多呈高電子密度(圖I,4 000×)。透明帶電子密度和厚度不均勻,部分透明帶溶解缺失,連續性中斷(圖J,10 000×);卵母細胞周圍的顆粒細胞排列紊亂,細胞多呈凋亡樣改變(圖K,4 000×);顆粒細胞穿過透明帶與卵母細胞靠近接觸,透明帶內顆粒細胞的突起消失(圖L,4 000×)。
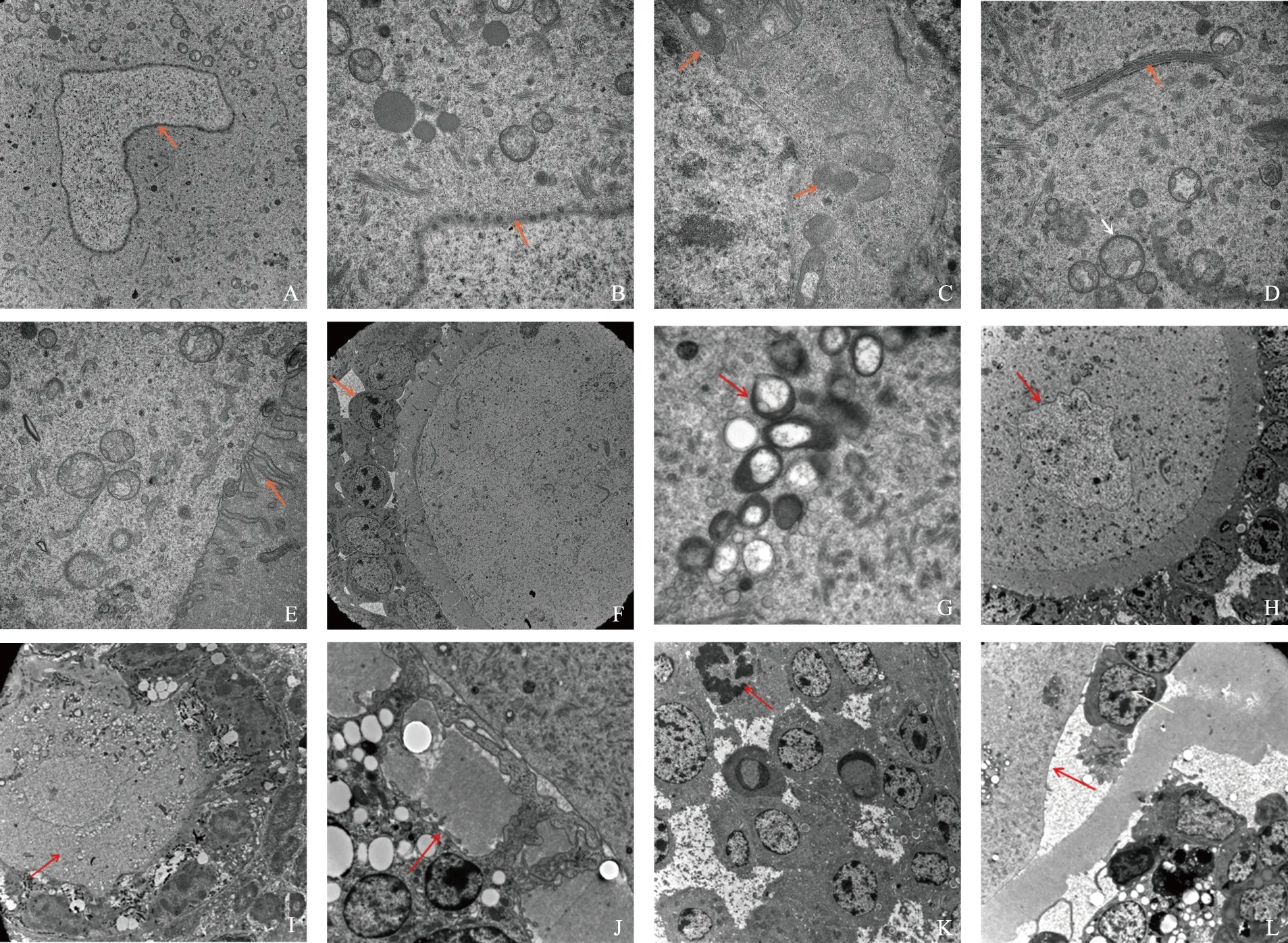
A~F為對照組小鼠;G~L為ob/ob小鼠。A:初級卵泡的卵母細胞核(箭頭所示)可呈不規則形;B:卵母細胞的核膜可見清晰的核孔(箭頭所示);C:卵母細胞核糖體發達(箭頭所示),形態和數目正常;D:卵母細胞質內的高爾基體(紅色箭頭所示)形態規整,可見囊泡(白色箭頭所示);E:卵母細胞外圍有豐富的微絨毛(箭頭所示)伸入至透明帶;F:顆粒細胞(箭頭所示)形態規整,透明帶厚度和電子密度均勻;G:原始卵泡中卵母細胞質內線粒體腫脹(箭頭所示);H:卵母細胞核形狀不規則,核內染色質疏松(箭頭所示);I:線粒體內灶狀溶解且多呈高電子密度(箭頭所示);J:部分透明帶溶解缺失,連續性中斷(箭頭所示);K:顆粒細胞排列紊亂,細胞多呈凋亡樣改變(箭頭所示);L:透明帶厚度不均勻,顆粒細胞穿過透明帶與卵母細胞靠近接觸(紅色箭頭所示),透明帶內顆粒細胞突起消失(白色箭頭所示)圖8 兩組小鼠卵泡超微結構圖像
討 論
近20年來,我國超重或肥胖的人群患病率逐年增多,呈流行態勢。中國健康營養調查數據顯示[7],從1993年到2009年的17年間,成人超重/肥胖的患病率從13.4% 增長至 26.4%,總體呈線性增長,自發性肥胖癥的群體也越來越被關注。近30年來育齡女性超重和肥胖的患病率也呈顯著上升趨勢,肥胖除了影響女性月經外,還影響排卵、卵母細胞質量,胚胎發育以及子宮內膜容受性[8]。現有證據表明肥胖對下丘腦-垂體-卵巢軸和卵泡發育的影響程度與體重正相關[9]。研究認為胰島素抵抗和氧化應激炎癥是常見的影響介質[10]。
本研究顯示自發性肥胖癥ob/ob小鼠4周時體重便較對照組小鼠明顯重,而且隨著喂養時間延長,體重超重程度更為顯著。盡管喂食正常飼料,喂食120 d時ob/ob小鼠糖代謝主要指標顯著異常,出現空腹血糖升高、胰島素抵抗,甚至發生糖尿病;同時主要血脂代謝指標也發生顯著異常,ob/ob小鼠表現為代謝綜合征(metabolic syndrome,MS)[11]。
理論上肥胖女性的高胰島素血癥和胰島素抵抗會降低肝臟產生性激素結合球蛋白,導致循環中游離雄激素水平升高,阻礙卵泡的募集和排卵[12]。由于ob/ob小鼠糖脂代謝嚴重紊亂;卵巢超微結構發生顯著異常改變;ob/ob小鼠卵巢周圍的脂肪組織顯著超標,脂肪組織可以分泌多種炎癥因子[13],以上因素嚴重損害了ob/ob小鼠卵巢功能,可能阻礙了卵巢T的合成。
卵泡的生長與成熟是通過FSH和 LH作用于顆粒細胞和卵泡膜間質細胞,并通過自分泌、旁分泌和胞內分泌及一系列信息傳遞和調節機制完成[14]。顆粒細胞與卵母細胞之間或顆粒細胞之間有許多縫隙連接,形成完整的功能聯合體,顆粒細胞的突起和卵母細胞的微絨毛可深入透明帶發生接觸,有利于顆粒細胞將營養物質輸送給卵母細胞以及細胞間離子、激素和小分子物質的交換,溝通信息,協調功能,從而調節卵母細胞的生長和發育。當受不良環境影響或相關基因發生異常時,卵母細胞及顆粒細胞的細胞器、數量、分布、結構、功能等均將發生相應改變。早些年學者已證實卵泡閉鎖與顆粒細胞凋亡過度密切相關[15]。本研究結果提示,ob/ob小鼠卵母細胞形態欠規則,細胞器出現損傷(線粒體為主),顆粒細胞出現凋亡,部分卵母細胞核染色質排列紊亂;透明帶形態或厚度異常;卵母細胞微絨毛明顯減少。這些超微結構的改變使卵泡不能維持正常的形態結構和功能,最終影響機體的生殖健康。加之ob/ob小鼠存在嚴重的糖和脂代謝障礙,更加重了對生殖健康的負性影響。
自發性肥胖癥ob/ob小鼠自幼體重超重,隨著繼續生長出現糖和脂代謝嚴重紊亂,出現代謝綜合征,電子顯微鏡下觀察到卵泡超微結構發生明顯的病理損傷性改變,提示自發性肥胖癥雌性個體存在嚴重的生殖健康問題。目前隨著人類疾病譜的復雜化和生存環境的惡化,人群中這種由于基因缺失或突變的自發性肥胖癥女性將會逐漸增多。本研究以小鼠模型為代表,對其代謝特征和卵泡超微結果進行初探,欲揭示這種基因異常對生殖健康的影響機制,期望伴隨著醫學科技的發展,能夠開發出有效的干預方法,改善這個群體的生殖健康。

