發酵香腸源抗氧化肽的穩定性
欒曉旭,馮美琴,孫 健,*
(1. 南京農業大學食品科技學院,國家肉品質量安全控制工程技術研究中心,江蘇 南京 210095;2.金陵科技學院動物科學與技術學院,江蘇 南京 210038)
近年來,隨著合成抗氧化劑的逐漸淘汰,具有抗氧化活性的天然物質被廣泛應用于抑制肉制品的氧化酸敗[1-4]。據報道,從肉制品中獲得的肽具有良好的抗氧化活性[5-7],為發酵香腸通過內源性抗氧化肽抑制自身氧化進程、延長保質期提供了可能。這一猜想在諸多學者的研究中得到證實[8-11]。并且,抗氧化肽具有安全性高、易吸收、活性強等優點,但作為蛋白質的降解產物,抗氧化肽的穩定性較弱,活性容易受環境因素影響。
抗氧化肽在生產加工、貯藏期間不可避免地會發生水解、氧化、脫酰胺、環化等生化反應,破壞肽鏈結構,從而導致其活性降低甚至完全喪失[12-13]。另外,消化道中的蛋白酶會一定程度上降解抗氧化肽,生成更低分子質量的短肽和游離氨基酸,影響其穩定性。姚軼俊等[14]分析了菜籽抗氧化肽WDHHAPQLR的穩定性,發現高溫、強酸強堿、NaCl、蔗糖等不利于多肽活性的保持,苯甲酸鈉和山梨酸鉀對其穩定性影響不明顯。劉晶晶等[15]認為溫度、食鹽、蔗糖對河蜆抗氧化肽的羥自由基清除活性影響不大。據鄭志強等[16]報道,小麥抗氧化肽的穩定性與溫度、pH值、食品原輔料、金屬離子和模擬胃腸道消化密切相關。另外,多肽的氨基酸組成多樣、排列方式千變萬化,多肽的結構和活性各異,對各影響因素的響應程度也有所不同。唐寧等[17]研究發現玉米抗氧化肽Leu-Pro-Phe的抗氧化活性隨NaCl和糖類添加量的增加顯著增強,與葡萄糖相比,Leu-Pro-Phe對蔗糖更為敏感。Liu Dongmei等[18]則發現高NaCl濃度會導致鴨肉源抗氧化肽部分析出,肽活性降低。胡小軍等[19]認為葡萄糖可與肽發生美拉德反應,生成的還原性產物可增強肽液的抗氧化活性,因此葡萄糖的增效作用比蔗糖更強。
本實驗從接種植物乳桿菌CD101的發酵香腸中提取到了具有較強抗氧化活性的粗肽粉,但其穩定性尚不明確,生產和應用受到一定限制。因此,本實驗以體外1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性、Fe2+螯合活性和2,2’-聯氮雙(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)總抗氧化能力為指標,探究溫度、pH值、食品配料、金屬離子和模擬胃腸道酶系對發酵香抗氧化肽穩定性的影響,旨在為發酵香腸抗氧化肽作為功能性抗氧化劑的生產、貯藏和應用提供一定的理論和實驗依據。
1 材料與方法
1.1 材料與試劑
發酵香腸為實驗室自制;胃蛋白酶、胰蛋白酶、DPPH(分析純)、1-苯胺基萘-8-磺酸(1-aniline naphthalene-8-sulfonic acid,ANS)(分析純) 美國Sigma公司;ABTS總抗氧化能力檢測試劑盒 上海碧云天生物技術有限公司;菲啰嗪、NaNO2(分析純)上海阿拉丁生化科技股份有限公司;磷酸鹽緩沖液(phosphate buffered saline,PBS)、氯化亞鐵、蔗糖、葡萄糖、NaCl(均為分析純) 國藥集團化學試劑有限公司。
1.2 儀器與設備
Ultra Turrax T25高速勻漿機 德國IKA公司;RE-52AA旋轉蒸發儀 上海亞榮生化儀器廠;ES2030冷凍干燥機、L-8900A氨基酸自動分析儀 日本Hitachi公司;Spectral Max M2e多功能酶標儀 美國伯騰儀器有限公司。
1.3 方法
1.3.1 發酵香腸源抗氧化肽的制備[20]
發酵香腸→去腸衣、肥肉、筋膜→絞成肉糜→冰浴勻漿(0.1 mol/L pH 7.2 PBS;15 000 r/min,4×15 s)→靜置2 h→12 000 r/min離心20 min→取上清液,紗布過濾→加入3 倍體積40%乙醇溶液→靜置過夜→12 000 r/min離心20 min→取上清液,抽濾→旋轉蒸發→冷凍干燥→發酵香腸抗氧化肽。
1.3.2 DPPH自由基清除活性測定
參考Najafian等[21]方法,測定粗肽液的DPPH自由基清除率。
1.3.3 螯合Fe2+能力的測定
根據Yu Di等[22]的方法,測定粗肽液螯合Fe2+能力。
1.3.4 ABTS總抗氧化能力測定
參照Mejri等[23]的方法,使用ABTS總抗氧化能力檢測試劑盒進行測定。
1.3.5 疏水性測定[24]
用超純水配制粗肽液,梯度稀釋,采用ANS熒光探針法測定熒光強度。以粗肽液濃度為橫坐標、熒光強度為縱坐標作圖,直線斜率即為粗肽液的表面疏水性指數H0。
1.3.6 游離氨基酸含量測定
將肽液與10%的磺基水楊酸溶液按4∶1混合,2~8 ℃靜置1 h,1 000 r/min離心15 min,取上清液,經0.45 μm的尼龍濾膜過濾,取20 μL,用自動氨基酸分析儀測定。
1.3.7 發酵香腸肽體外抗氧化能力的穩定性分析
1.3.7.1 溫度對發酵香腸抗氧化肽活性的影響
配制質量濃度為1 mg/mL的發酵香腸抗氧化肽溶液,分別在25(室溫)、40、60、80、100 ℃水浴中保溫2 h,保溫完成后急速冷卻,測定DPPH自由基清除率、Fe2+螯合率和總抗氧化能力。
1.3.7.2 pH值對發酵香腸抗氧化肽活性的影響
配制質量濃度為1 mg/mL的粗肽液,用1 mol/L鹽酸和氫氧化鈉調整溶液pH值分別為3.0、5.0、7.0、9.0、11.0,室溫振蕩反應2 h,結束后調節樣品的pH值為7.0,測定DPPH自由基清除率、Fe2+螯合率和總抗氧化能力。
1.3.7.3 食品原料對發酵香腸抗氧化肽活性的影響
配制質量濃度為1 mg/mL的粗肽液,分別添加質量分數2%、4%、6%、8%、10%的蔗糖、葡萄糖和氯化鈉,室溫振蕩2 h后,測定DPPH自由基清除率、Fe2+螯合率和總抗氧化能力。
1.3.7.4 金屬離子對發酵香腸抗氧化肽活性的影響
配制質量濃度為1 mg/mL的粗肽液,分別添加50、100、150、200、250 μg/mL的CuCl2和KCl,室溫振蕩反應2 h,測定DPPH自由基清除率、Fe2+螯合率和總抗氧化能力。
1.3.7.5 NaNO2對發酵香腸抗氧化肽活性的影響
配制質量濃度為1 mg/mL的粗肽液,分別添加質量分數0.005%、0.010%、0.015%、0.020%、0.025%的NaNO2,室溫振蕩反應2 h后,測定DPPH自由基清除率、Fe2+螯合率和總抗氧化能力。
1.3.7.6 體外模擬胃腸道消化對發酵香腸抗氧化肽活性的影響
3.1.1 醫學圖書館管理人員的軟實力要提高。醫學院校圖書館管理人員在一定程度上存在差異,包括知識水平的不同,相關專業不一,所以對圖書資料專業知識了解不足,計算機信息技術,英語水平普遍底,導致醫學圖書館管理素質參差不齊。圖書館學家阮岡納贊說過:“不管圖書館坐落在什么地方,開館時間和設備怎樣,也不管管理圖書館的方法怎樣,一個圖書館成敗的關鍵還是在于圖書館工作者”[19]。因此,醫學圖書館的發展與館員的素質密切相關。大數據時代醫學圖書館如何應對面臨的挑戰,如何更好的開展圖書館的工作,就要不斷學習圖書館相關知識,和醫學相關知識。具備卓越的洞察力,有對信息組織和檢索能力。
配制1 mg/mL的粗肽液,用1 mol/L鹽酸調節粗肽液pH值至2.0,加入質量分數4%的胃蛋白酶,在37 ℃消化2 h,每30 min取一次樣,消化完成后分成兩部分,一部分沸水浴15 min終止反應,為胃蛋白酶消化樣品。剩余部分繼續反應,用0.9 mol/L碳酸氫鈉溶液調節粗肽液pH值至5.3,再用1 mol/L氫氧化鈉溶液調節粗肽液pH值至7.5,加入質量分數4%的胰蛋白酶,在37 ℃環境中孵育2 h,每30 min取一次樣,反應完成后沸水浴15 min,為胰蛋白酶消化樣品。分別測定消化前、胃蛋白酶酶解、胰蛋白酶酶解后的粗肽液的表面疏水性、游離氨基酸含量和抗氧化活性。
1.4 數據分析
2 結果與分析
2.1 溫度對發酵香腸抗氧化肽活性的影響
如圖1所示,粗肽液的DPPH自由基清除率與溫度呈負相關。與室溫相比,60 ℃孵育2 h,DPPH自由基清除率下降約16%。當溫度繼續升高,DPPH自由基清除率急劇下降(P<0.05),100 ℃時活性僅為16.87%。ABTS陽離子自由基清除率變化趨勢與此類似,但下降幅度較小。與25 ℃時相比,100 ℃時ABTS陽離子自由基清除力下降5%左右。據Asaduzzaman等[25]報道,長時間暴露于高溫中會導致抗氧化肽變性聚集,使得粗肽液的自由基清除活性下降。與此相反,加熱溫度在25~80 ℃時,Fe2+螯合率逐漸增大,100 ℃時略有下降,但螯合率仍比25 ℃時高出3%左右。這可能是因為高溫處理改變了抗氧化肽的構象,使得組氨酸更容易與Fe2+結合,體系中Fe2+含量減少,粗肽液的Fe2+螯合率增加[26]。完整的二級結構對維持肽類的生物活性十分重要,處理溫度過高、加熱時間長不可避免地會改變抗氧化肽的二級結構[27-28],影響其穩定性。因此,發酵香腸和抗氧化肽宜在中低溫環境中加工。
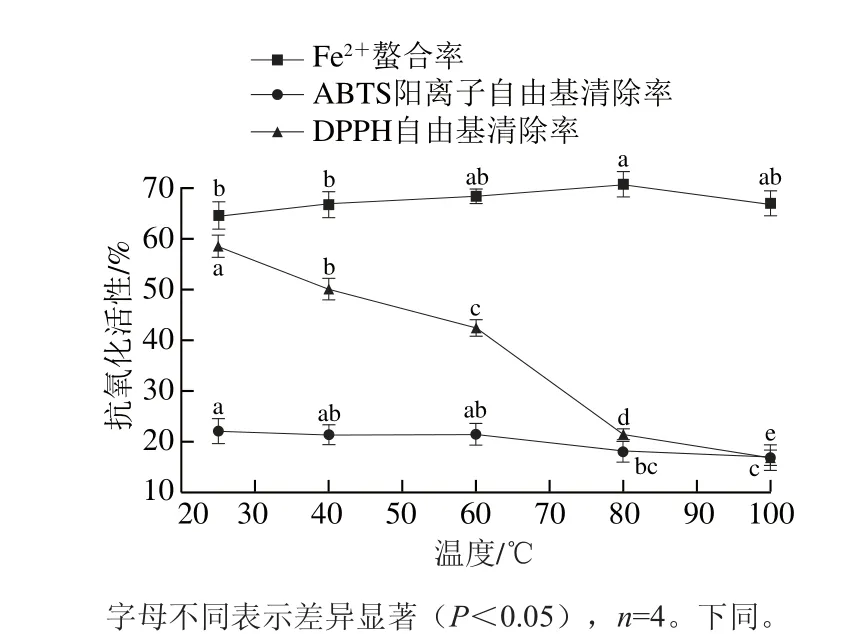
圖1 溫度對發酵香腸抗氧化肽活性的影響Fig. 1 Changes in antioxidant activities of peptides extracted from fermented sausages at different temperatures
2.2 pH值對發酵香腸抗氧化肽活性的影響
pH值可通過影響肽的電離勢和電子轉移能力影響肽的抗氧化活性[29]。如圖2所示,pH 7.0時粗肽液的DPPH自由基清除活性最高,偏酸或堿性環境都會導致DPPH自由基清除活性顯著下降(P<0.05)。其中,在pH 3.0環境中孵育2 h,粗肽液的DPPH自由基清除率下降10%,而在pH 11.0環境中反應2 h,活性下降22%。因此,粗肽液的DPPH自由基清除活性對堿性環境更敏感。堿性環境會促進肽類物質發生外消旋或脫酰胺反應,從而導致多肽的活性下降[30-31]。而酸性或低酸介質則會降低分子溶解度,影響肽分子羥基的有效性,這有可能促進氫原子的捐贈,減弱DPPH自由基清除活性[32]。pH 7.0時粗肽液的Fe2+螯合率最低,隨著堿性或酸性的增強螯合率顯著增強(P<0.05),但增加幅度較小。堿性環境中氧合酰胺基上的氮原子會攜帶負電荷,增強抗氧化肽對Fe2+的吸引力,從而提高Fe2+螯合率[28]。姚軼俊等[14]研究發現菜籽抗氧化肽Fe2+螯合活性隨pH值遞增呈先增高后降低的趨勢,與本實驗趨勢相反。這可能是因為發酵香腸抗氧化肽和菜籽抗氧化肽的結構、氨基酸組成和最適pH范圍等有所不同,導致在相同條件下2 種抗氧化肽的活性存在一定差異。粗肽液的ABTS陽離子自由基清除活性對pH值不敏感,清除率上下波動,變化不顯著(P>0.05)。發酵香腸抗氧化肽耐酸、堿性較弱,為了保持較好的抗氧化活性,宜在中性、弱酸性環境中加工制備、保藏發酵香腸及其抗氧化肽。
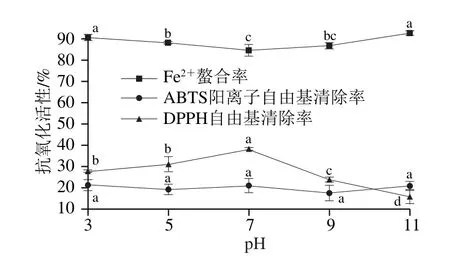
圖2 pH值對發酵香腸抗氧化肽活性的影響Fig. 2 Changes in antioxidant activities of peptides extracted from fermented sausages under different pH conditions
2.3 食品配料對發酵香腸抗氧化肽活性的影響
2.3.1 NaCl的影響

圖3 NaCl對發酵香腸抗氧化肽活性的影響Fig. 3 Changes in antioxidant activities of peptides extracted from fermented sausages at different NaCl contents
如圖3所示,加入NaCl后,粗肽液的DPPH自由基和ABTS陽離子自由基清除率分別增強18%和6%左右。Pereira等[32]認為,肽與含有NaCl的食品基質之間的相互作用有利于肽生物活性的維持。相反地,隨著NaCl添加量的提高,粗肽液的螯合Fe2+活性急劇下降(P<0.05),添加量達10%時,螯合率僅為22.23%。這可能是因為NaCl對肽分子結構造成一定程度破壞,加速氨基酸側鏈的裂解,導致其螯合Fe2+能力下降[33]。結果表明,NaCl有利于抗氧化肽清除自由基活性的提高,對螯合Fe2+活性保持有不良影響。為保證抗氧化肽較高的活性,在加工和應用過程中應適量添加食鹽,或者對產品進行脫鹽等處理。
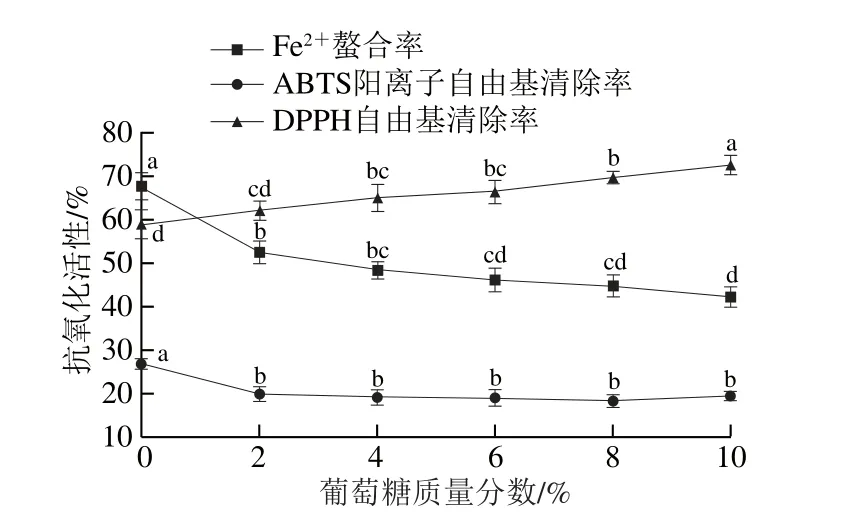
圖4 葡萄糖對發酵香腸抗氧化肽活性的影響Fig. 4 Changes in antioxidant activities of peptides extracted from fermented sausages at different glucose contents
圖4 中,粗肽液的DPPH自由基清除活性與葡萄糖添加量呈顯著正相關(P<0.05),添加量為10%時,DPPH自由基清除活性增加至未添加組的1.23 倍。研究表明,多肽和氨基酸可以與還原糖類發生美拉德反應,促進醛、酮等還原性物質的生成,提高肽液的供質子能力,從而促進抗氧化活性的提高[19,34]。粗肽液的Fe2+螯合活性與葡萄糖添加量呈負相關,添加量從2%提高至10%時,Fe2+螯合率從52.56%下降到42.36%。添加糖類將提高溶液黏稠度,阻礙肽段與Fe2+螯合。粗肽液的ABTS陽離子自由基清除活性對葡萄糖的抑制作用敏感度較低,活性穩定在19%左右。
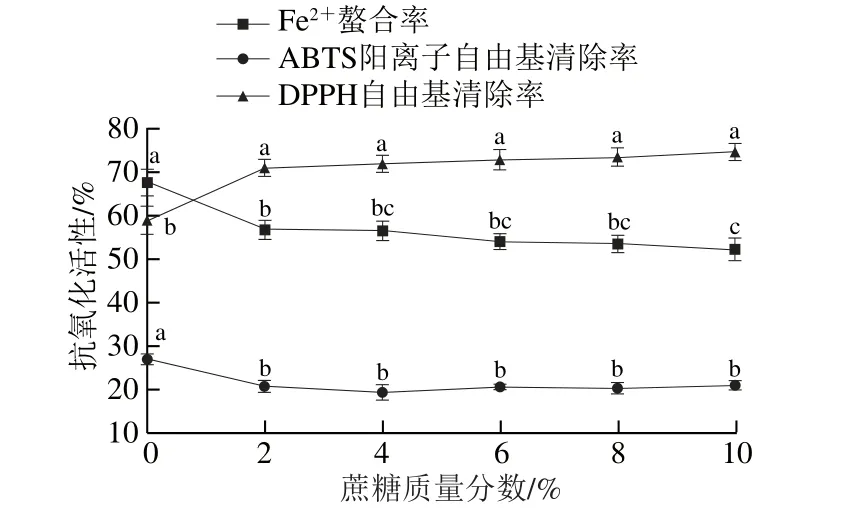
圖5 蔗糖對發酵香腸抗氧化肽活性的影響Fig. 5 Changes in antioxidant activities of peptides extracted from fermented sausages at different sucrose contents
圖5 中,蔗糖組的變化趨勢與葡萄糖組類似,但當添加量相同時,蔗糖組的活性保持率高于葡萄糖組。另外,蔗糖質量分數升高時,DPPH自由基清除活性稍有升高,但無顯著差異(P>0.05)。胡曉等[35]研究結果與本研究結果類似。原因可能在于蔗糖為非還原糖性多糖,常溫下水解不完全,美拉德反應受到一定抑制[36-37]。唐寧[17]和Guérard[38]等的研究表明,糖類是玉米抗氧化肽和魚肉源抗氧化肽的增效劑,但每種糖的作用效果略有不同。
2.3.3 NaNO2的影響
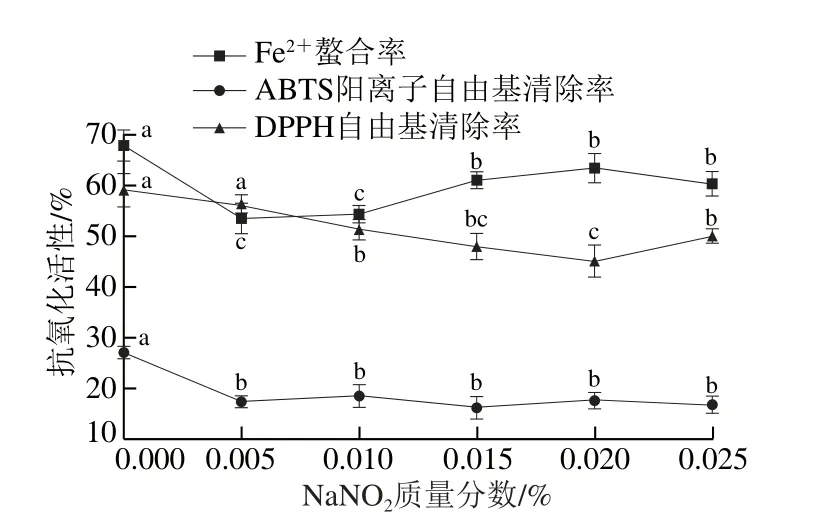
圖6 NNaaNNOO2對發酵香腸抗氧化肽活性影響Fig. 6 Changes in antioxidant activities of peptides extracted from fermented sausages at different NaNO2 contents
圖6 中,NaNO2添加量在0.005%~0.025%范圍內時,粗肽液的DPPH自由基清除率先降低后升高,在0.020%時取得最小值,清除率約為45%。Fe2+螯合活性則先升高后降低,在0.020%時螯合率為63.35%,僅比未添加組低4%左右。NaNO2添加量遞增時,粗肽液的ABTS陽離子自由基清除率上下波動,無顯著差異(P>0.05)。結果表明,發酵香腸加工中常用的發色劑、防腐劑NaNO2對發酵香腸抗氧化肽的活性影響較小。因此,在國家標準規定的添加范圍內NaNO2對發酵香腸抗氧化肽穩定性影響不大。
2.4 金屬離子的影響
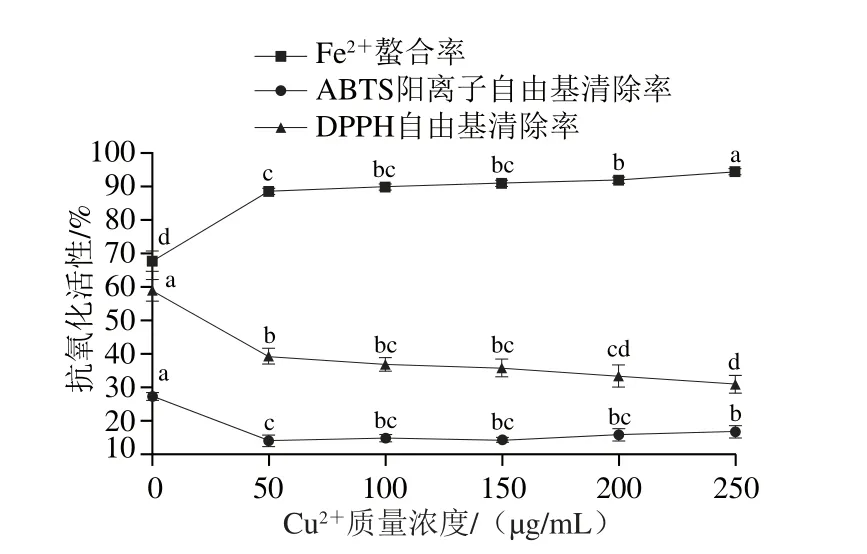
圖7 CCuu22+對發酵香腸抗氧化肽活性的影響Fig. 7 Changes in antioxidant activities of peptides extracted from fermented sausages at different Cu2+ contents
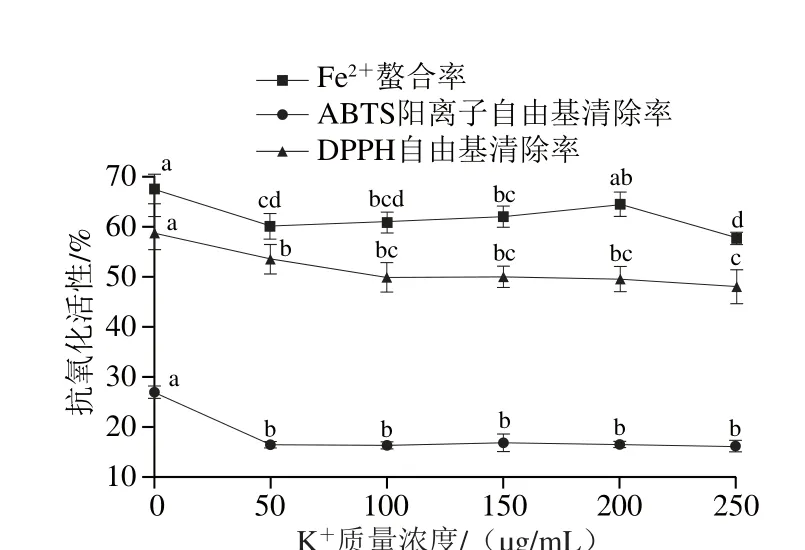
圖8 K+對發酵香腸抗氧化肽活性影響Fig. 8 Changes in antioxidant activities of peptides extracted from fermented sausages at different K+ contents
由圖7、8可知,Cu2+和K+顯著抑制了粗肽液清除自由基活性(P<0.05),其中Cu2+的抑制作用更明顯。當離子質量濃度達到250 μg/mL時,粗肽液分別保持30.89%和48.18%的DPPH自由基清除率。過渡金屬Cu2+更容易與多肽形成配合物[39],阻礙DPPH自由基清除過程。Thanonkaew等[40]發現Cu2+對烏賊肌肉肽的穩定性無顯著影響。這可能是因為多肽的組成不同,對金屬離子的響應機制和程度也有所不同。金屬離子質量濃度從5 μg/mL遞增至250 μg/mL過程中,K+對ABTS陽離子自由基清除活性影響不顯著(P>0.05),Cu2+可增強其清除活性,Cu2+質量濃度為250 μg/mL時,清除率可達16.66%,比50 μg/mL時高出10%左右。Cu2+和K+對Fe2+螯合活性影響不一,其中,Cu2+可顯著增強其活性(P<0.05),離子質量濃度為250 μg/mL時取得最大值94.77%,為未添加金屬離子時的1.4 倍。隨K+濃度升高,粗肽液的Fe2+螯合率的變化趨勢為降低-升高-降低,離子質量濃度為200 μg/mL時螯合率為64.67%,約比未添加組低3%,250 μg/mL時螯合率取得最小值57.87%。于麗娜等[26]發現加入Cu2+后,樣品的Fe2+螯合率增大為對照樣品的2.3 倍,與本實驗結果類似。原因在于氯化銅的水溶液為弱酸性,導致肽鏈上組氨酸殘基中的咪唑基接受質子,容易與Fe2+形成六元環和七元環,提高粗肽液對Fe2+的螯合活性。結果表明,在加工、貯藏發酵香腸及其抗氧化肽時應盡量避免與銅制器具接觸,同時盡量不與富含Cu2+的原輔料混合加工。
2.5 模擬胃腸消化道酶系對發酵香腸抗氧化肽活性的影響
2.5.1 模擬胃腸消化道酶系對游離氨基酸組成的影響
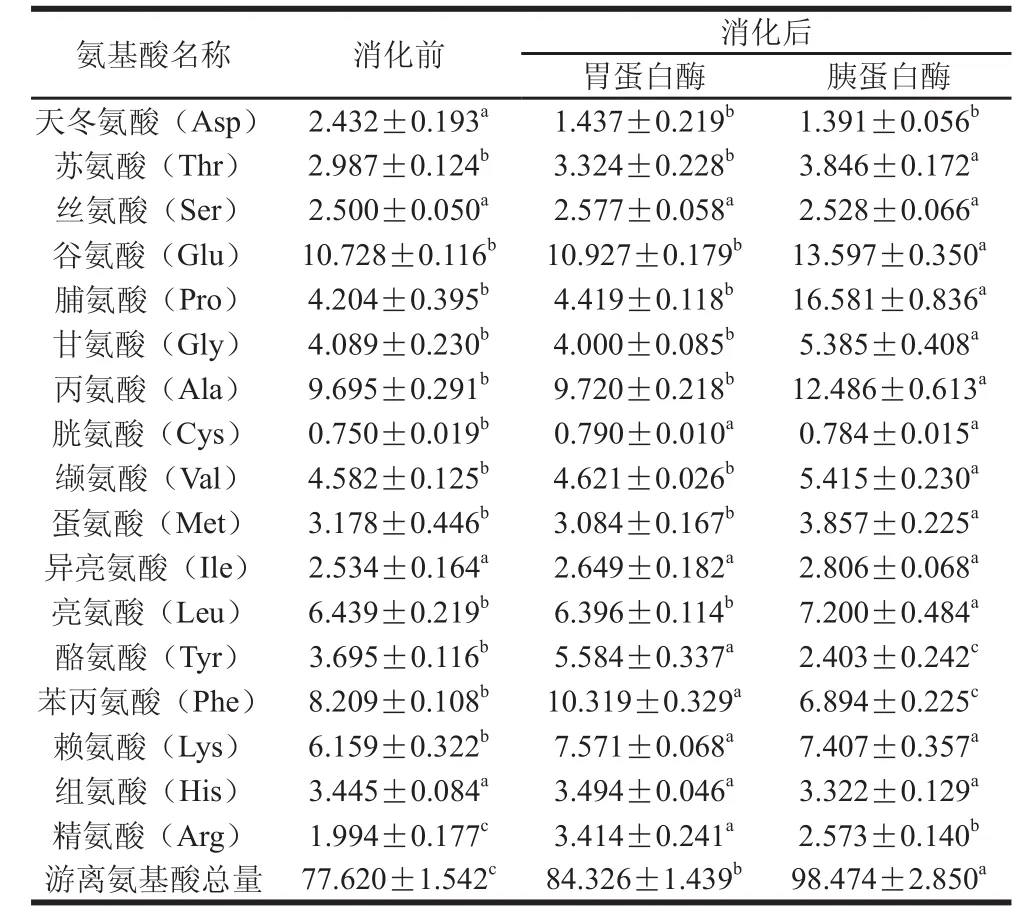
表1 模擬胃腸道消化中發酵香腸粗肽液游離氨基酸組成的變化Table 1 Changes in free amino acid contents of peptides extracted from fermented sausages during simulated GI digestion with pepsin followed by typsin μg/mL
如表1所示,胃蛋白酶消化2 h后,粗肽液中游離氨基酸總量從77.620 μg/mL顯著增加到84.326 μg/mL(P<0.05),再經過2 h的模擬胰蛋白酶消化,游離氨基酸總量進一步增加到98.474 μg/mL,是消化前的1.27 倍。這可能是因為胃蛋白酶的主要作用是破壞多肽的二級結構,將其水解成更小分子的肽。而胰蛋白酶則可以將多肽進一步水解,同時伴隨著大量游離氨基酸生成[18]。另外,經過胃酶和胰酶的水解,粗肽液中疏水氨基酸Val、Leu、Pro、Ala、Met含量顯著增高(P<0.05),Lys、Arg等具有金屬離子螯合能力的氨基酸也顯著增多(P<0.05)。
2.5.2 模擬胃腸消化道酶系對表面疏水性的影響
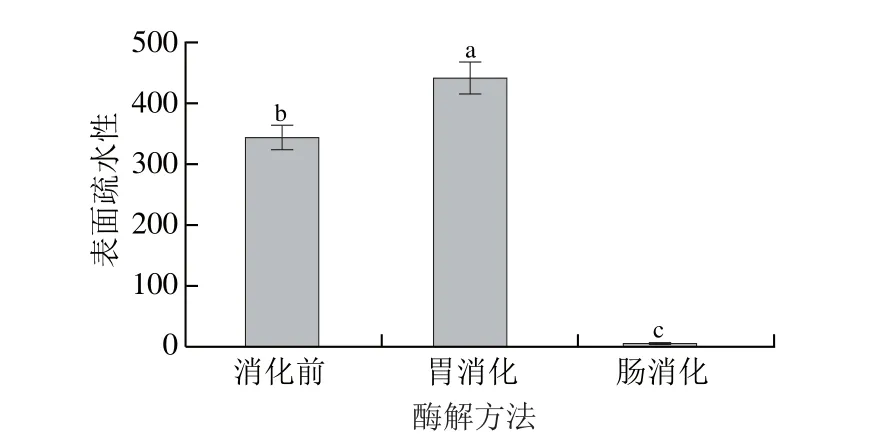
圖9 模擬胃腸消化中發酵香腸粗肽液表面疏水性的變化Fig. 9 Effect of simulated GI digestion on surface hydrophobicity of antioxidant peptides extracted from fermented sausages
圖9 表明,胃酶消化后,粗肽液的表面疏水性可達441.16,顯著高于消化前(P<0.05)。這進一步驗證了在胃蛋白酶的作用下,發酵香腸抗氧化肽的結構遭到破壞,使其多肽內部的疏水基團的得以暴露,表面疏水性增加[24]。而胰蛋白酶酶解后,粗肽液的表面疏水性銳減至6.63(P<0.05)。結合表1可知,胰蛋白酶水解導致游離氨基酸特別是Asp、Glu、Lys、Arg、Thr等親水性游離氨基酸顯著增多,會導致粗肽液的親水性增強,表面疏水性降低。
2.5.3 模擬胃腸消化道酶系對發酵香腸粗肽液抗氧化活性的影響
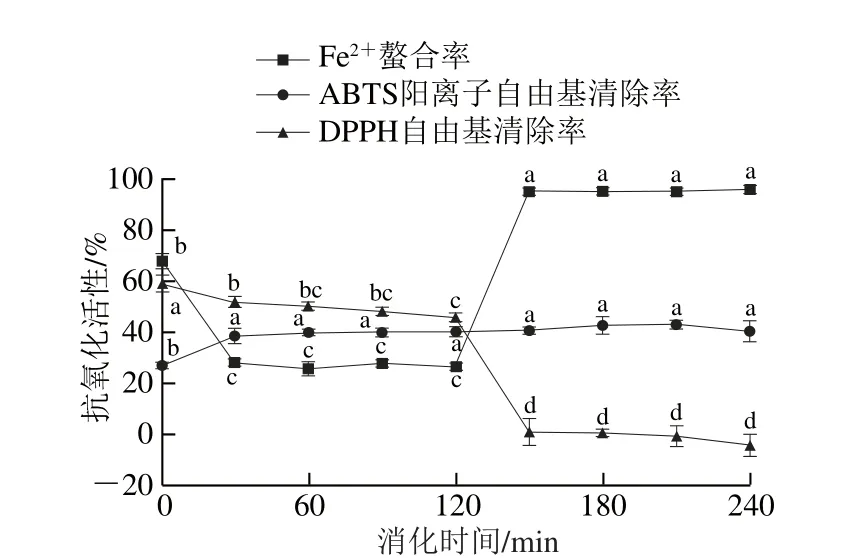
圖10 模擬胃腸消化對發酵香腸抗氧化肽活性的影響Fig. 10 Effect of simulated GI digestion on antioxidant activities of peptides extracted from fermented sausages
如圖10所示,0~120 min為模擬胃蛋白酶消化,120~240 min為模擬胰蛋白酶消化。經過120 min的模擬胃蛋白酶消化后,粗肽液的DPPH自由基清除率顯著(P<0.05)下降至45.8%,與消化前相比,活性保持率約77%,這可能是因為消化酶的最適溫度(37 ℃)不利于粗肽液DPPH自由基清除活性的保持(圖1)。在胰蛋白酶的作用下,粗肽液的DPPH自由基清除活性完全喪失。Zhu Chaozhi等[24]報道,模擬胃腸道消化會導致粗肽液的DPPH自由基清除活性顯著降低。胃蛋白酶消化顯著(P<0.05)降低了粗肽液的Fe2+螯合活性,消化120 min后活性僅為26%。模擬胃蛋白酶消化改變了多肽結構,破壞了螯合金屬離子的基團或氨基酸。而120 min的胰蛋白酶消化結束后,粗肽液的Fe2+螯合率顯著增加(P<0.05)至95.94%,是消化前的1.41 倍左右。這與酶解液中顯著增多的中性和酸性氨基酸有關[41]。蛋白酶解可顯著增強粗肽液的ABTS陽離子自由基清除活性,但ABTS陽離子自由基清除率與消化時間、酶系種類無顯著相關性(P>0.05),在實驗時間內一直維持在40%左右。
3 結 論
本實驗探究了不同因素及體外模擬胃腸道酶系消化對發酵香腸抗氧化肽穩定性的影響。結果表明,中高溫、酸堿性環境不利于抗氧化肽活性保持;食鹽和糖類可促進體系中自由基的清除,抑制抗氧化肽的Fe2+螯合活性;在國標規定范圍內使用NaNO2對抗氧化肽穩定性影響不大;與K+相比,Cu2+對抗氧化肽穩定性的影響更為顯著;模擬胃腸道酶系消化后,DPPH自由基清除活性完全喪失,Fe2+螯合率顯著升高,這與蛋白酶改變了肽鏈結構和氨基酸組成有關。

