甲基營養菌MB200中mutL基因的突變及高耐甲醇菌株的篩選
聞東明, 黃羅冬, 楊青山, 申佩弘
廣西大學生命科學與技術學院,廣西 南寧 530004
甲基營養菌(Methylobacteriumsp.)是一類能夠利用單碳化合物或非C—C鍵低碳化合物(如甲烷、甲醇、甲醛等)的微生物,由于這類細菌多為桿狀,也稱為甲基桿菌(Methylotrophicbacteria)[1]。其在自然界中分布廣泛,早在20世紀初科學家就發現了有細菌存在甲基營養能力,但直到20世紀六、七十年代,它們的生理生化性質才逐漸引起研究者的重視[2]。研究報道共有100多個基因參與甲基營養菌的C1代謝過程,包括甲醇氧化、甲胺氧化、甲醛氧化和絲氨酸循環等[3]。
目前,利用微生物合成方法生產生物燃料、精細化學品和藥物分子等 (如: 烴類燃料、大宗有機酸等) 主要使用葡萄糖作為碳源與能源,存在與人畜爭糧爭地的困局[4]。甲醇作為簡單的甲基化合物,含有更多電子,可提供更多還原力,且市場價格低廉,不受季節與氣候的影響[5],同時也是很多工業生產的副產物及廢棄物的主要成分,因而使用甲基營養菌生物合成途徑具有明顯的優勢。如果能夠根據甲基營養菌的這一特性對其加以利用,不僅可以降低污染,節約能源,還可以開辟出一條蛋白質或其它生物資源開發的新路徑[5]。目前已有研究利用其生產氨基酸、單細胞蛋白、聚合物、胞外多糖、維生素和輔酶等物質[6]。
甲醇作為底物具有很多優點,但也存在如下關鍵問題:(1)具有毒性的甲醇在甲基營養型微生物培養過程中不易染菌,但甲醇代謝過程中產生的甲醛對細胞有毒害作用[7];甲醇濃度高或濃度波動大均會造成甲醛在細胞中大量積累,對細胞造成毒害;(2)作為菌株生長的唯一碳源,甲醇濃度低定會造成產量低,而過高的甲醇濃度會對菌株造成傷害,甚至導致菌株無法生長;(3)在以甲醇作為底物進行培養時,存在培養過程穩定性差的問題,實驗結果難以重復[8]。
MutL基因是M. sp. MB200體內的一個突變修復基因,在大腸桿菌中,DNA復制錯誤主要通過甲基導向錯配修復(MMR)途徑進行糾正[9]。MutL蛋白通過調節從錯配識別到DNA雙鏈體解旋展開的一系列事件中發揮核心作用[10]。MMR首先通過需要ATP的MutS二聚體識別異常堿基對,隨后MutL以ATP結合的形式與MutS-DNA復合物[11]相互作用,激活與MutH 相關的潛在內切酶,定位在不匹配的兩側[12]。接著,MutL將UvrD蛋白招募到帶缺口的DNA底物上,啟動DNA從切口展開。解開的新生DNA鏈被細胞核酸外切酶[13],產生一個缺口,然后由DNA聚合酶III填補,最后的缺口被DNA連接酶封閉[14]。
目前少有關于甲基營養微生物耐受甲醇方面的報道,其耐受甲醇機理尚不清楚,因此獲得高耐受甲醇的甲醇營養型微生物對工業生產和解析其耐受甲醇的機理具有重要意義。
本研究從本實驗室保存的一株甲基營養菌M. sp. MB200野生菌株出發,通過三親本結合構建突變修復基因Mutl插入的突變體,在甲醇濃度不斷提高的環境中對MB200mTB進行不斷地甲醇環境壓力脅迫誘導突變,篩選獲得高甲醇條件下生長的菌株,為進一步應用奠定基礎。
1 材料與方法
1.1 材料
1.1.1菌種與質粒
實驗所用菌株M. sp. MB200(Nmr)和大腸桿菌E.coliDH5α為本實驗室保存,所用質粒為pMD18-T(Ampr,TaKaRa公司)、pk18mod(Kmr)、pRK2073(Kmr)、pCM80(Tcr)。
1.1.2培養基
(1) 完全培養基(CM,g/L):蛋白胨10,牛肉膏3,NaCl 5,pH 7.0。
(2) 基本培養基(MM,g/L)按照文獻[15]配制,在培養甲基營養菌M. sp. MB200時在實驗前向培養基中加入無水甲醇。
1.1.3常用抗生素及使用濃度
氨芐青霉素(Amp,50 μg/mL)、卡那霉素(Km,25 μg/mL)、四環素(Tc,25 μg/mL)、萘啶酮酸(Nm,50 μg/mL)。LA Taq聚合酶和T4-DNA連接酶購自TaKaRa公司。
1.1.4主要試劑
所需化學試劑均為國產分析純,購自國藥集團化學試劑有限公司;基因組DNA提取試劑盒、質粒DNA小量提取試劑盒、PCR產物純化試劑盒和膠回收試劑盒等常用試劑盒購自Thermo公司。其他生物化學實驗常用試劑購自上海生工公司。本實驗所用引物也交由上海生工合成,所用引物見表1。
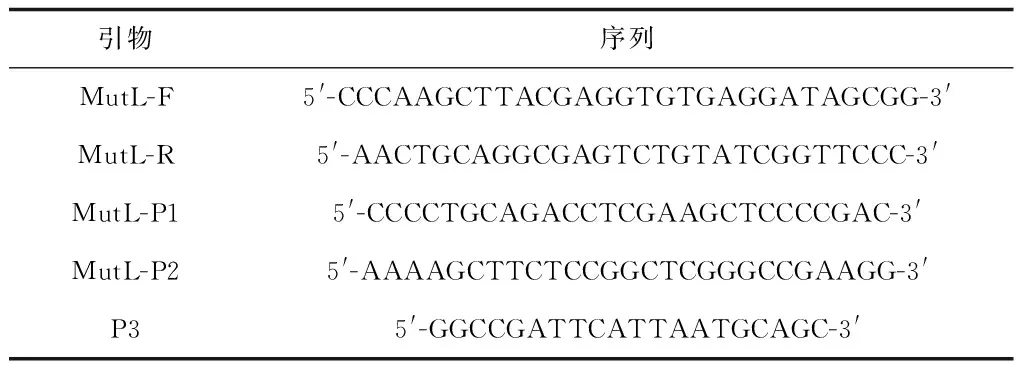
表1 實驗所用引物
1.2 方法
1.2.1M. sp. MB200和突變菌株
MB200mTB基因組DNA提取、質粒DNA提取、回收、純化、酶切、連接、轉化等常規分子生物學操作均參照文獻[16]進行。
1.2.2mutL基因和部分mutL片段(mutLps)的PCR擴增和DNA測序
參照Genbank中AM1的mutL基因序列,通過vector NTI軟件設計引物,引物序列分別為MutL-F:5′-CCCAAGCTTACGAGGTGTGAGGATAGCGG-3′,MutL-R:5′-AACTGCAGGCGAGTCTGTATCGGTTCCC-3′,MutL-P1:5′-C-CCCTGCAGACCTCGAAGCTCCCCGAC-3′,MutL-P2:5′-AAAAGCTTCTCCGGCTCG-GGCCGAAGG-3′。以M. sp. MB200的基因組DNA為模板,其中MutL-F和MutL-R用來擴增完整mutL基因序列,MutL-P1和MutL-P2用來擴增mutL基因內的部分片段mutLps。將擴增產物連接到pMD18-T vector載體上(分別命名為pMD18T-MutL,pMD18T-MutLps),分別導入DH5α,在含有X-gal、IPTG和Amp的LB平板上進行藍白斑篩選,并提取質粒,酶切和測序驗證。
1.2.3原始菌株M. sp MB200的耐甲醇性
將M. sp. MB200種子液5 mL接入甲醇濃度分別為0.8%、1%、1.2%、1.4%、1.6%、1.8%、2.0%和2.2%的100 mL MM培養基中,于恒溫搖床32 ℃、200 r/min培養48 h,測量原始菌株在不同甲醇中的生長曲線。
1.2.4MutL基因突變株MB200mTB的構建
將mutL片段(mutLps)用PstI與Hind III從T載體上酶切下,與同樣用PstI與Hind III酶切的pK18mob載體連接,得到重組質粒pK18mob-mutLps,化學轉化至E.coliDH5α中。在質粒載體pK18mob的多克隆位點上游200 bp處設計引物P3:5′-GGCCGATTCATTAATGCAGC-3′,以重組質粒pK18mob-mutLps為模板,分別以P3、MutL-P1為引物對其進行擴增,驗證重組質粒pK18mob-mutlps連接的正反向。采用三親本接合的方法[17],將供體菌DH5α/pK18mob-mutLps,受體菌M. sp MB200,幫助菌DH5α/pRK2073同時培養至對數生長期,用0.85%生理鹽水洗滌三次后將3種菌體按照DH5α/pK18mob-mutLps:M. sp. MB200:DH5α/pRK2073=1∶4∶1混合在一起,用移液器轉移至含10% LB的MMI培養基的醋酸纖維薄膜上,置于超凈工作臺中晾干,于恒溫培養箱中32 ℃倒置培養3 d。在此期間,每隔12 h用滅菌牙簽從薄膜的菌落邊緣挑取部分菌落,使用1 mL MM液體培養基于滅菌Ep管中清洗牙簽,將其稀釋涂布于含抗生素Nm 50 μg/mL、Km 25 μg/mL的MMI固體培養基上進行篩選,32 ℃培養72 h。得到的篩選子命名為MB200mTB(Nmr,Kmr),即為突變株。
1.2.5突變株MB200mTB的耐甲醇誘導
往1.5%甲醇濃度的基礎培養基中接入菌株MB200mTB,于恒溫搖床30 ℃、200 r/min培養48 h,后接入10%菌液進1.7%(甲醇濃度增加0.2%)甲醇濃度的基礎培養基中,恒溫搖床30 ℃、200 r/min培養48 h。待生長穩定后繼續接種10%菌液進甲醇濃度增加0.2%的基礎培養基進行培養。對照組接種10%菌液進甲醇濃度增加1%的基礎培養基進行培養。由于突變株MB200mTB的突變修復基因mutL被插入突變,不能修復在菌體生長繁育中產生的各種隨機突變,在甲醇濃度不斷增長的環境中,只有產生高濃度甲醇耐性的菌株可以存活,其余突變方向的菌株因不能適應高濃度甲醇環境而死亡,經過不斷地傳代馴化后,可篩選獲得耐高濃度甲醇的菌株。
1.2.6表達載體pCM80-mutL的構建
使用分別含PstI酶切位點和Hind III酶切位點的引物MutL-F和MutL-R,從克隆載體pMD18T-MutL中擴增出mutL目的片段,膠回收后進行雙酶切,然后與經同樣酶切處理的載體pCM80連接,構建表達載體pCM80-mutL,化學轉化至E.coliDH5α,篩選獲得的陽性重組子命名為E.coliDH5α/pCM80-mutL。
1.2.7耐高甲醇濃度重組株MB200mHB菌株構建
由于MB200mTB的突變修復基因mutL被插入突變,不能修復菌體產生的各種隨機突變,遺傳穩定性差,需要將mutL基因回補到篩選到的耐高濃度甲醇菌株中,確保其遺傳的穩定性。吸取耐甲醇誘導系統中可在7%甲醇濃度下正常生長的菌液,稀釋后涂板于添加甲醇濃度為7%的MM固體培養基上,倒置于恒溫培養箱中32 ℃培養72 h,隨機挑選20個單菌落于7%的MM液體培養基進行培養。將培養至對數生長期的E.coliDH5ɑ/pCM80-mutL做為供體菌,隨機挑選的20株MB200mTB做為受體菌,E.coliDH5α/pRK2073做為幫助菌,三親本結合后于32 ℃培養箱中倒置培養3 d。每隔12 h用滅菌牙簽從薄膜的菌落邊緣挑取部分菌落,稀釋涂布于含抗生素Nm 50 μg/mL、Tc 15 μg/mL的MM固體培養基,倒置于培養箱中32 ℃培養72 h。得到的20株篩選子MB200mTB/pCM80-mutL(Nmr,Tcr)即重組株分別命名為MB200mHB1-MB200mHB20。
1.2.8重組菌株遺傳穩定性研究
將得到的20株MB200mHB菌株分別于7%甲醇含量的MM液體培養基中,恒溫搖床32 ℃、200 r/min培養48 h,測量其OD600。 5%接種量接種于7%甲醇含量的MMI液體培養基中傳代培養,32 ℃、200 r/min培養48 h,測量其OD600。連續傳代10次,記錄每次傳代時菌株生長狀況,待最后一次傳代時進行平板涂菌培養,隨機挑取單菌落進行質粒提取驗證并送交生物公司測序,以確定重組菌株的遺傳穩定性。
1.2.9重組菌株生長情況分析
先分別從培養有野生型菌株M. sp. MB200和重組菌株MB200mHB1的新鮮的平板上接一環菌株于10 mL指型瓶中活化培養,恒溫搖床32 ℃、200 r/min培養使之達到對數生長后期。按0.5%的接種量將M. sp. MB200和MB200mHB1分別轉接到100 mL新鮮的甲醇含量為1%的MM液體培養基中;另將MB200mHB1按0.5%的接種量接入甲醇含量分別為1%和7%的100 mL新鮮的MM液體培養基中,恒溫搖床32 ℃、200 r/min進行培養,每6 h取樣,使用分光光度計檢測菌液OD600數值,繪OD600與時間的曲線圖。
2 結果與討論
2.1 菌株M. sp MB200的甲醇耐受
將菌株M. sp MB200種子液5 mL接入100 mL甲醇濃度分別為0.8%、1%、1.2%、1.4%、1.6%、1.8%、2.0%和2.2%的基礎培養基中,32 ℃、200 r/min搖床培養 48 h,測量原始菌株在不同濃度甲醇中的生長曲線及菌體量(圖1)。 菌株在1%甲醇濃度培養基中生長速度最快,菌體量最大,在甲醇濃度增高的培養基中生長速度及菌體量遞減,在2.2%甲醇濃度培養基中幾乎不進行生長。
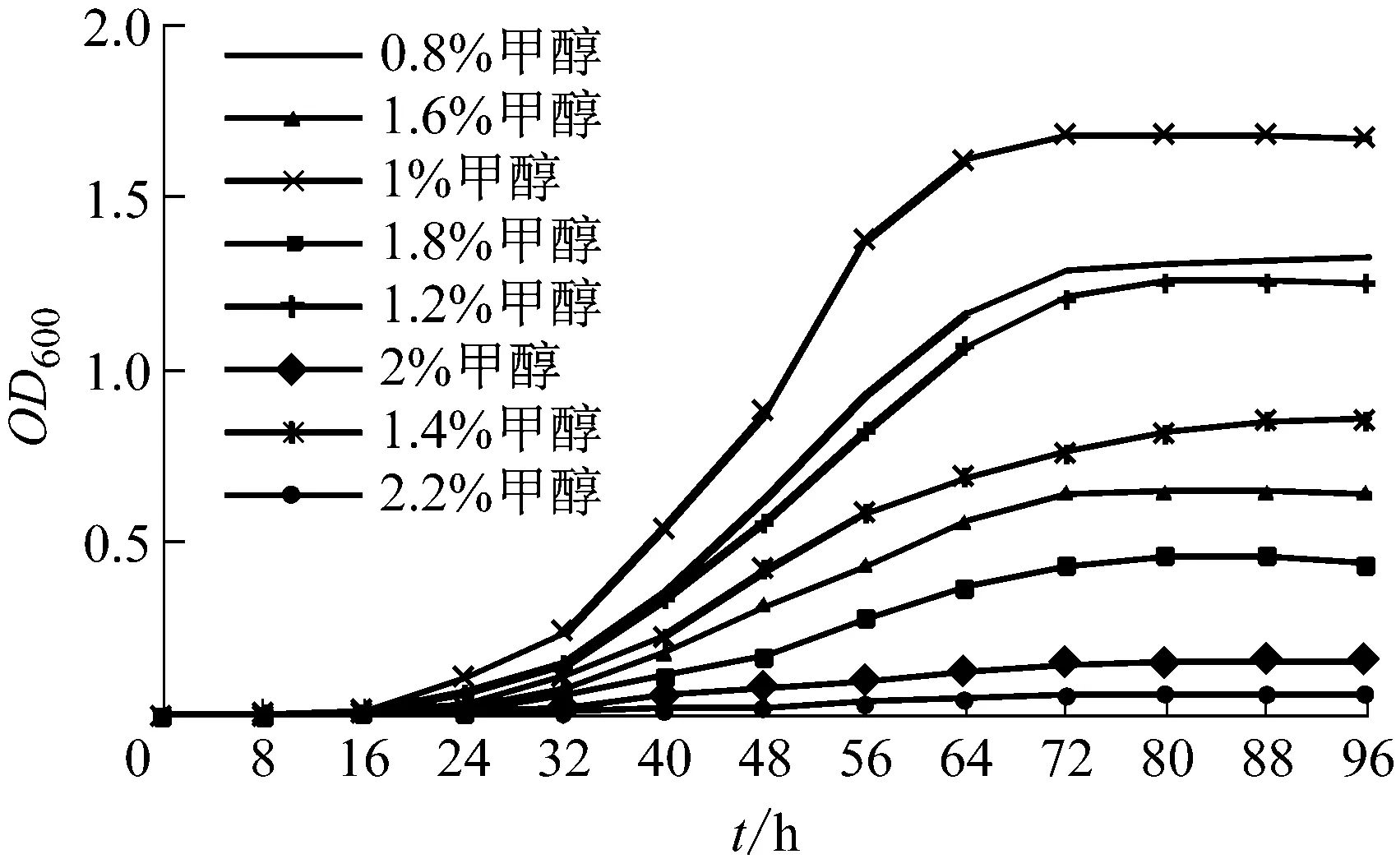
圖1 菌株MB200的甲醇耐受生長曲線
2.2 突變體的構建與篩選
使用自殺質粒pK18mob構建含有mutL基因部分片段的重組質粒pK18mob-mutLps,通過三親本結合將質粒pK18mob-mutLps 導入野生菌株M. sp. MB200中,經過同源單交換,mutL基因被pK18mob插入突變。經Nm、 Km抗性平板篩選,PCR驗證,得到突變株MB200mTB(Nmr,Kmr)。
2.3 菌株MB200mTB的甲醇誘導突變
通過在不斷增加的甲醇濃度對突變體MB200mTB連續傳代培養,環境誘導突變。菌株經過若干代培養后,逐漸適應高甲醇濃度的環境。在經過80次連續傳代后,菌株可在7%甲醇環境中具有較好的生長量。菌株MB200mTB在甲醇培養基中的耐甲醇結果如圖2所示。
菌株MB200mTB經在甲醇培養基中反復傳代馴化后,其對甲醇的耐受性有較大的提高。在未經甲醇誘導時,MB200mTB菌體在甲醇濃度1%的培養基中生長速度較為緩慢,在接種48 h后OD600值由0.05升至0.855。而經連續誘導培養后,在7%甲醇濃度含量培養基中,菌體生長得到大幅提升,在接種48 h后OD600值由0.05漲至2.583。可見,經過在不斷升高的甲醇濃度環境中對菌體進行誘導突變,菌株的甲醇耐受性有極大的提升。
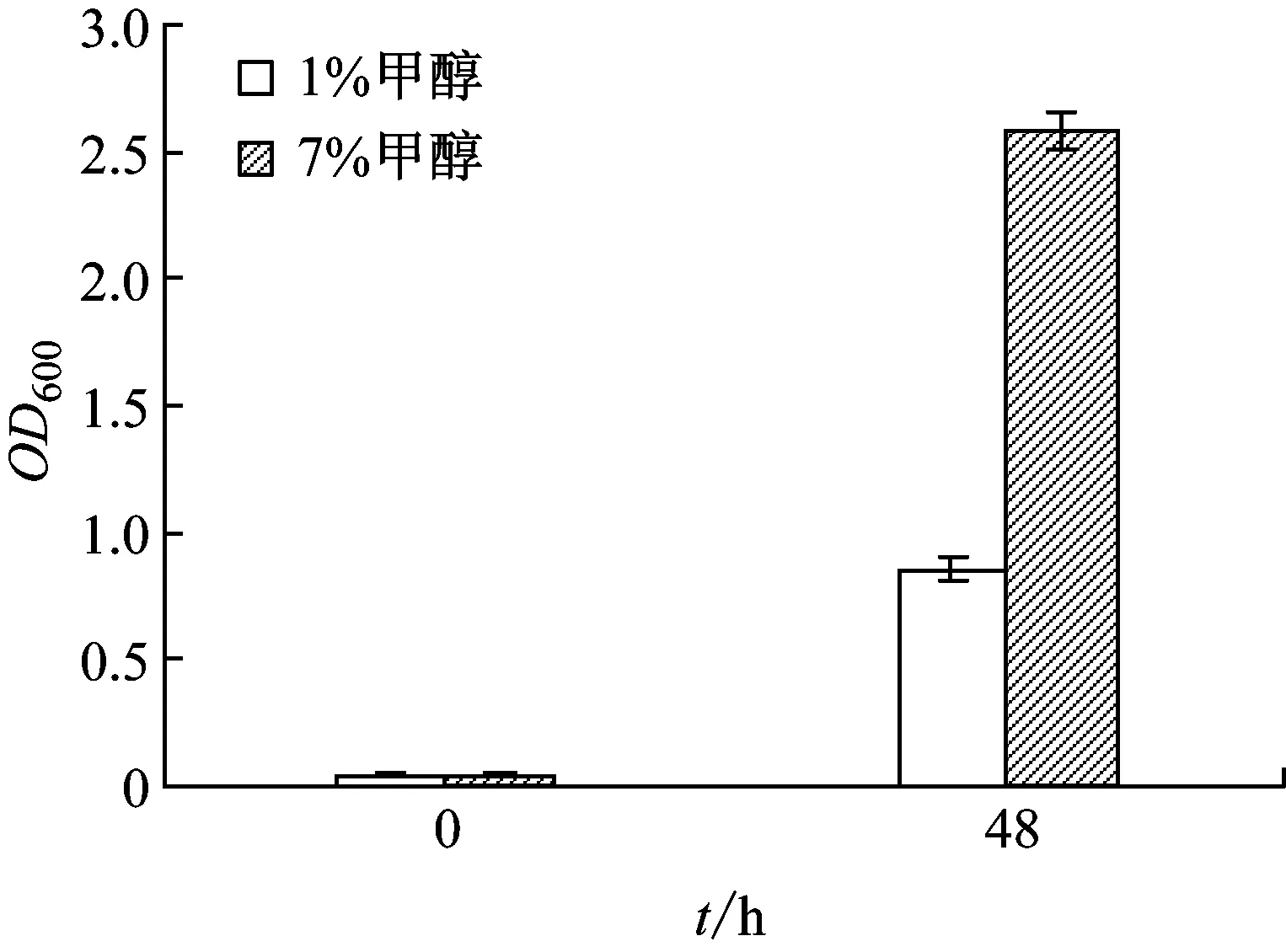
圖2 MB200mTB甲醇誘導前后生長比較
2.4 重組菌株MB200mTB的構建
利用引物MutL-F和MutL-R,從克隆載體pMD18T-MutL中擴增出mutL目的片段,膠回收后進行雙酶切,與經同樣酶切處理的載體pCM80連接,構建表達載體pCM80-mutL(圖3),化學轉化至E.coliDH5α,涂布到含Tc的X-gal和IPTG的平板上,對轉化子進行篩選,提取質粒進行酶切驗證,將陽性重組子命名為E.coliDH5α/pCM80-mutL。
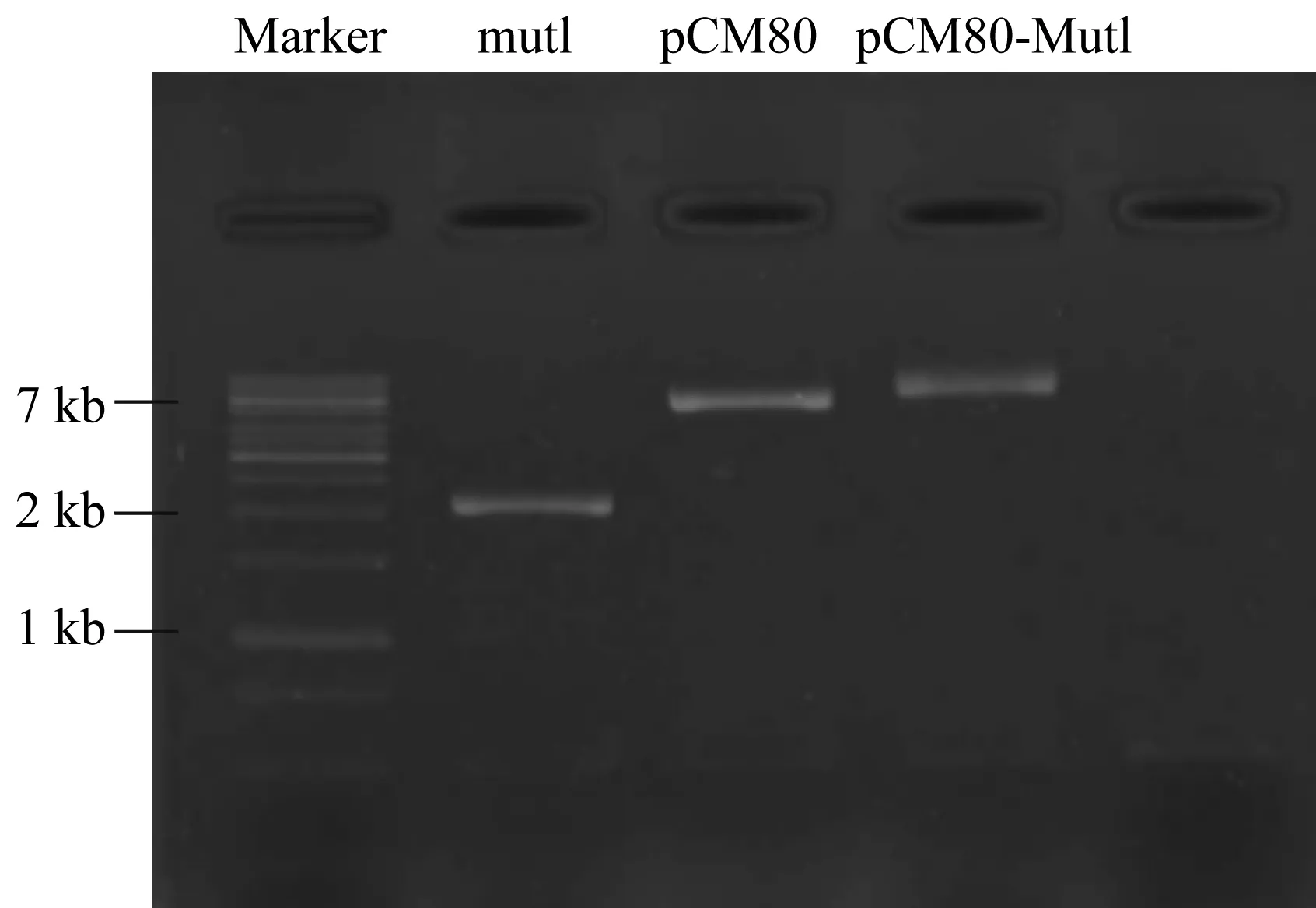
圖3 表達載體pCM80-mutL的構建
以篩選到的耐高濃度甲醇菌株MB200mTB為受體菌進行三親本接合,將重組質粒導入MB200mTB中,構建重組菌MB200mTB/pCM80-mutL。平板培養后稀釋涂布于含Nm 50 μg/mL、Tc 15 μg/mL的固體MM平板上進行篩選,32 ℃倒置培養72 h。共得到20株篩選子(Nmr,Tcr)即重組株命名為MB200mHB1-MB200mHB20。
2.5 重組株MB200mHB遺傳性狀穩定性
連續在7%甲醇培養基中傳代培養10代,記錄每一代菌液生長狀況,其中有7株菌體生長狀況優異,在7%甲醇濃度下具有較好的生長性狀,其余菌株雖在7%甲醇濃度條件下可以生長,但菌體生長速度和菌體量未有較大提升(圖4)。
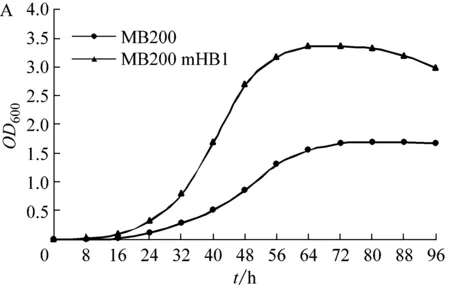
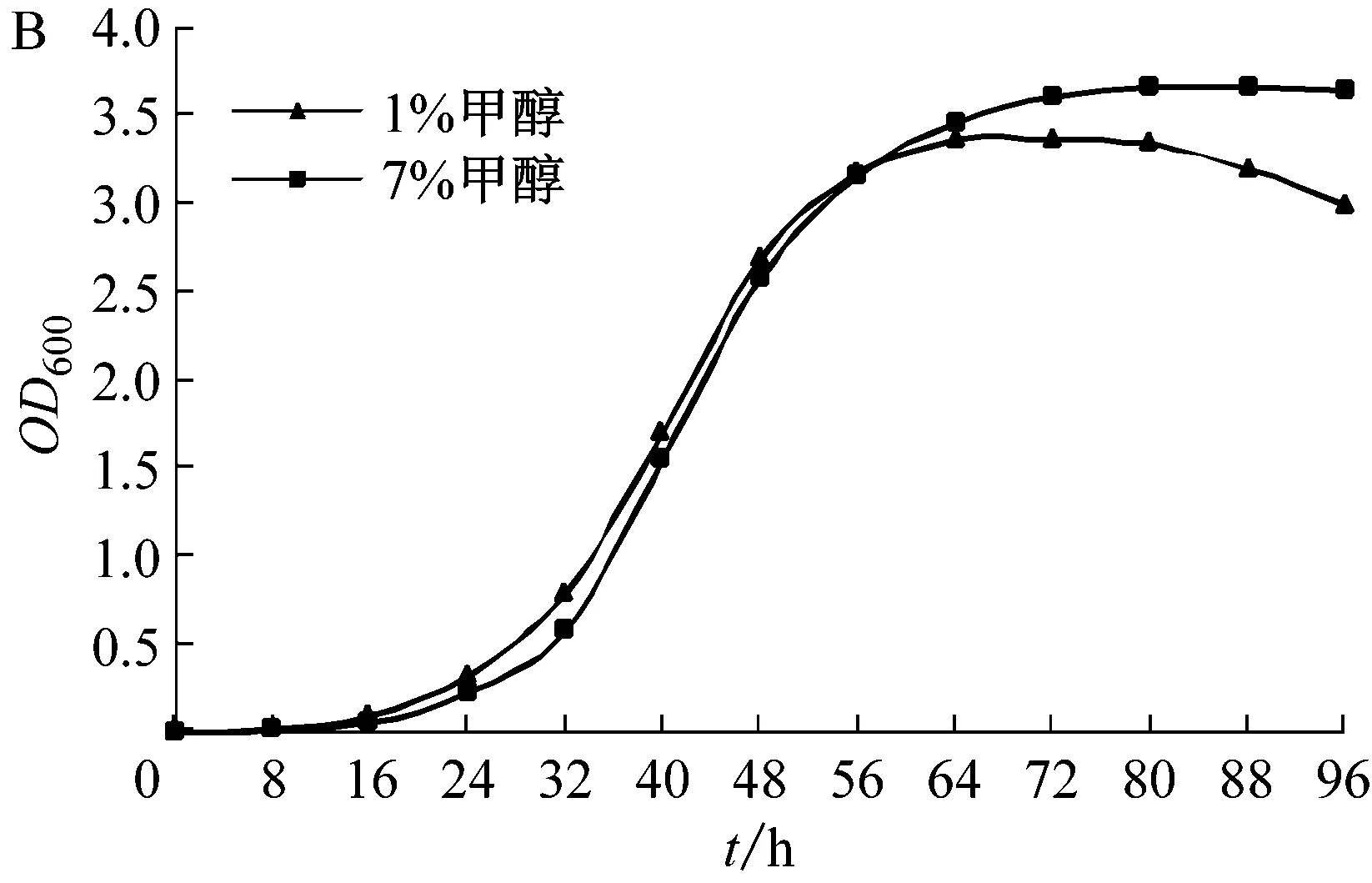
A:1%甲醇濃度下菌株生長曲線;B:MB200mTB1不同甲醇濃度下生長曲線
在7%甲醇誘導培養基中,可以生存的菌株產生了明顯的生長性狀差異。既存在可以利用高濃度甲醇進行快速生長繁殖的菌株,也存在可生長緩慢的菌株。在通過三親本結合進行遺傳穩定性恢復后,MB200mHB1-MB200mHB20均在連續10代液體培養中OD600值及菌體量接近,生長穩定。
2.6 野生菌與重組菌生長情況分析
按0.5%的接種量將活化后的M. sp. MB200和MB200mHB1分別轉接到100 mL新鮮的甲醇含量為1%的MM液體培養基中;另將MB200mHB1按0.5%的接種量接入甲醇含量分別為1%和7%的100 mL新鮮的MM液體培養基中,恒溫搖床32 ℃ 200 r/min進行培養,每隔6小時取樣,使用分光光度計檢測菌液OD600數值,最后繪OD600與時間的曲線圖(圖4),來衡量菌株的生長情況。
結果表明,在甲醇濃度較低的培養基中(1%甲醇濃度),重組菌MB200mHB1生長速度更快,較野生菌M.sp. MB200提前8 h到達對數期,且其在穩定期的菌體量更大。在不同的甲醇濃度下,MB200mHB1具有不同的生長速度。當培養基甲醇濃度較低(1%甲醇濃度),菌體快速生長且更早到達對數期,但由于培養基甲醇含量較低,在穩定期生長一段時間后開始出現菌體消融現象。而在7%濃度下,菌體生長量較在1%甲醇濃度下的生長量大,且在達到生長期后能夠維持較長時間。
3 結論
本研究通過構建了甲基營養菌M. sp. MB200的mutL基因突變株MB200mTB,在甲醇不斷增高的培養基中進行甲醇誘導突變,平板篩選到20株可以在7%甲醇環境中生長的菌株,三親本結合進行遺傳穩定性恢復后,獲得20株可穩定遺傳的重組菌株。其中有7株重組菌株的生長性狀較野生菌株M. sp. MB200得到極大提升,不僅可以在7%甲醇條件下快速生長繁殖,且其菌體量較野生菌得到極大提升,甲醇耐受性提升近4倍。
甲醇作為甲基營養菌M. sp. MB200可利用的能源與碳源,菌體對甲醇的耐受能力一定程度上影響菌體的生長,進而限制了利用甲基營養菌進行各種生物合成的能力。通過對菌體進行連續的甲醇環境誘導突變,獲得高甲醇耐受的菌株,可以進一步研究甲基營養菌利用甲醇的機制。同時可對高甲醇耐受的菌株進行針對性改造,獲得性狀優良的工程菌,為大規模的工業生產提供可能。

