低氧微環境對腦膠質瘤細胞增殖、凋亡及HIF-1α 表達的影響
余朝軍,趙遷浩,趙寧輝
(1) 江油市九〇三醫院神經外科,四川江油 621700;2) 昆明醫科大學第二附屬醫院神經外科二病區功能神經外科,云南昆明 650101;3) 昆明市兒童醫院神經外科,云南昆明 650034)
腫瘤的惡性增殖使其組織內耗氧及血管形成不全,導致微環境含氧量不足,使腫瘤各區域處于不同低氧微環境中,研究已發現包括神經膠質瘤在內的大多實體腫瘤均存在著廣泛的缺氧區域[1]。并且隨著神經膠質瘤惡性程度的增加瘤內的氧分壓逐漸降低,研究發現在許多高級別的神經膠質瘤中存在著明顯的缺氧區域,其生長的局部氧含量甚至低于1%[2]。缺氧微環境也與神經膠質瘤細胞的增殖、凋亡、侵襲、遷移、血管生成和耐藥性密切相關[3]。低氧誘導因子-1α(HIF-1α) 在機體及細胞水平上調節低氧適應性反應和糖酵解速率,是腫瘤細胞適應低氧生存增殖的關鍵因素[4]。本研究通過三氣培養箱模擬神經膠質瘤細胞的低氧微環境,觀察處于缺氧環境的人腦膠質瘤細胞株T98G 隨時間變化的生長情況,以及細胞不同生長時間及密度對HIF-1α 表達的影響。
1 材料與方法
1.1 細胞培養及實驗分組
將人腦膠質瘤細胞株T98G(購于中國科學院昆明動物研究所),用基礎培養基(DMEM/高糖+10%FBS+1%P/S) 培養,設為常氧組(21%O2)和低氧組(1%O2)。以不同密度將低氧組細胞分為低密度組(1 萬個/cm2),中密度組(4.3 萬個/cm2),高密度組(8.5 萬個/cm2) 和極高密度組(12.5 萬個/cm2),于CO2培養箱及三氣培養箱中以相應氧濃度及培養基中分別培養24、48、72、96及120 h 后檢測細胞存活與增殖。
1.2 MTT 實驗檢測細胞存活及增殖
取對數生長期的T98G 細胞,設置常氧組(21%O2)、低氧組(1%O2) 及調零組,以每孔3 000 個細胞/200 μL 的密度鋪于96 孔板,按分組分別培養24、48、72、96、120 h 后進行加入20 μL 0.5 mg/mL MTT 溶液進行增殖檢測。在酶標儀上于492 nm 波長處讀取吸光度值(A 值),以培養時間為橫坐標,吸光度值為縱坐標,繪制細胞生長曲線,實驗重復3 次。
1.3 Hoechst 染色凋亡檢測
根據實驗分組,以每孔0.8×105細胞密度接種到6 孔板中,達到處理時間后消化細胞,清洗后以1 mL 4%PFA 重懸、固定細胞,避光下向每孔加1 mL 終濃度為10 μg/mL 的Hoechst33342 染液后滴于載玻片后到熒光顯微鏡觀察。
1.4 HIF-1α 的表達檢測
根據不同的實驗組,提取各組相應時間段的細胞總蛋白后用Western blot 檢測HIF-1α 表達。蛋白質濃度測定后,各組樣本取總蛋白20 μg 上樣進行電泳、轉膜、封閉后,加入HIF-1α 一抗過夜,以β-actin 做內參,洗膜后加入二抗,顯影曝光后用image J 進行灰度值分析。
1.5 免疫細胞化學(ICC)
根據實驗分組在帶有細胞爬片的6 孔板中鋪上密度為0.8×105/孔的T98G 細胞進行處理,達到處理時間后,用4%的多聚甲醛進行細胞固定后室溫下加入密封液(0.5%TritonX-100+3%BSA+5%山羊血清) 處理1.5 h。棄封閉液,加一抗(HIF-1alpha Rabbit Monoclonal Antibody,1:200) 室溫孵育2 h,加二抗(Goat anti-rabbit IgG-FITC,1:200) 室溫孵育1 h,DAPI 液染色10 min;取出玻片,樹膠封片;上熒光顯微鏡觀察。
1.6 統計學處理
2 結果
2.1 Hoechst 染色檢測低氧組與常氧組細胞凋亡
倒置顯微鏡下的低氧組T98G 細胞(圖1A)和常氧組細胞(圖1B) 的比較顯示良好的生長狀態且無明顯的細胞凋亡;Hoechst33342 進行細胞核染色后見低氧組(圖1C) 和常氧組(圖1D) 核形態完好,未見明顯的細胞凋亡。

圖1 1%O2 氧濃度和常氧下培養72 h 細胞鏡下形態Fig.1 Cells cultured under 1%O2 oxygen concentration and normoxia for 72 h
2.2 MTT 法檢測低氧組和常氧組的細胞增殖
常氧組和低氧組T98G 細胞連續培養24、48、72、96、120 h 生長曲線發現(圖2):常氧組和缺氧組細胞均表現出增殖趨勢且表現出良好的生長狀態。低氧組在<72 h 時增殖速率略高于常氧組,但在120 h 內生長趨勢差異無統計學意義(P>0.05)。
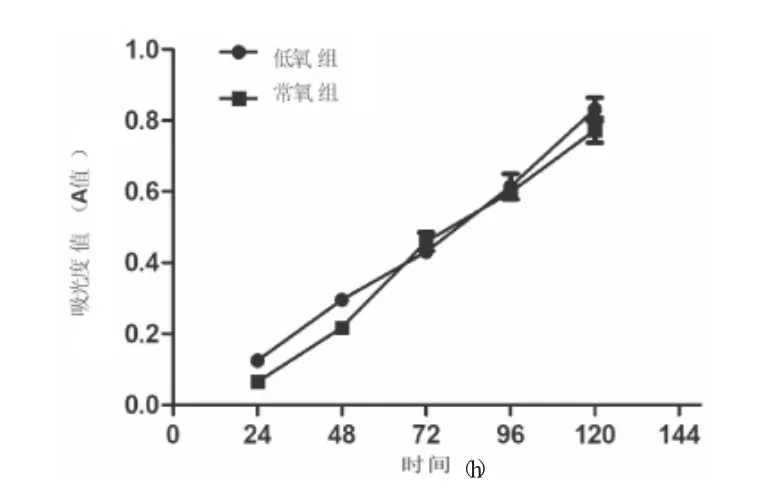
圖2 T98G 低氧組和常氧組細胞生長曲線Fig.2 Growth curve of T98G cells in hypoxia group and normoxia group
2.3 低氧對T98G 細胞HIF-1α 蛋白表達的影響
T98G 細胞在低氧和常氧下處理24 h 后,根據免疫熒光結果,常氧下T98G 細胞中HIF-1α 少量表達(圖3 A),而低氧下呈現高表達(圖3 B)。Western blot 也證實了常氧下HIF-1α 蛋白少量表達(圖4 A),低氧時HIF-1α 蛋白明顯高表達(P<0.001),見圖4 B。
2.4 不同時間梯度下低氧條件對HIF-1α 表達的影響
根據蛋白質印跡結果,低氧條件下T98G 細胞的HIF-1α 表達在<24 h(4、6 和12 h) 隨時間增加(P<0.05) (圖5A、5B),在24 h(48、72 h) 后隨著時間延長,HIF-1α 表達量逐漸下降((P<0.05) 圖5 C、5D)。該結果還證明了在缺氧條件下HIF-1α 不會長時間大量表達,而是急性快速表達。
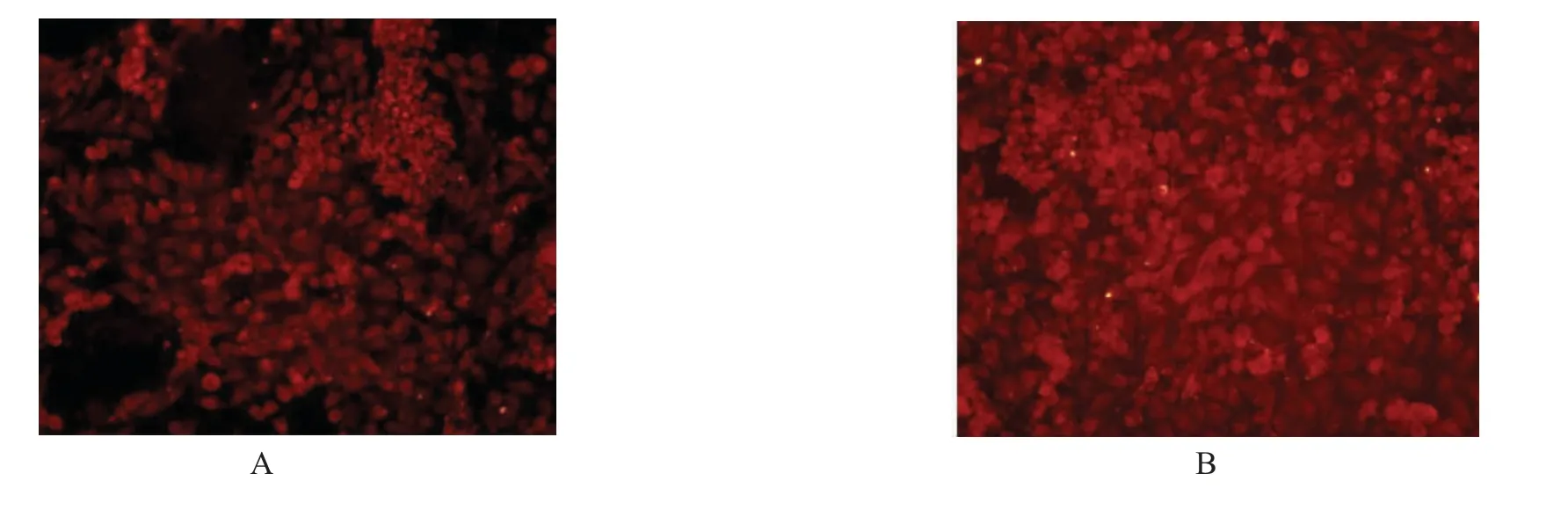
圖3 T98G 細胞在低氧和常氧下處理24 h 后HIF-1α 免疫熒光檢測Fig.3 Immunofluorescence detection of HIF-1α in T98G cells treated with hypoxia and normoxic for 24 h
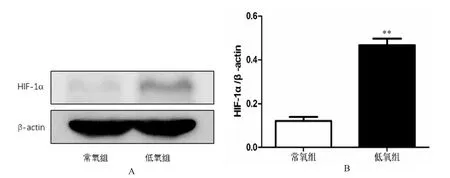
圖4 T98G 細胞在低氧和常氧下處理24 h 后Western blot 檢測HIF-1α 表達水平Fig.4 HIF-1α expression level of T98G cells by Western blot 24 h after hypoxic and normoxic treatment
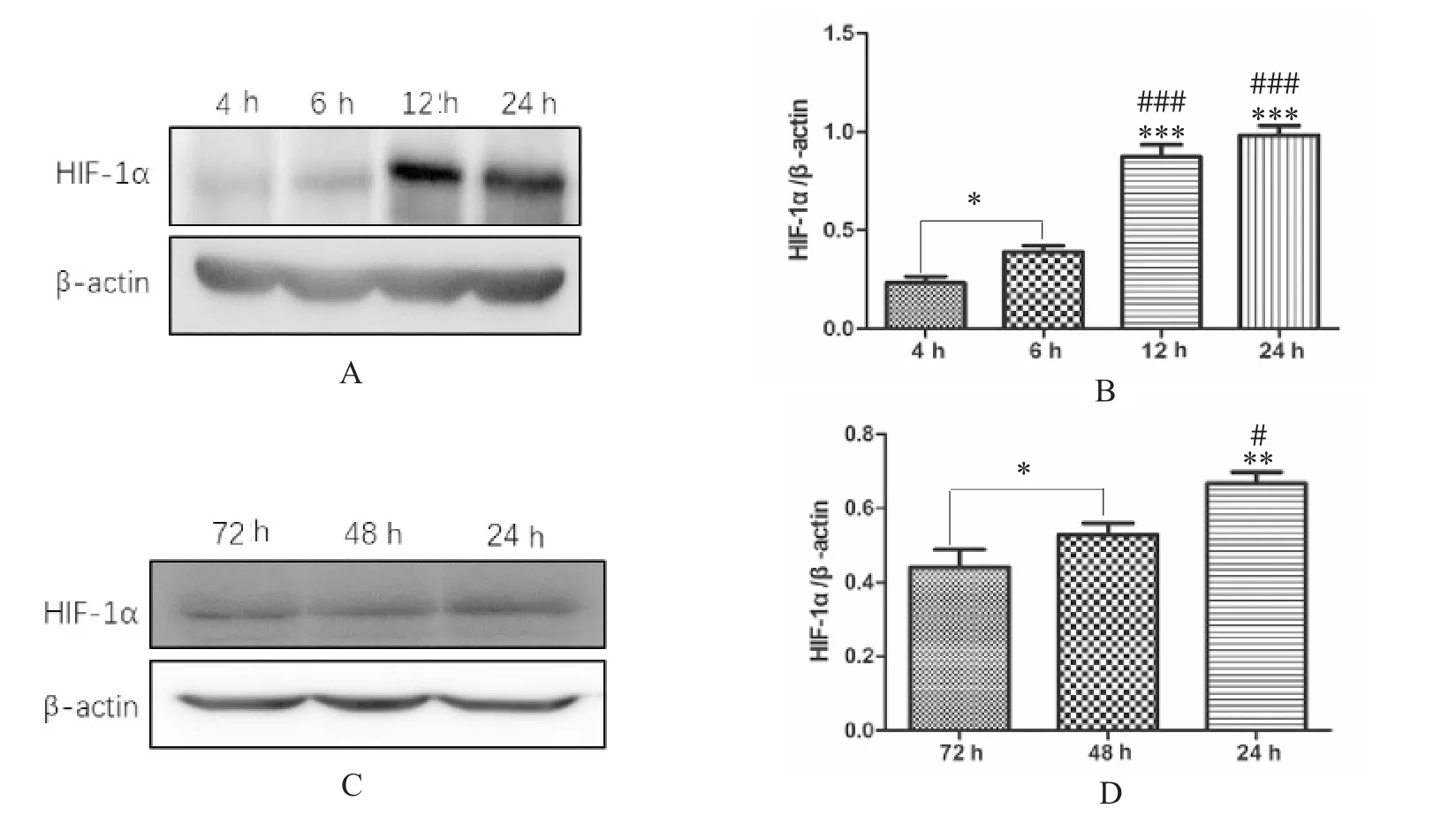
圖5 T98G 細胞在低氧條件下不同時間段(4、6、12、24、48、72 h) HIF-1α 的表達水平Fig.5 HIF-1α expression in T98G cells at 4 h,6 h,12 h,24 h,48 h and 72 h under hypoxia
2.5 低氧條件下不同細胞密度對HIF-1α 表達的影響
根據Western blot 結果提示(圖6):低氧下T98 G 細胞中HIF-1α 的表達會受到細胞密度變化的影響,其中在高細胞密度(8.5 萬/cm2,其細胞匯合度約為95%) 表達量最高,密度過高或過低HIF-1α 蛋白表達均會降低。
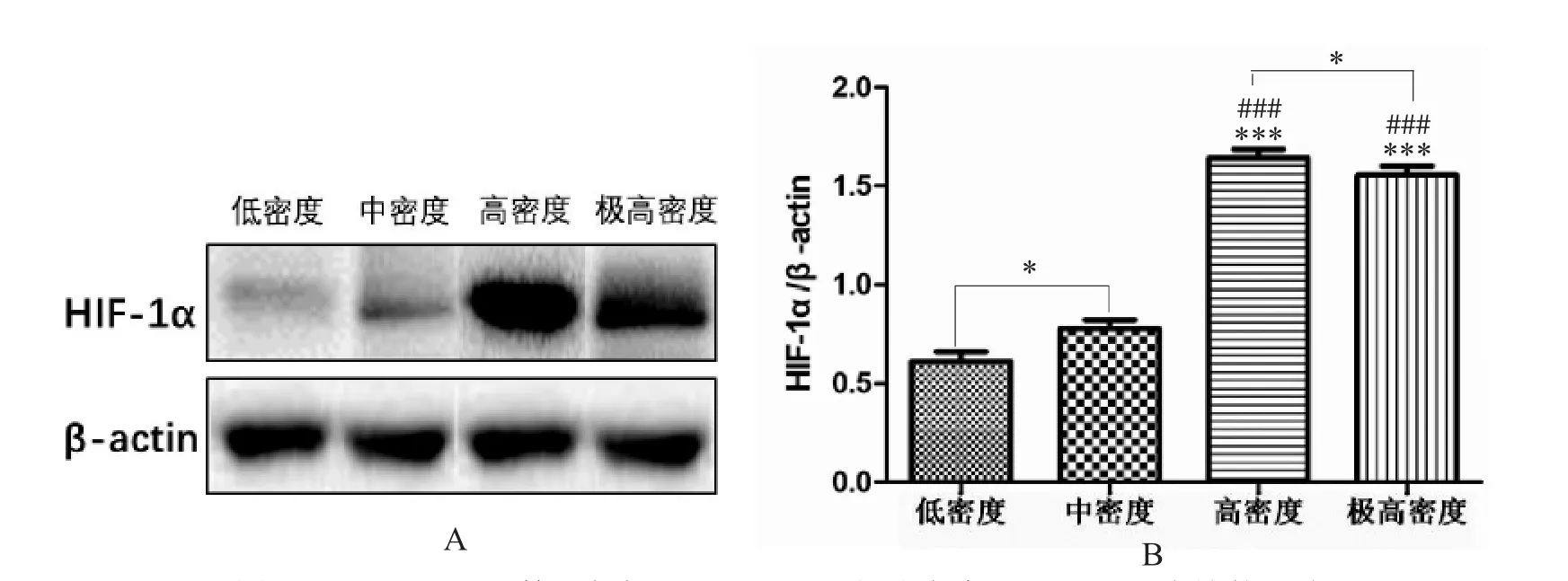
圖6 Western blot 檢測低氧下不同T98G 細胞密度對HIF-1α 表達的影響Fig.6 Effect of different T98G cell densities on HIF-1α expression under hypoxia by Western blot
3 討論
如同大多數實體腫瘤一樣,膠質瘤的生長速度遠快于腫瘤血管的生成速度,導致腫瘤細胞局部微環境中氧含量及營養物質的缺乏[5]。在氧含量及營養不足的情況下,低氧誘導一系列適應性反應,使腫瘤細胞得以在缺氧微環境中保持存活并增殖[6]。目前膠質瘤的缺血、缺氧和再復氧體內外模型能充分模擬細胞生長的低氧微環境,本研究在三氣培養箱中通過調控腦膠質瘤細胞株T98G 的培養氧濃度從而觀察其生長反應。
局部缺氧導致的一系列鏈式反應是造成腫瘤惡性發展和治療抵抗的重要原因。多形性膠質母細胞瘤(GBM) 通過快速表低氧誘導因子-1(HIF-1)激活一系列適應性分子機制,以應對細胞中氧環境的變化[7]。HIF 是由一個結構型表達的HIF-1β 亞基和一個O2調節亞基(HIF-1α、HIF-2α 和HIF-3α) 構成的異源二聚體,在組織處于低氧時HIF-1α 不發生降解并與β 亞基配合構成功能轉錄因子[8]。在基因水平上HIF-1α 是氧敏感轉錄激活因子,通過結合靶基因啟動子內的DNA 共有序列(缺氧應答元件HRE) 而發生反式激活,HIF-1α 的激活會促進參與細胞自主及非自主適應缺氧的數百種基因發生表達[9]。即使微環境中氧含量正常時,HIF-1α 也經常通過癌基因激活和/或抑癌基因抑制在癌細胞中被激活[10]。研究證明HIF-1α 在GBM 的發展和進展中起著關鍵作用,調控細胞血管生成、侵襲和轉移等癌變過程中所涉及的許多基因[11]。
缺氧激活HIF-1α 的表達可導致糖酵解的氧化磷酸化(OXPHOS) 轉向無氧糖酵解的基因發生改變,這種轉變也是GBM 的代謝特點[12]。缺氧時HIF-1 通過降低線粒體功能,減少電子傳遞鏈的電子泄漏,防止ROS 的過度產生,以確保GBM細胞在缺氧環境中的存活并增殖[13]。因此,HIF-1α 在控制GBM 有氧糖酵解以滿足其高能量消耗的同時,還在防止缺氧所致的損傷方面起著重要的調節作用。HIF-1α 的穩定表達引發與無氧糖酵解相關的一系列酶增多,導致周圍組織乳酸水平升高、細胞外環境酸化,進一步激活與腫瘤增殖相關的信號通路[14]。致癌信號通路的激活在轉錄水平上促進了HIF-1α 表達[15]。依據GBM 偏愛糖酵解作為能量代謝的特點,靶向HIF-1α 的研究可能為膠質瘤的治療提供機會。基于上述原理,本實驗通過三氣培養箱來檢測T98G 細胞在1%O2的低氧濃度下的增殖與凋亡情況。通過實驗觀察到缺氧(1%O2)培養環境不能誘導T98G 細胞發生明顯的凋亡;在低氧微環境(1% O2) 中,T98G 細胞HIF-1α 的蛋白表達不是恒定不變的,其表達量與缺氧時間及細胞密度密切相關。
綜上所述,通過本研究可以初步推斷缺氧微環境對腦膠質瘤T98G 細胞增殖、凋亡的影響,以及不同細胞生長階段和生長密度對HIF-1α 表達的影響。低氧環境對膠質瘤細胞的影響尚需更多研究證明,HIF-1α 的研究能進一步闡明其代謝途徑和調控凋亡對膠質瘤細胞的作用機制,促進以HIF-1α 為靶點的GBM治療研究。

