氯代芳烴的偶聯反應在工業化中間體合成中的應用
李寶巖 汪余 劉凱泓 劉國華 金榮華

摘 ?要: 近年來,氯代芳烴的偶聯反應在天然產物、生物活性物質、醫藥、殺菌劑等中間體的合成中得到了廣泛使用,這為它們的工業化生產提供了可能.簡述了氯代芳烴的Suzuki偶聯、Heck偶聯和Sonogashira偶聯反應在工業化中間體合成中的幾個應用實例.
關鍵詞: 氯代芳烴; Suzuki偶聯; Heck偶聯; Sonogashira偶聯; 工業化中間體
中圖分類號: TQ 32.41 ? ?文獻標志碼: A ? ?文章編號: 1000-5137(2020)04-0433-10
Abstract: Recently,the coupling reactions of aryl chlorides have been widely used in the syntheses of intermediates for natural products,bioactive substances,pharmaceuticals,fungicides etc.,which provides the possibility for their industrial production.This review summarizes some synthetic applications of coupling reactions with aryl chlorides,such as Suzuki coupling,Heck coupling,Sonogashira coupling reactions reported in the literatures.
Key words: aryl chloride; Suzuki coupling; Heck coupling; Sonogashira coupling; industrial intermediate
0 ?引 ?言
近年來,鹵代芳烴或者烯烴與親核性碳原子或者雜原子之間的催化偶聯反應,是有機化學研究中的重要成就,并為社會帶來了顯著的經濟效益[1-2],如圖1所示.
對于鹵代芳烴,大多使用溴代和碘代化合物,很少用氯代芳烴化合物.這是因為氯代芳烴的反應活性比相應的溴代和碘代芳烴低很多 (C-Cl,C-Br,C-I鍵能分別是402,339,272 kJ·mol-1),在相同的條件下反應不容易進行,收率比較低.但是氯代芳烴在工業上廉價易得,因此研究氯代芳烴的偶聯反應具有非常重要的現實意義.
鹵代芳烴的鈀(Pd)催化偶聯反應具有化學反應活性較好、區域選擇性較高,以及反應條件溫和等優點[3-6].一些條件極為苛刻并難以實現的有機化學反應,因有過渡金屬絡合物的參與而變得極其容易進行,所以過渡金屬催化的偶聯反應在有機合成中的應用越來越受到人們的重視,并廣泛應用于工業規模的合成中.其中Suzuki,Heck,Sonogashira偶聯反應被認為是工業有機合成中最重要的反應[7-8].許多鈀-膦配合物中的配體具有以下缺點:對空氣和水較敏感;配體需要多步反應來合成;使用多種添加劑和有毒有害溶劑;產物和催化劑分離、回收和再利用困難;需要使用貴金屬Pd作為催化劑活性組分等[9-12].因此,在Pd催化的氯代芳烴偶聯反應中,開發高性能催化劑,進行可持續和環境友好的反應是目前面臨的最大挑戰[13].
氯代芳烴的Suzuki,Heck,Sonogashira偶聯反應是一類經典的形成碳碳(C-C)鍵的反應,近年來,通過多方面的探索與研究,已經取得了一些重要進展,其中主要包括了反應的進一步優化、聯串化、綠色化以及非催化等[14],這些進展對于許多實驗室乃至工業合成有著重要的科學和經濟價值.本文作者主要綜述了氯代芳烴的Suzuki,Heck,Sonogashira偶聯反應在工業化中間體合成中的一些應用研究.
1 ?氯代芳烴的Suzuki偶聯反應在工業化中間體合成中的應用
1979年MIYAURA等[15]報道了在Pd催化劑條件下鹵代芳烴與苯硼酸的合成反應.Suzuki偶聯反應通常是指鹵代芳烴與有機硼試劑進行的交叉偶聯,芳烴上的取代基通常是鹵素,也可以是三氟甲基磺酸基、甲基磺酸基等,有機硼試劑的優點是無毒,對空氣穩定而且易得,同時兼容反應物上共存的多種官能團,因此被廣泛應用,反應通式如圖2所示.
由于具有反應條件溫和、官能團容忍性好、產物收率高等特點,此反應已成為工業化有機合成中不可缺少的一個手段[16].下面介紹氯代芳烴的Suzuki偶聯反應在工業化中間體合成中應用的幾個例子.
1.1 p38促細胞分裂活性蛋白(MAP)激酶抑制劑的合成
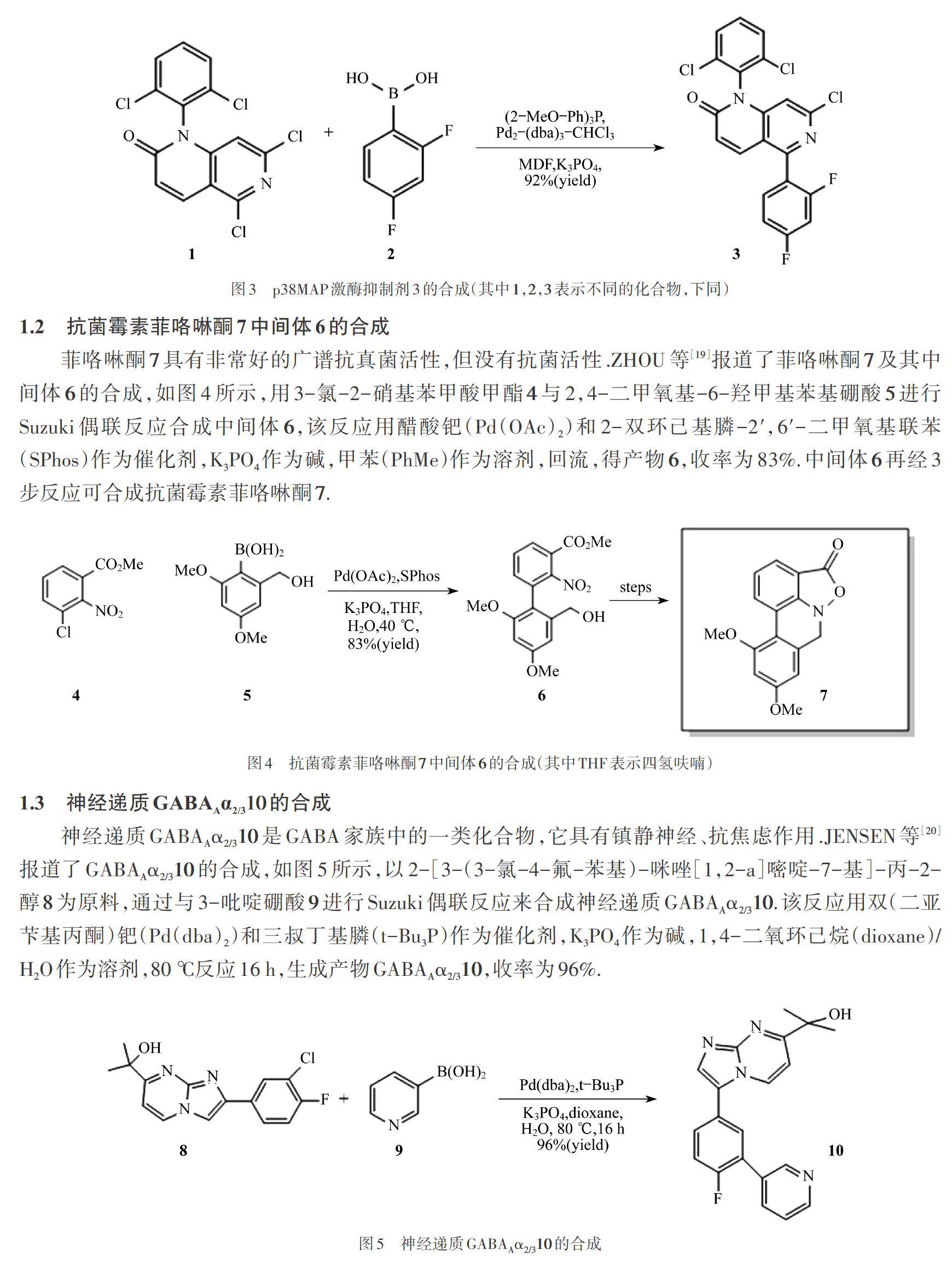
CAI等[17-18]以5,7-二氯-1,6-二氮雜萘-2-酮1為原料,通過Suzuki偶聯反應與2,4-二氟苯基硼酸2合成p38 MAP激酶抑制劑3,如圖3所示.該反應以三(二亞芐基丙酮)二鈀(0)-氯仿復合物(Pd2-(dba)3-CHCl3)和三甲氧基苯基磷((2-MeO-Ph)3P)作為催化劑(其中,dba表示二亞芐基丙酮,Me代表甲基,Ph代表苯基),二甲基甲酰胺(DMF)作為溶劑,K3PO4作為堿,偶聯反應產物p38 MAP激酶抑制劑3的收率可達92%.
1.2 抗菌霉素菲咯啉酮7中間體6的合成
菲咯啉酮7具有非常好的廣譜抗真菌活性,但沒有抗菌活性.ZHOU等[19]報道了菲咯啉酮7及其中間體6的合成,如圖4所示,用3-氯-2-硝基苯甲酸甲酯4與2,4-二甲氧基-6-羥甲基苯基硼酸5進行Suzuki偶聯反應合成中間體6,該反應用醋酸鈀(Pd(OAc)2)和2-雙環己基膦-2',6'-二甲氧基聯苯(SPhos)作為催化劑,K3PO4作為堿,甲苯(PhMe)作為溶劑,回流,得產物6,收率為83%.中間體6再經3步反應可合成抗菌霉素菲咯啉酮7.
1.3 神經遞質GABAAα2/310的合成
神經遞質GABAAα2/310是GABA家族中的一類化合物,它具有鎮靜神經、抗焦慮作用.JENSEN等[20]報道了GABAAα2/310的合成,如圖5所示,以2-[3-(3-氯-4-氟-苯基)-咪唑[1,2-a]嘧啶-7-基]-丙-2-醇8為原料,通過與3-吡啶硼酸9進行Suzuki偶聯反應來合成神經遞質GABAAα2/310.該反應用雙(二亞芐基丙酮)鈀(Pd(dba)2)和三叔丁基膦(t-Bu3P)作為催化劑,K3PO4作為堿,1,4-二氧環己烷(dioxane)/H2O作為溶劑,80 ℃反應16 h,生成產物GABAAα2/310,收率為96%.
1.4 NK1受體拮抗劑藥效團中間體2-苯基-3-氨基吡啶14的合成
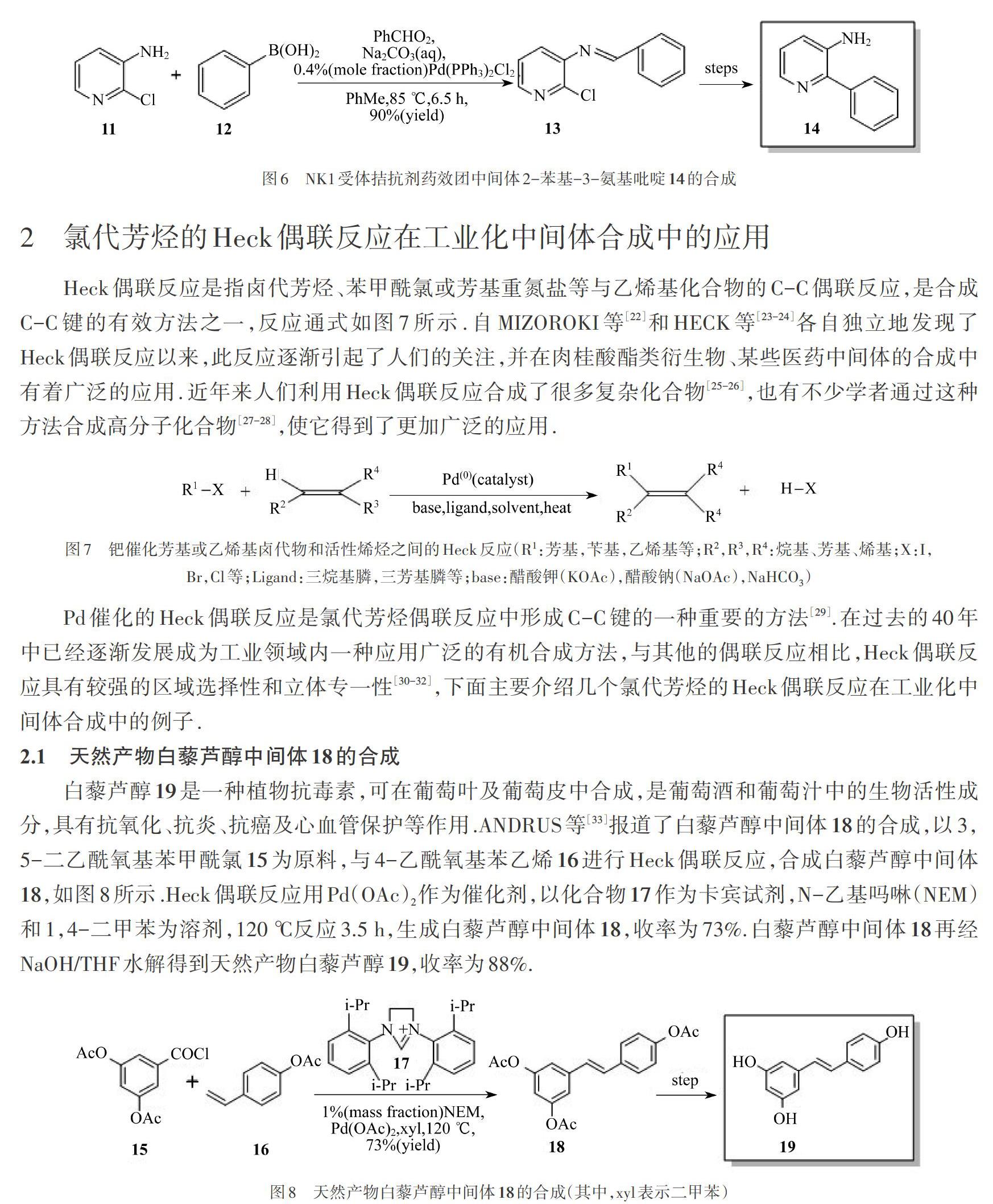
2-苯基-3-氨基吡啶14是合成3-氨基-2-苯基哌啶類NK1受體拮抗劑藥效團的關鍵中間體,CARON等[21]報道了2-苯基-3-氨基吡啶14的合成方法,如圖6所示,以2-氯-3-氨基吡啶化合物11為原料,首先用苯甲醛進行氨基保護生成烯胺化合物,再通過與苯硼酸12進行Suzuki偶聯反應生成中間體13,該Suzuki偶聯反應用雙三苯基磷二氯化鈀(Pd(PPh3)2Cl2)作為催化劑,Na2CO3作為堿(aq表示水溶液),PhMe作為溶劑,85 ℃反應6.5 h,生成化合物13,收率為90%,化合物13經水解生成2-苯基-3-氨基吡啶14.
2 ?氯代芳烴的Heck偶聯反應在工業化中間體合成中的應用
Heck偶聯反應是指鹵代芳烴、苯甲酰氯或芳基重氮鹽等與乙烯基化合物的C-C偶聯反應,是合成C-C鍵的有效方法之一,反應通式如圖7所示.自MIZOROKI等[22]和HECK等[23-24]各自獨立地發現了Heck偶聯反應以來,此反應逐漸引起了人們的關注,并在肉桂酸酯類衍生物、某些醫藥中間體的合成中有著廣泛的應用.近年來人們利用Heck偶聯反應合成了很多復雜化合物[25-26],也有不少學者通過這種方法合成高分子化合物[27-28],使它得到了更加廣泛的應用.
Pd催化的Heck偶聯反應是氯代芳烴偶聯反應中形成C-C鍵的一種重要的方法[29].在過去的40年中已經逐漸發展成為工業領域內一種應用廣泛的有機合成方法,與其他的偶聯反應相比,Heck偶聯反應具有較強的區域選擇性和立體專一性[30-32],下面主要介紹幾個氯代芳烴的Heck偶聯反應在工業化中間體合成中的例子.
2.1 天然產物白藜蘆醇中間體18的合成
白藜蘆醇19是一種植物抗毒素,可在葡萄葉及葡萄皮中合成,是葡萄酒和葡萄汁中的生物活性成分,具有抗氧化、抗炎、抗癌及心血管保護等作用.ANDRUS等[33]報道了白藜蘆醇中間體18的合成,以3,5-二乙酰氧基苯甲酰氯15為原料,與4-乙酰氧基苯乙烯16進行Heck偶聯反應,合成白藜蘆醇中間體18,如圖8所示.Heck偶聯反應用Pd(OAc)2作為催化劑,以化合物17作為卡賓試劑,N-乙基嗎啉(NEM)和1,4-二甲苯為溶劑,120 ℃反應3.5 h,生成白藜蘆醇中間體18,收率為73%.白藜蘆醇中間體18再經NaOH/THF水解得到天然產物白藜蘆醇19,收率為88%.
2.2 前列腺素Beraprost中間體23的合成
前列腺素Beraprost是一類口服活性抗血栓和臨床抗血小板的前列腺素藥,它既是一種有效的血管擴張劑,又是一種血小板凝聚抑制劑.中間體23是合成Beraprost的關鍵中間體,HIGUCHI等[34]報道了前列腺素Beraprost關鍵中間體23的合成.首先用芐氯衍生物20和烯丙酸甲酯21的Heck偶聯反應,合成Beraprost重要中間體22,如圖9所示.反應用Pd(OAc)2作為催化劑,(n-C12H25)3N作為堿,反應5 h后,以94%的收率生成Beraprost中間體22,再在甲醇中用5%(質量分數)Pd/C催化劑進行催化氫化還原反應生成Beraprost關鍵中間體23,收率為96%.
2.3 血小板衍生生長因子受體(PDGFR)激酶中間體26的合成
PDGFR為血小板衍生生長因子蛋白質家族的受體,位于細胞膜表面,屬于酪胺酸激酶受體的一種,它在調控細胞增殖、分化、生長、發育上扮演著相當重要的角色.如果調控不正常,可能會引發癌癥等多種疾病.HICKEN等[35]報道了PDGFR激酶關鍵中間體26和各種PDGFR激酶的合成,測試了它們的生理活性和毒性.首先用咪唑吡啶衍生物24為原料,通過與2-氯-8-芐氧基喹啉25進行Heck偶聯反應,合成關鍵中間體26,再經過多步反應合成PDGFR激酶之一的產物27,如圖10所示.中間體26的合成采用Pd(PPh3)4和Pd(OAc)2作為催化劑,K2CO3作為堿,1,4-二氧環己烷/H2O作為溶劑,再在Pd(OH)2/C,MeOH,HCO2NH4回流條件下獲得PDGFR激酶關鍵中間體26,2步的總收率為83%.
3 ?氯代芳烴的Sonogashira偶聯反應在工業化中間體合成中的應用
1975年,SONOGASHIRA等[36]報道了對稱性取代炔的制備方法.反應在溫和條件下和乙炔氣體中進行,用催化量的Pd (PPh3)Cl2和CuI使乙炔和芳基碘或乙烯溴反應.同年,CASSAR[37]和DIECK等[38]兩個研究組各自獨立地展開了相似的Pd催化反應,但如果不用輔助催化劑,反應條件要求較高,難以達到目標.用Pd-Cu催化使末端炔烴與芳基鹵代物及乙烯基鹵代物作用得到烯烴或炔烴的方法稱為Sonogashira交叉偶聯反應,反應通式如圖11所示.
Sonogashira偶聯反應經過40多年的發展,已經逐漸為人們所熟悉,而且也成為了一個重要的人名反應.目前,Sonogashira偶聯反應在取代炔烴以及大共軛炔烴的合成中得到了廣泛的應用,已經在許多天然化合物、農藥、醫藥、新興材料等的合成中起著重要的作用[39].下面介紹的幾個例子都是以氯代芳烴為反應原料通過Sonogashira偶聯反應合成可能有工業化前景的中間體及其產物.
3.1 TRPV1受體拮抗劑中間體31的合成
TRPV1受體拮抗劑是一類配體門控非選擇性陽離子信道,這一信道存在于中樞神經系統及末梢神經系統上,并且對痛覺進行傳遞和調節,以及集成各種疼痛信息.YU等[40]報道了TRPV1受體拮抗劑32中間體31的合成,如圖12所示,首先用2-氯-4-三氟甲基苯腈28為原料,通過與3,3-二甲基-1-丁炔29進行Sonogashira偶聯反應合成關鍵中間體31,反應采用Pd2(dba)3作為催化劑,碘化亞銅(CuI)為助催化劑,把2-二環己膦基-2'-(N,N-二甲胺)-聯苯(C26H36NP)30溶解于三乙胺(Et3N)中,65 ℃反應,中間體31收率大于95%,再經過多步反應合成TRPV1受體拮抗劑32.
3.2 天然生物堿Mappicine中間體35的合成
天然生物堿Mappicine36是喜樹堿家族中的一個,具有優良的抗癌活性,尤其對消化道腫瘤、白血病、膀胱癌等活性更強,從而引起了人們的廣泛關注.TOYOTA等[41]采用2-氯-3-羥甲基喹啉33為原料,通過與三甲基硅基乙炔34進行Sonogashira偶聯反應來合成重要的中間體35,如圖13所示.該反應采用Pd(PPh3)2Cl2作為催化劑,CuI為助催化劑,Et3N作為堿,DMF作為溶劑,室溫反應1 h,獲得了中間體化合物35,收率達98%,化合物35再經過幾步反應就可獲得天然生物堿Mappicine36.
3.3 肌纖維蛋白類似物中間體39的合成
肌纖維蛋白類似物40是一類具有抗有絲分裂的,抑制細胞生長的活性物質.HOCEK等[42]采用2,6-二氯-9-異丙基嘌呤37為原料,通過與(4-甲氧基苯基)乙炔38進行Sonogashira偶聯反應來合成中間體39.該反應采用Pd(PPh3)4作為催化劑,CuI為助催化劑,Et3N作為堿,DMF作為溶劑,所得化合物39的收率為39%,再經過Pd/C催化加氫就可以獲得肌纖維蛋白類似物40,如圖14所示.
3.4 高不飽和吡喃酮衍生物中間體42的合成
高不飽和吡喃酮衍生物43是擔子菌類的代謝物,它具有很好的抗菌、抗真菌、抗腫瘤活性.BIAGETTI等[43]采用6-氯-2(2H)-吡喃酮41為原料,通過與三甲基硅基乙炔34進行Sonogashira偶聯反應來合成重要的中間體42,如圖15所示.該反應采用Pd(PPh3)4作為催化劑,CuI為助催化劑,Et3N作為堿,苯作為溶劑,室溫反應,獲得了中間體42,收率達85%,中間體42再經過多步反應就可獲得高不飽和吡喃酮衍生物43[44].
3.5 熒光探針化合物46的合成
熒光探針化合物46是具有共軛供體—受體—供體的二氮雜萘的熒光探針分子,具有對Hg2+優良的檢測性能,化合物46與Hg2+作用會發生熒光顏色變化,可以用來檢測單糖化合物.HUANG等[45]用炔基苯胺化合物44與2,7-二氯-1,8-二氮雜萘化合物45進行Sonogashira偶聯反應來合成熒光探針化合物46,如圖16所示.該反應采用Pd(PPh3)2Cl2作為催化劑,CuI為助催化劑,Et3N作為堿,DMF作為溶劑,80 ℃反應18 h,得到熒光探針化合物46,收率達77%.
4 ?展 ?望
氯代芳烴的Suzuki,Heck,Sonogashira偶聯反應在工業合成中已有廣泛的應用.雖然這些偶聯具有反應條件溫和、選擇性良好、環境友好等優點,但是氯代芳烴的反應活性差,它的偶聯反應的研究還有很長道路要走.將來希望能夠:1) 制備出負載型的Pd非均相催化劑,使催化劑在偶聯反應中能重復使用,延長催化劑的壽命;2) 開發出更多高效的催化劑和廉價的金屬催化劑,降低催化劑的成本;3) 利用這些偶聯反應合成更多有用的天然有機化合物和藥物等,為創造更高的社會經濟效益和人類的健康作出更多貢獻.
參考文獻:
[1] BARANANO D,MANN G,HARTWIG J F.Nickel and palladium-catalyzed cross-couplings that form carbon-heteroatom and carbon-element bonds [J].Current Organic Chemistry,1997,4(29):287-305.
[2] TYKWINSKI R R.Evolution in the palladium-catalyzed cross-coupling of sp- and sp2- hybridized carbon atoms [J].Angewandte Chemie,2003,42(14):1566-1568.
[3] BARDER T E,BISCOE M R,BUCHWALD S L.Structural insights into active catalyst structures and oxidative addition to (Biaryl) phosphine-palladium complexes via density functional theory and experimental studies [J].Organometallics,2007,26(9):2183-2192.
[4] MURATA M,OYAMA T,WATANABE S,et al.Palladium-catalyzed borylation of aryl halides or triflates with dialkoxyborane: a novel and facile synthetic route to arylboronates [J].The Journal of Organic Chemistry,2000,65(1):164-168.
[5] ISHIYAMA T,MIYAURA N.Chemistry of group 13 element-transition metal linkage:the platinum-and palladium-catalyzed reactions of (alkoxo) diborons [J].Journal of Organometallic Chemistry,2000,611(1):392-402.
[6] MOLANDER G A,TRICE S L J,DREHER S D.Palladium-catalyzed,direct boronic acid synthesis from aryl chlorides: a simplified route to diverseboronate ester derivatives [J].Journal of the American Chemical Society,2010,132(50): 17701-17703.
[7] SHAUGHNESSY K H,KIM P,HARTWIG J F.A fluorescence-based assay for high-throughput screening of coupling reactions:application to Heck chemistry [J].Journal of the American Chemical Society,1999,121(10):2123-2132.
[8] BARDER T E,WALKER S D,MARTINELLI J R,et al.Catalysts for Suzuki-Miyaura coupling processes: scope and studies of the effect of ligand structure [J].Journal of the American Chemical Society,2005,127(13):4685-4696.
[9] KWON M S,KIM N,PARK C M,et al.Palladium nanoparticles entrapped in aluminum hydroxide: dual catalyst for alkene hydrogenation and aerobic alcohol oxidation [J].Organic Letters,2005,7(6):1077-1079.
[10] YOON B,WAI C M.Microemulsion-templated synthesis of carbon nanotube-supported Pd and Rh nanoparticles for catalytic applications [J].Journal of the American Chemical Society,2005,127(49):17174-17175.
[11] HAGIWARA H,SUGAWARA Y,HOSHI T,et al.Sustainable Mizoroki-Heck reaction in water: remarkably high activity of Pd (OAc)2 immobilized on reversed phase silica gel with the aid of an ionic liquid [J].Chemical Communications,2005,2005(23):2942-2944.
[12] LU S M,ALPER H.Intramolecular carbonylation reactions with recyclable palladium-complexed dendrimers on silica: synthesis of oxygen,nitrogen,or sulfur-containing medium ring fused heterocycles [J].Journal of the American Chemical Society,2005,127(42):14776-14784.
[13] HAMASAKA G,ICHII S,UOZUMI Y.A palladium NNC-Pincer complex as an efficient catalyst precursor for the Mizoroki-Heck reaction [J].Advanced Synthesis & Catalysis,2018,360(9):1833-1840.
[14] BARAN T.Biosynthesis of highly retrievable magnetic palladium nanoparticles stabilized on bio-composite for production of various biarylcompounds and catalytic reduction of 4-Nitrophenol [J].Catalysis Letters,2019,149(6):1721-1729.
[15] MIYAURA N,SUZUKI A.Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst [J].Journal of the American Chemical Society,1979,11(7):866-867.
[16] MARTIN R,BUCHWALD S L.Palladium-catalyzed Suzuki-Miyaura cross-coupling reactions employing dialkylbiaryl phosphine ligands [J].Accounts of Chemical Research,2008,41(11):1461-1473.
[17] CAI C,CHUNG J Y L,MCWILLIAMS J C,et al.From high-throughput catalyst screening to reaction optimization:detailed investigation of regioselectivesuzuki coupling of 1,6-Naphthyridone Dichloride [J].Organic Process Research & Development,2007,11(3):328-335.
[18] CHUNG J Y L,CAI C,MCWILLIAMS J C,et al.Efficient synthesis of a trisubstituted 1,6-naphthyridone from acetonedicarboxylate and regioselective suzukiarylation [J].Journal of Organic Chemistry,2005,70(25):10342-10347.
[19] ZHOU Q,SNIDER B B.Synthesis of the isoxazolo [4,3,2-de] phenanthridinone moiety of the parnafungins [J].Organic Letters,2009,11(13):2936-2939.
[20] JENSEN M S,HOERMER R S,LI W,et al.Efficient synthesis of a GABAA α2,3-selective allosteric modulator via a sequential Pd-catalyzed cross-coupling approach [J].Journal of Organic Chemistry,2005,70(15):6034-6039.
[21] CARON S,MASST S S,BOGL D E,et al.An efficient and cost-effective synthesis of 2-phenyl-3-aminopyridine [J].Organic Process Research & Development,2001,5(3):254-256.
[22] MIZOROKI T,MORI K,OZAKI A.Arylation of olefin with aryl iodide catalyzed by palladium [J].Bulletin of the Chemical Society of Japan,1971,44(2):581.
[23] HECK R F.Acylation,methylation,and carboxyalkylation of olefins by group VIII metal derivatives [J].Journal of the American Chemical Society 1968,90 (20):5518-5526.
[24] HECK R F,NOLLEY J P,Jr.Palladium-catalyzed vinylic hydrogen substitution reactions with aryl,benzyl,and styryl halides [J].Journal of Organic Chemistry,1972,37(14):2320-2322.
[25] FERRACCIOLI R,CARENZI D.One-pot synthesis of 3,4-dihydro-2(1H)-quinazolinones through palladium-catalyzed intramolecular arylation of ureas [J].Synthesis,2003,2003(9):1383-1386.
[26] AMENGUAL R,GENIN E,MICHELET V,et al.Convenient synthesis of new anionic water-soluble phosphanes and applications in inter-and intramolecular Heck reactions [J].Advanced Synthesis & Catalysis,2002,344(3):393-398.
[27] YANG N C,SUH D H.Synthesis of a new polyarylenvinylene derivative based on a terstyryl group linked by a maleimide group [J].Polymer Bulletin,2001,46(1):29-35.
[28] SCHLICK H,STELZER F,LEISING G.Chemical and optical properties of new highly luminescent alternating oligo-m,p-phenylenevinylenes [J].Monatshefte Fur Chemie,2001,132(4):21-32.
[29] JOUCLA L,CUSATI G,PINEL C,et al.One-pot Suzuki/Heck sequence for the synthesis of (E)-stilbenes featuring a recyclable silica-supported palladium catalyst via a multi-component reaction in 1,3-propanediol [J].Advanced Synthesis & Catalysis,2010,352(11):1993-2001.
[30] HECK R F,NOLLEY J P,Jr.Palladium-catalyzed vinylic hydrogen substitution reactions with aryl,benzyl,and styrylhalides [J].Journal of Organic Chemistry,1972,37(14):2320-2322.
[31] MOLNAR A.Palladium-catalyzed coupling reactions:practical aspects and future developments [J].Platinum Metals Review,2014,58(2):93-98.
[32] WU X F,ANBARASAN P,NEUMANN H,et al.From noble metal to Nobel prize:palladium‐catalyzed coupling reactions as key methods in organic synthesis [J].Angewandte Chemie,2010,49(48):9047-9050.
[33] ANDRUS M B,LIU J,MEREDITH E L,et al.Synthesis of resveratrol using a direct decarbonylative Heck approach from resorcylicacid [J].Tetrahedron Letters,2003,44(26):4819-4822.
[34] HIGUCHI K,SAWADA K,NAMBU H,et al.A convenient synthesis of the beraprost intermediate: a useful method for introducing a C3 unit at the benzyl position[J].Organic Letters,2003,5(20): 3703-3704.
[35] HICKEN E J,MARMSATER F P,MUNSON M C,et al.Discovery of a novel class of imidazo [1,2-a] pyridines with potent PDGFR activity and oral bioavailability [J].ACS Medicinal Chemistry Letters,2014,5(1):78-83.
[36] SONOGASHIRA K,TOHDA Y,HAGIHARA N.A convenient synthesis of acetylenes:catalytic substitutions of acetylenic hydrogen with bromoalkenes,iodoarenes and bromopyridines [J].Tetrahedron Letters,1975,16(50):4467-4470.
[37] CASSAR L.Synthesis of aryl-and vinyl-substituted acetylene derivatives by the use of nickel and palladium complexes [J].Journal of Organometallic Chemistry,1975,93(2):253-257.
[38] DIECK H A,HECK F R.Palladium catalyzed synthesis of aryl,heterocyclic and vinylic acetylene derivatives [J].Journal of Organometallic Chemistry,1975,93(2):259-263.
[39] CHINCHILLA R,NAJERA C.Recent advances in Sonogashirareactions [J].Chemical Society Reviews,2011,40(10): 5084-5121.
[40] YU S,HAIGHT A,KOTECKI B,et al.Synthesis of a TRPV1 receptor antagonist [J].Journal of Organic Chemistry,2009,74(24):9539-9542.
[41] TOYOTA M,KOMORI C,IHARA M.A.Concise formal total synthesis of mappicine and nothapodytine B via an intramolecular Hetero Diels-Alder Reaction [J].The Journal of Organic Chemistry,2000,65(21):7110-7113.
[42] HOCEK M,VOTRUA I,DVOAOVA H.Synthesis of carba-analogues of myoseverin by regioselective cross-coupling reactions of 2,6-dichloro-9-isopropylpurine [J].Tetrahedron,2003,59(5):607-611.
[43] BIAGETTI M,BELLINA F,CARPITA A,et al.6-Chloro-2(2H)-pyranone:a new 2(2H)-pyranonesynthon[J].Tetrahedron Letters,2003,44(3):607-610.
[44] BELLINA F,CARPITA A,MANNOCCI L,et al.First total synthesis of naturally occurring (-)-nitidonand its enantiomer [J].European Journal of Organic Chemistry,2004,2004(12):2610-2619.
[45] HUANG J H,WEN W H,SUN Y Y,et al.Two-stage sensing property via a conjugated donor-acceptor-donor constitution:application to the visual detection of mercuric ion [J].Journal of Organic Chemistry,2005,70(15):5827-5832.
(責任編輯:郁 ?慧,包震宇)

