氫化可的松對中暑大鼠去甲腎上腺素低反應性及炎癥反應的影響
張明,陳懷生,李悅,楊經文,施學智,梁泳欣,童華生*
1廣州醫科大學附屬第六醫院/清遠市人民醫院重癥醫學科一區,廣東清遠 511500;2南方科技大學第一附屬醫院/暨南大學第二臨床醫學院/深圳市人民醫院重癥醫學科,廣東深圳 518020;3南部戰區總醫院重癥醫學科/解放軍熱區損傷與組織修復重點實驗室,廣州 510010
循環衰竭是重癥中暑常見的臨床表現,它可能是患者的首發癥狀,也可能是由其他臟器衰竭所致[1-2]。中暑直接導致無基礎病的心臟發生泵衰竭的概率并不大,其循環衰竭難以簡單地通過心功能損傷來解釋[3]。另外,盡管熱打擊后內源性的兒茶酚胺大量分泌,維持中暑患者循環功能仍常須依賴縮血管藥物[4-5],預示重癥中暑患者存在著對縮血管藥物的低反應性,這可能是中暑循環衰竭的致病機制之一。在重癥中暑的研究中,作為與其相似的炎癥反應性疾病,膿毒癥休克的研究經驗常被借鑒。膿毒癥休克同樣伴隨著對縮血管藥物的低反應性,有研究指出,氫化可的松可作為增加該反應性的輔助藥物[6]。然而,至今鮮有研究報道血管反應性的改變,亦無氫化可的松的應用經驗,該藥物對血管反應性的影響仍不明確。本研究觀察了氫化可的松對去甲腎上腺素升血壓效應等的影響,探討其對縮血管藥物的效應及其對炎癥反應的影響。
1 材料與方法
1.1 主要試劑 氫化可的松購自華中藥業股份有限公司,去甲腎上腺素購自中國遠大醫藥公司。一氧化氮(nitric oxide,NO)檢測試劑盒購自碧云天生物技術公司,前列腺素E2(prostaglandin E2,PGE2)、皮質醇、促腎上腺皮質激素(adrenocorticotropic hormone,ACTH)、核因子κB(nuclear factor kappa-B,NF-κB)、腫瘤壞死因子-α(tumor necrosis factor,TNF-α)、白細胞介素1β(interleukin-1β,IL-1β)ELISA檢測試劑盒購自云克隆科技股份有限公司。
1.2 中暑大鼠模型的構建及分組 健康雄性SPF級SD大鼠96只,體重220~250 g,購自南方醫科大學動物實驗中心,實驗流程經南部戰區總醫院實驗動物倫理委員會審批通過。實驗前大鼠常規飼養在溫度(23±1) ℃、濕度50%±5%的環境中。實驗開始時,將大鼠用3%戊巴比妥(30 mg/kg)施行腹腔注射麻醉,再行頸動脈置管接壓力傳感器監測動脈血壓,最后行股靜脈置管以注入實驗藥物。具體操作方法見本課題組前期研究[7]。
將置管順利的大鼠分為生理鹽水對照組、氫化可的松對照組、生理鹽水中暑組及氫化可的松中暑組,每組24只,隨機參加下述3部分實驗,每部分實驗中各組大鼠均為8只。造模時,中暑組大鼠被置入預熱至(39.5±0.2) ℃及60%±5%濕度的改良型加溫培養箱(購自戴維醫療器械股份有限公司)中,實驗過程中保持培養箱內定期適當通風(供氧),并通過獨立設備兩次校正溫度、濕度和氧氣濃度。中暑建模成功的標準是大鼠肛溫(直腸內5 cm)超過42 ℃的情況下,血壓從峰值開始快速下降[8]。造模成功后的大鼠立刻采用冰塊降溫至基礎體溫,并以1 ml/kg的無菌生理鹽水緩慢靜脈注射補充血容量。兩對照組大鼠始終置于(23±1) ℃、50%±5% 濕度、保暖的環境中,未接受熱打擊,維持大鼠中心體溫接近基礎體溫。
中暑組大鼠在血壓開始快速增高至峰值(熱應激)后,分別接受10 mg/kg氫化可的松0.5 ml或等量生理鹽水靜脈注射。對照組分別在模擬造模開始后70 min接受10 mg/kg氫化可的松0.5 ml或等量生理鹽水靜脈注射,在模擬造模開始后75 min接受1 ml/kg無菌生理鹽水靜脈注射。
1.3 兩次負荷劑量的去甲腎上腺素推注實驗 為評估上述4組大鼠對去甲腎上腺素的反應性,參考文獻[9]的方法和劑量,觀察負荷劑量的去甲腎上腺素對大鼠血壓的影響。每組取8只大鼠,分別接受一次負荷劑量的去甲腎上腺素(1 μg/kg)靜脈彈丸式注射,當大鼠血壓回復至基線水平后5 min,再次注射一次相同劑量的去甲腎上腺素,分別記錄兩次注射后的平均動脈壓(MAP)峰值及血壓回落至基線的時間。
1.4 恒定低劑量的去甲腎上腺素持續泵注實驗為進一步觀察恒定低劑量的去甲腎上腺素對大鼠血壓的影響[9],上述大鼠每組取8只,分別接受去甲腎上腺素[25 μg/(kg·h)]微量泵持續泵注,記錄大鼠MAP維持水平及存活時間。
1.5 血管反應性相關生化指標檢測 4組大鼠每組取8只,分別接受去甲腎上腺素[25 μg/(kg·h)]靜脈持續泵注,于造模1 h后通過動脈大量放血終止實驗,留取避免稀釋的動脈血標本,低溫離心取血清并完成如下指標的檢測:血管擴張因子(血清NO、PGE2),激素(皮質醇、ACTH),促炎因子(NF-κB、TNF-α、IL-1β)。為保障激素水平的穩定性,本步驟實驗均在每日的14時至17時之間完成。操作方法嚴格按照試劑盒說明書施行。另外,為檢測大鼠主動脈α1腎上腺素能受體3個亞型(α1A、α1B及α1D)的mRNA水平,取大鼠主動脈組織行RT-qPCR檢測。用PrimeScriptTMRT Maseter Mix(TaKaRa)提取總RNA,羅氏LightCycler480系統實施擴增。mRNA的比較采用ΔΔCt方法,結果以相對于內參基因GAPDH的比值表示。引物序列設計參照文獻[10](表1)。
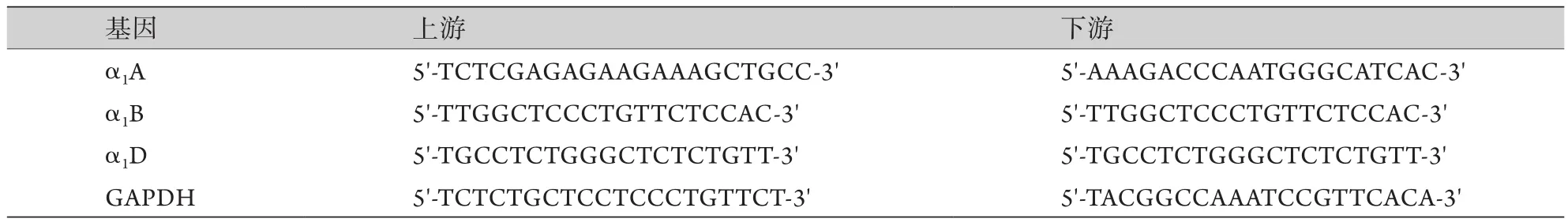
表1 RT-qPCR的引物序列Tab.1 Primers used in RT-qPCR
1.6 統計學處理 應用SPSS 17.0軟件處理數據。連續性計量資料先行Kolmogorov-Smirnov檢驗檢測數據正態性,正態分布數據以表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t法;同一組數據的前后比較采用配對t檢驗。采用Kaplan-Meier方法進行生存分析。P<0.05為差異有統計學意義。
2 結 果
2.1 兩次負荷劑量的去甲腎上腺素推注實驗 中暑大鼠造模成功后均發生循環衰竭,血壓進行性下降。未經降溫、補液、血管活性藥物干預的大鼠均因低血壓導致的心律失常快速死亡。生理鹽水對照組和氫化可的松對照組大鼠在兩次接受1 μg/kg的去甲腎上腺素后,血壓均快速而顯著增高,并緩慢下降至基線,組內兩次注射產生的MAP峰值和血壓回落時間前后比較未見明顯差異。生理鹽水中暑組大鼠在接受負荷劑量的去甲腎上腺素后,血壓上升的峰值和持續時間明顯低于生理鹽水對照組,第二次注射后的峰值降低更加明顯。氫化可的松中暑組接受負荷劑量的去甲腎上腺素后,雖然血壓峰值和持續時間明顯低于氫化可的松對照組,但明顯高于生理鹽水中暑組,差異有統計學意義(P<0.05)。氫化可的松中暑組兩次接受去甲腎上腺素注射后的血壓峰值和持續時間前后比較無明顯差異(表2)。
2.2 恒定低劑量的去甲腎上腺素持續泵注實驗持續泵入恒定低劑量的去甲腎上腺素的實驗中,氫化可的松中暑組和生理鹽水中暑組大鼠MAP明顯低于兩個對照組,且前兩組大鼠均因血壓進行性下降而死亡。但是,氫化可的松中暑組大鼠血壓高于生理鹽水中暑組,血壓下降相對平緩,且總體生存時間較后者延長(P=0.009,圖1)。
表2 前后兩次負荷劑量去甲腎上腺素靜脈注射對大鼠血壓的影響(±s,n=8)Tab.2 Effect of two doses of intravenously injected norepinephrine on the blood pressure of rats (±s, n=8)
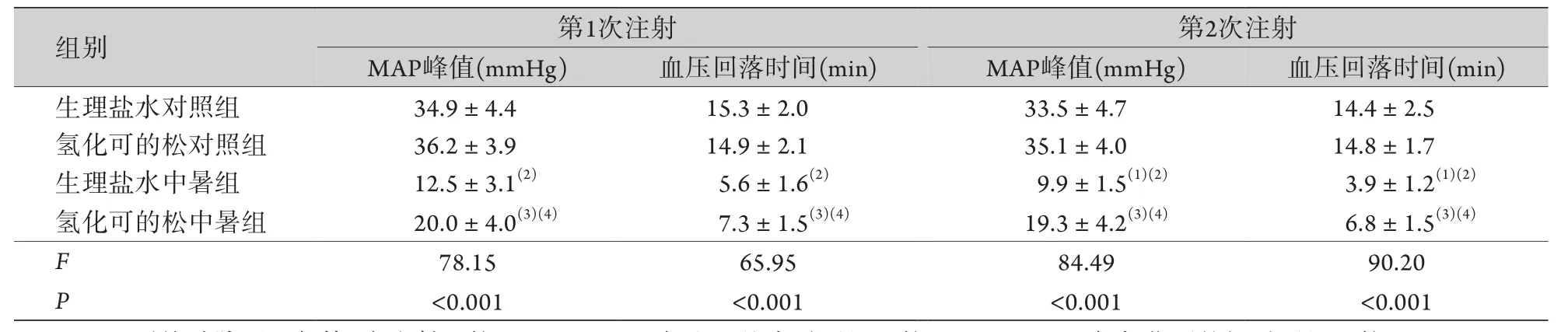
表2 前后兩次負荷劑量去甲腎上腺素靜脈注射對大鼠血壓的影響(±s,n=8)Tab.2 Effect of two doses of intravenously injected norepinephrine on the blood pressure of rats (±s, n=8)
MAP.平均動脈壓;與第1次注射比較,(1)P<0.05;與生理鹽水對照組比較,(2)P<0.05;與氫化可的松對照組比較,(3)P<0.05;與生理鹽水中暑組比較,(4)P<0.05。
images/BZ_12_638_514_1410_564.png組別 第1次注射 第2次注射images/BZ_12_1423_514_2220_564.png生理鹽水對照組 34.9±4.4 15.3±2.0 33.5±4.7 14.4±2.5氫化可的松對照組 36.2±3.9 14.9±2.1 35.1±4.0 14.8±1.7生理鹽水中暑組 12.5±3.1(2) 5.6±1.6(2) 9.9±1.5(1)(2) 3.9±1.2(1)(2)氫化可的松中暑組 20.0±4.0(3)(4) 7.3±1.5(3)(4) 19.3±4.2(3)(4) 6.8±1.5(3)(4)F 78.15 65.95 84.49 90.20 P<0.001 <0.001 <0.001 <0.001
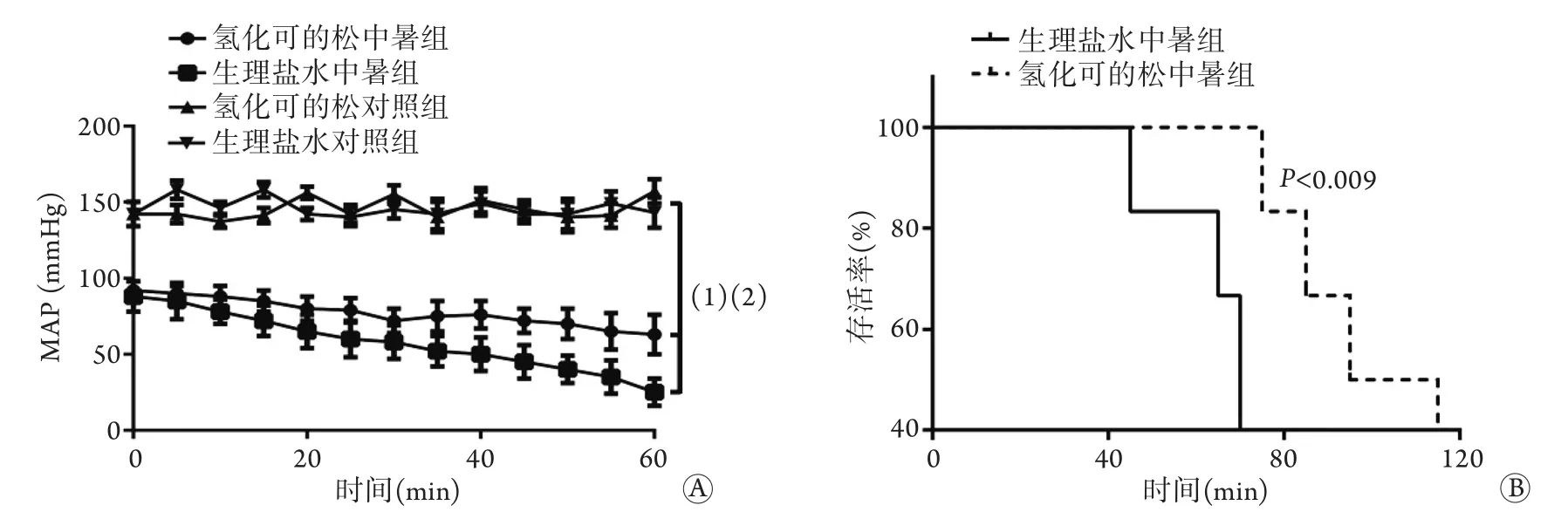
圖1 持續泵入去甲腎上腺素的大鼠血壓(A)及生存情況(B)Fig.1 Blood pressure and survival of rats with continuously intravenous injection of norepinephrine
2.3 大鼠血管擴張因子及激素的檢測 4組大鼠血清皮質醇、ACTH、NO、PGE2水平差異無統計學意義(P>0.05),提示氫化可的松對MAP的影響與上述血管擴張因子及激素水平無關(表3)。
表3 大鼠血清皮質醇、ACTH、NO、PGE2水平(±s,n=8)Tab.3 The serum levels of cortisol, adrenocorticotropic hormone, nitric oxide, prostaglandin E2 of rats (±s, n=8)
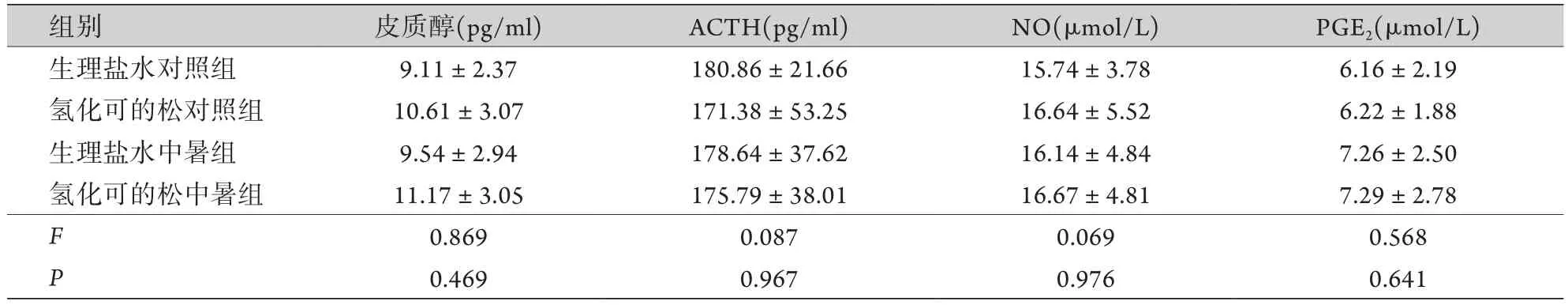
表3 大鼠血清皮質醇、ACTH、NO、PGE2水平(±s,n=8)Tab.3 The serum levels of cortisol, adrenocorticotropic hormone, nitric oxide, prostaglandin E2 of rats (±s, n=8)
ACTH.促腎上腺皮質激素;NO.一氧化氮;PGE2.前列腺素E2
組別 皮質醇(pg/ml) ACTH(pg/ml) NO(μmol/L) PGE2(μmol/L)生理鹽水對照組 9.11±2.37 180.86±21.66 15.74±3.78 6.16±2.19氫化可的松對照組 10.61±3.07 171.38±53.25 16.64±5.52 6.22±1.88生理鹽水中暑組 9.54±2.94 178.64±37.62 16.14±4.84 7.26±2.50氫化可的松中暑組 11.17±3.05 175.79±38.01 16.67±4.81 7.29±2.78 F 0.869 0.087 0.069 0.568 P 0.469 0.967 0.976 0.641
2.4 大鼠主動脈腎上腺素能受體的變化 生理鹽水中暑組和氫化可的松中暑組的3種α1腎上腺素能受體亞型α1A、α1B及α1D的mRNA表達水平分別較生理鹽水對照組和氫化可的松對照組明顯下降,氫化可的松中暑組的腎上腺素受體mRNA表達顯著高于生理鹽水中暑組,差異有統計學意義(P<0.05,表4)。
2.5 大鼠血清炎性因子表達水平比較 大鼠血清NF-κB、TNF-α、IL-1β檢測結果顯示,生理鹽水中暑組和氫化可的松中暑組的炎性因子水平分別較生理鹽水對照組和氫化可的松對照組顯著提高,氫化可的松中暑組的炎性因子水平顯著低于生理鹽水中暑組,差異有統計學意義(P< 0.05,表5)。
表4 主動脈組織的α1腎上腺素能受體3個亞型(α1A、α1B及α1D)的mRNA表達 (±s,n=8)Tab.4 The mRNA expressions of 3 subtypes (α1A, α1B and α1D) of α1 adrenergic receptor in aortic tissue (±s, n=8)
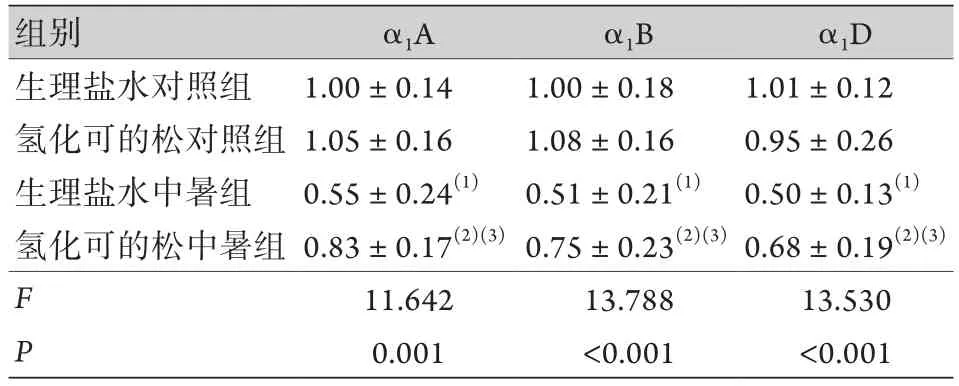
表4 主動脈組織的α1腎上腺素能受體3個亞型(α1A、α1B及α1D)的mRNA表達 (±s,n=8)Tab.4 The mRNA expressions of 3 subtypes (α1A, α1B and α1D) of α1 adrenergic receptor in aortic tissue (±s, n=8)
與生理鹽水對照組比較,(1)P<0.05;與氫化可的松對照組比較,(2)P<0.05;與生理鹽水中暑組比較,(3)P<0.05。
組別 α1A α1B α1D生理鹽水對照組 1.00±0.14 1.00±0.18 1.01±0.12氫化可的松對照組 1.05±0.16 1.08±0.16 0.95±0.26生理鹽水中暑組 0.55±0.24(1) 0.51±0.21(1) 0.50±0.13(1)氫化可的松中暑組 0.83±0.17(2)(3)0.75±0.23(2)(3)0.68±0.19(2)(3)F 11.642 13.788 13.530 P 0.001 <0.001 <0.001
表5 大鼠血清炎性因子表達水平 (±s,n=8)Tab.5 The serum levels of inflammatory cytokines of rats(±s, n=8)
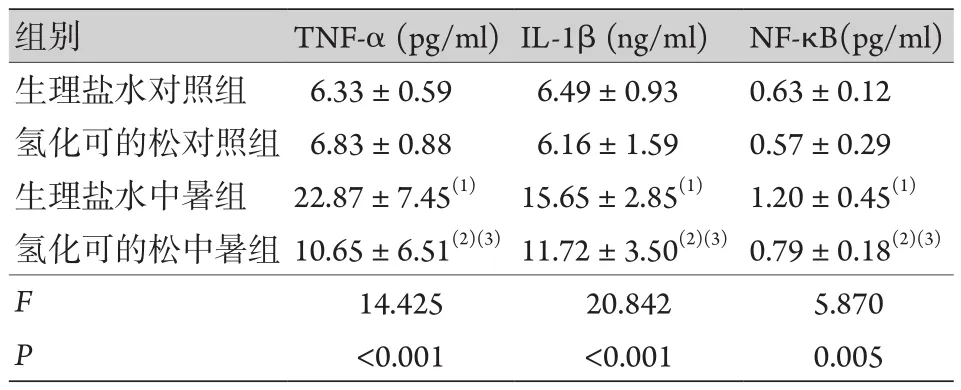
表5 大鼠血清炎性因子表達水平 (±s,n=8)Tab.5 The serum levels of inflammatory cytokines of rats(±s, n=8)
TNF-α.腫瘤壞死因子α;IL-1β.白介素1β;NF-κB.核因子κB;與生理鹽水對照組比較,(1)P<0.05;與氫化可的松對照組比較,(2)P<0.05;與生理鹽水中暑組比較,(3)P<0.05。
組別 TNF-α (pg/ml)IL-1β (ng/ml) NF-κB(pg/ml)生理鹽水對照組 6.33±0.59 6.49±0.93 0.63±0.12氫化可的松對照組 6.83±0.88 6.16±1.59 0.57±0.29生理鹽水中暑組 22.87±7.45(1) 15.65±2.85(1) 1.20±0.45(1)氫化可的松中暑組 10.65±6.51(2)(3)11.72±3.50(2)(3)0.79±0.18(2)(3)F 14.425 20.842 5.870 P<0.001 <0.001 0.005
3 討 論
現今,循環衰竭已經成為中暑大鼠模型建立的公認標準之一[11]。早有研究指出,雖然輕度中暑大鼠的血壓可能升高,但重度中暑大鼠的血壓勢必大幅下降,循環衰竭是重度中暑的典型改變,且是造模大鼠死亡的直接原因[12]。這些足以證實中暑致循環衰竭的普遍性和特征性。與既往的研究結果類似,本研究中造模成功的大鼠無一例外地死于循環衰竭。另外,本研究還發現,早期快速降溫、擴容可能緩解循環衰竭的進展速度,但無法逆轉,使用縮血管藥物仍是延長生存的有效措施。與膿毒癥休克類似,重癥中暑大鼠的血流動力學具有低血管張力的特點[13-14],而使用去甲腎上腺素干預膿毒癥休克已成為共識[15],從中可以推測去甲腎上腺素對中暑循環衰竭治療的潛在價值和必要性。
然而,去甲腎上腺素并不能長期穩定重癥中暑大鼠的循環功能,正如縮血管藥物不能治愈膿毒癥休克的患者一樣,縮血管藥物的低反應性是首先要面對的問題[16]。由于其機制的復雜性,雖已經過漫長的研究,低反應性在膿毒癥休克中仍未得到解決[17],單一的靶向、拮抗均有杯水車薪之勢[18]。因而,人們轉向考慮靶點更廣泛的藥物——氫化可的松等。早有研究證實,氫化可的松作為對各系統廣泛起效的藥物,可以進入血管壁細胞發揮強有力的作用[19]。為了驗證該藥物對中暑大鼠低反應性的作用,本研究采用彈丸式注射和持續注射兩種模式,均觀察到其對中暑大鼠去甲腎上腺素反應性的改善作用,且有利于大鼠生存時間的延長,這與糖皮質激素在膿毒癥休克中的作用類似[9]。實際上,臨床早有使用糖皮質激素改善中暑患者循環功能的觀察報道[4]。也有動物實驗使用糖皮質激素(地塞米松)改善中暑大鼠的低血壓,但這些動物并未使用縮血管藥物,不排除糖皮質激素改善了內源性兒茶酚胺的敏感性[11]。與這些研究不同的是,本研究主要評估糖皮質激素對使用了去甲腎上腺素的中暑大鼠的影響,并且選用了在抗休克領域更受認同的氫化可的松作為干預藥物,干預過程更符合臨床實際。
為了初步探索氫化可的松改善中暑大鼠去甲腎上腺素低反應性的機制,本研究觀察了中暑大鼠血清NO和PGE2水平的變化,結果顯示熱打擊或糖皮質激素并未在短時間內明顯改變“血管張力因子”,初步排除了它們在這一過程中發揮重要作用的可能性。進一步的研究中,我們觀察了中暑大鼠的血清皮質醇水平,以驗證氫化可的松的有效性是否依賴于激素水平的缺乏。結果顯示,至少在發病早期,大鼠未出現糖皮質激素不足的表現。與本研究不同的是,有研究發現,糖皮質激素水平在中暑動物體內有變化,造成差異的原因可能是觀察時間點的不同[20]。總之,氫化可的松的治療意義可能并不是單純的補充不足以及外源性替代,正如在膿毒癥休克中,也認為皮質醇激素水平的絕對值意義不大[21]。當然,為進一步驗證該結論或者確定藥物起效的激素水平“閾值”,后續研究仍是需要的。
炎性因子的大量釋放是中暑作為一種炎癥反應性疾病的重要依據,這些炎性因子被認為誘導了中暑導致的多器官功能障礙,也包括循環系統功能障礙[8]。雖然熱打擊能夠誘導離體血管對去甲腎上腺素的低反應性,但熱的直接作用不足以改變血管壁的收縮功能,而熱打擊伴隨而來的血管環境的改變才是主要原因[22]。研究還顯示,雖然具體機制仍不明確,增加的炎性因子,尤其是NF-κB、TNF-α、IL-1β可能是造成血管壁α1腎上腺素能受體變化,并進一步導致縮血管藥物低反應的主要原因[23-24]。由此我們推測,炎性因子可能在中暑致去甲腎上腺素低反應性的過程中發揮重要作用。本研究發現,中暑后NF-κB、TNF-α、IL-1β水平明顯增高,這與未使用縮血管藥物的中暑模型類似[25],其變化趨勢與血管低反應性一致。早有研究發現糖皮質激素能夠通過多種機制抑制炎性因子的釋放,因而作為相關研究常用的干預藥劑[26]。這種效應在我們的中暑模型中也得到驗證,且還伴隨了中暑對去甲腎上腺素低反應性的改善。基于上述結論,我們認為炎性因子可能是誘導中暑大鼠對去甲腎上腺素低反應的原因之一,而氫化可的松可通過調控炎癥反應改善此低反應性。
總而言之,本研究發現,中暑大鼠存在對去甲腎上腺素的低反應性,使用氫化可的松可以減緩中暑大鼠血壓的下降幅度,延長大鼠個體存活時間,這種效果可能是通過抑制炎性因子的表達實現的,該發現可能為重癥中暑的救治提供一定參考。可惜的是,本研究發現氫化可的松仍不具備逆轉中暑誘發的致死性結局的功效,正如同沒有任何一種糖皮質激素能夠明顯改善膿毒癥休克患者的預后一樣[6]。由此可見,相對于輔助藥物的開發,進一步研究早期合理防控的技術手段,避免中暑進展到循環衰竭階段,是下一步亟待解決的課題。

