電化學試題的解題思路分析
蘆紅霞



摘 要:電化學是中學化學學科中的重要內容,也是高考考查的重點.試題涉及有電極判斷、電極反應式書寫、離子的移動等相關問題,通過高考真題的分析來提煉處理這類問題的方法.
關鍵詞:氧化還原反應;電子轉移;電極判斷;離子移動;高中化學
電化學試題的解題思路一般可以分成這樣四個步驟來進行:1.先弄清楚是電池反應還是電解反應;2.根據信息說明或反應中物質價態變化確定正、負極或陰、陽極;3.根據物質的特點確定反應的微粒;4.根據反應所處的環境正確寫出電極反應式以及判斷離子的移動方向.下面就結合具體的高考試題來分析.
一、考查電極反應式書寫
例1 (2018年江蘇-20節選)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,電解該混合溶液可獲得較濃的硝酸.寫出電解時陽極的電極反應式:.
分析 稀硝酸吸收NOx后有HNO3和HNO2兩種物質,想通過電解的方法來得到較濃的硝酸.從這句表達來看該過程屬于電解反應,目的是使混合溶液中的亞硝酸轉化成硝酸,讓氮元素價態升高,氮元素價態升高的過程就是氮原子失去電子的過程,所以應該在電解池的陽極反應.在這個過程中涉及的問題還有:(1)NO-2轉化成NO-3的變化中,缺少的氧原子可以用什么微粒來補充?(2)電極式也是離子方程式,微粒以什么樣的形式保留呢?由于亞硝酸屬于弱酸,應當以分子形式存在;缺少的氧原子在溶液中一般以水或者OH-補充,考慮該溶液為酸性,用水比較合理.最終寫出的陽極的電極反應式為:
二、考查電極判斷
電化學反應中,電極的確定和電子的得失是聯系在一起的,電子的得失在物質價態變化上顯現出來.如果電極名稱沒有標明,就可以通過微粒中元素價態變化來確定反應的電極.
分析 根據提供的電池總反應可以看出,鈉在反應中化合價升高,失電子,應該在負極反應,則正極反應物應為CO2,那正極的反應式為3CO2+4e-2CO2-3+C.從提供的圖示也可以判斷:左邊電極上發生反應的物質為鈉,右邊為CO2.其中鈉為非常活潑的金屬,易失電子,很顯然鈉為負極反應物.負極失去電子后該區域區帶正電荷,正極區得到電子后帶負電荷,那電解液中的離子會相應移動維持電荷平衡.所以放電時ClO-4向負極移動.充電時,陰極得到電子,鈉離子被還原,發生的反應為是Na++e-Na,此時電極名稱為陰極,解題時要注意區分電池反應和電解反應的電極名稱.
三、考查離子的移動方向
在電化學反應中,離子的移動來維持電荷的平衡.一般來說有兩種情況:濃度大的離子會向離子濃度小的區域擴散、離子向帶相反電荷的方向移動.
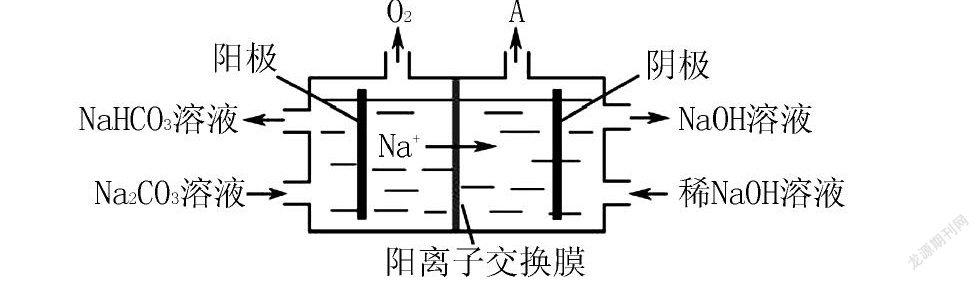
例3 (2017年江蘇-16節選)電解Na2CO3溶液的原理如圖所示.
陽極的電極反應式為,陰極產生的物質A的化學式為.
分析 該題裝置為電解反應,左池是陽極區,右池為陰極區.陽極失去電子,發生氧化反應.陰極得到電子,發生還原反應.那發生反應的離子分別是什么呢?在陽極區產生氧氣,原來氧元素存在于CO2-3或H2O中,都是以-2價存在,考慮最后CO2-3轉化成HCO-3,所以應該是水發生反應產生氧氣.即2H2O-4e-4H++O2,產生的H+立即與CO2-3反應生成HCO-3,所以總反應應該寫成4CO2-3+2H2O-4e-4HCO-3+O2,由于CO2-3轉化成HCO-3,所帶負電荷減少,為了維持電荷平衡,鈉離子由陽極區通過陽離子交換膜轉移到陰極區.再看陰極區的反應,稀的NaOH轉變成濃的NaOH溶液,鈉離子由陽極區轉移過來的,OH-則由陰極區產生,從存在的微粒來看,只有水參加反應得到,所以陰極區是水得到電子,發生還原反應:2H2O+2e-H2+2OH-,則A為氫氣.
四、根據實際情況分析反應物質
在電化學反應中,除了一些常見的微粒發生反應外,也會看到一些不是很常見的物質,比如活潑的金屬離子、非金屬離子或單質參見反應.這種情況的出現需要根據實際情況進行分析,判斷出具體反應的物質,再依據電化學中電子轉移的理論來分析即可.
例4 (2018全國卷Ⅲ-27節選) KIO3可采用“電解法”制備,裝置如圖所示.
寫出電解時陰極的電極反應式.
電解過程中通過陽離子交換膜的離子主要為,其遷移方向是.
分析 該電解裝置的目的是制取KIO3,從提供的原料來看,KIO3在陽極區產生.陰極區的物質是KOH溶液,能得到電子的只有水中的氫,電極反應為:2H2O+2e-H2+2OH-,那陽極的反應呢?參加反應的物質是KOH與I2,且從價態分析碘元素由單質的0價轉化成IO-3中的+5價,失電子,結合堿性溶液的氛圍,電極反應式可以寫:I2-10e-+12OH-2IO-3+6H2O.反應中消耗的OH-比生成的IO-3多,負電荷減少,正電荷增加,多余的K+則由a室通過陽離子交換膜進入b室.該題考查時雖然沒有要求寫出陽極的電極反應式,但從離子移動的方向來看,還是需要能分析清楚陽極的反應情況.雖然平時的教學中有關I2的內容較少,但依據該題中情境的實際情況來分析就可以得到答案.
(2018年全國卷Ⅱ-26節選),以閃鋅礦(ZnS,含有SiO2和少量FeS、CdS、PbS雜質)為原料制備金屬鋅的流程如圖所示:
電解硫酸鋅溶液制備單質鋅時,陰極的電極反應式為_______;
分析:該工業流程最終目的為了制取鋅單質.將原料閃鋅礦(ZnS,含有SiO2和少量FeS、CdS、PbS雜質)經過一系列反應后去除其中的雜質,并轉化為ZnSO4溶液.如果電解ZnSO4稀溶液,也許發生反應的物質仍然是水,但題中要求得到鋅單質,發生反應的物質必定是Zn2+.也許在平時的學習中一般認為,在水溶液中活潑金屬的離子不容易參加反應,如果采用鋅作電極,并通過增加鋅離子的濃度來增強氧化能力,反應是完全可以發生的.這其實也是氫在鋅電極上具有超電勢所致.該方案最后可以選擇電解飽和硫酸鋅溶液,則鋅離子發生反應就很正常.這種情況就需要考慮實際問題,不能墨守成規,認為水溶液中一定反應的是H+或者OH-.
電化學的基礎是氧化還原反應,在處理電化學問題時要抓住本質(電子轉移的情況)和現象(微粒中元素化合價的變化)這兩個方面分析,同時注意結合具體的反應情況就可以完美的解決問題.雖然需要回答的問題只是一到兩個方面,但在分析時應該把握住整個裝置.
參考文獻:
[1]中華人民共和國教育部.普通高中化學課程標準(2017年版)[M].北京:人民教育出版社,2018.
[2]李宗來,李小娟.例談電解原理在高考題中的應用[J].化學教學,2019(5):37-39.
[3]曹錫章,張婉蕙,杜堯國.無機化學[M].北京:高等教育出版社,2002.
[責任編輯:季春陽]

