碘過量對NOD·H2h4小鼠甲狀腺轉錄組影響的分析
曹曉曉 徐菁 王海燕 馬巍 李秀維 王建強
摘要:目的:對比分析碘營養適宜和過量對有自身免疫性甲狀腺炎遺傳傾向小鼠甲狀腺轉錄組的影響,為碘過量致自身免疫性甲狀腺疾病的發病機制提供科學依據。方法:將18只5周齡NOD·H2h4小鼠隨機分為對照組和高碘組,分別予適宜碘和過量碘飼養16周。ELISA和HE法進行血清甲功和甲狀腺病理檢測。建立甲狀腺轉錄組文庫,利用Illumina HiSeq平臺測序,進行基因轉錄組表達差異和差異基因KEGG通路分析。結果:適宜碘和過量碘飼養建立了甲狀腺正常和自身免疫性甲狀腺炎小鼠模型,兩組小鼠甲狀腺轉錄組存在304個差異表達基因,其中與細胞因子、細胞趨化因子和細胞粘附分子通路,以及抗原處理呈遞相關的基因轉錄水平在高碘組顯著升高。結論:碘過量可能會過度激活多個與免疫反應和炎癥發生密切相關的分子通路,共同促進自身免疫性甲狀腺疾病的發生發展。
關鍵詞:碘過量;轉錄組學;自身免疫性甲狀腺疾病;小鼠
國內外流行病學調查顯示,碘缺乏地區人群在補碘后較長時間內AITD患病率和發病率均會增高[12],且高水碘地區的居民中甲狀腺自身抗體陽性伴隨甲狀腺功能減退的患者顯著多于適碘地區[3],這些現象能夠在有疾病遺傳易感性的動物模型中得到重復。研究發現,90%的NOD·H2h4小鼠在005%NaI水喂養的條件下可被誘發出實驗性自身免疫性甲狀腺炎(EAT)[4]。可見,碘過量是AITD發病的危險因素,特別是對于具有遺傳背景的敏感人群而言,過量碘攝入可能會誘導或加速該類疾病的發生發展。有學者認為,碘過量可導致甲狀腺上皮細胞氧化應激增強,造成細胞損傷,進而誘導甲狀腺濾泡上皮細胞發生凋亡,誘發甲狀腺免疫功能異常[56]。另外,過量碘攝入還可促使甲狀腺球蛋白(Tg)碘化程度增高,進而可能增加其免疫原性[1]。然而,有關碘攝入過量誘發AITD的具體分子機理目前尚不明確。近年來,隨著高通量分析技術和信息科學的迅速發展,轉錄組學能夠在整體水平上研究細胞特定時空中全部基因轉錄本種類、結構和功能及轉錄調控的學科,其相關技術為疾病的不同階段、不同結局的分子機理和調控網絡的研究提供了強有力工具[7]。本研究通過適宜碘和過量碘飼養具有自身免疫性甲狀腺炎遺傳傾向的NOD·H2h4小鼠,建立甲狀腺正常和EAT小鼠模型,對比分析兩組甲狀腺轉錄組學,旨在探索碘過量攝入誘發自身免疫性甲狀腺炎中發揮關鍵作用的相關通路,為碘致AITD發病的分子機制提供科學依據。
1材料與方法
11儀器與試劑
NaI,上海國藥集團化學試劑有限公司;ELISA試劑盒,武漢伊萊瑞特生物科技股份有限公司;RNA提取與純化試劑盒、cDNA文庫構建試劑盒、PCR反應體系,深圳華大基因有限公司;其余試劑,均為分析純,上海國藥集團化學試劑有限公司。
AR3130電子天平,中國上海梅特勒托利多公司;5407離心機,德國Eppendorf公司;EXL 800酶標測試儀,美國Biotech公司;AE31顯微鏡,中國廈門麥克奧迪公司;Hiseq 2500測序平臺,Illumina公司。
12實驗動物與分組處理
5周齡雌性NOD·H2H4小鼠(中國醫科大學滕衛平教授課題組惠贈),在中國疾病預防控制中心實驗動物中心SPF環境下飼養。按體重將18只小鼠隨機分成2組:對照組(C)和高碘組(HI),每組9只,分別給予蒸餾水和005%NaI水[4]喂養16周。第16周末處死小鼠,取血清和甲狀腺,將甲狀腺的一葉固定在4%多聚甲醛溶液中,另一葉在液氮中快速冷凍。本實驗程序經中國疾病預防控制中心動物倫理委員會審核批準(批準文號:NHPF064101)。
13血清指標的ELISA檢測
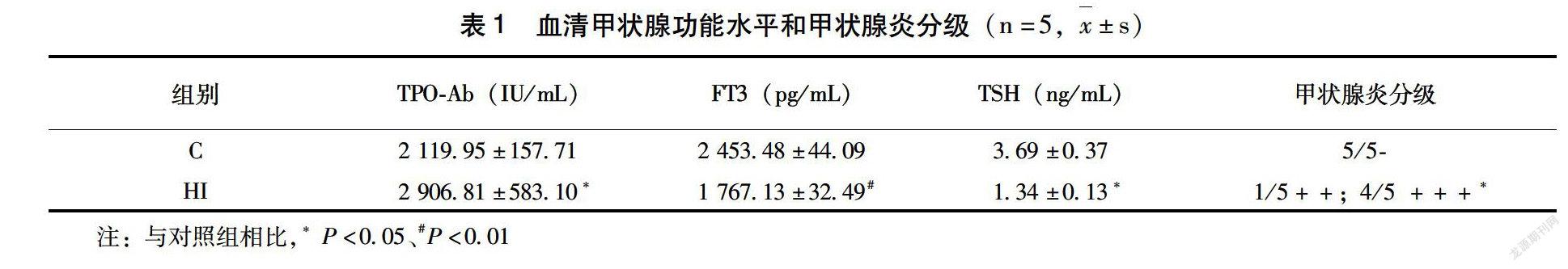
每組隨機取5只小鼠血清,進行甲狀腺過氧化物酶抗體(TPOAb)、游離三碘甲狀腺原氨酸(FT3)、促甲狀腺素(TSH)的檢測,采用ELISA檢測試劑盒,具體操作參照說明書。
14甲狀腺組織病理檢測
與13相對應,取5只小鼠的一葉甲狀腺進行病理檢測。采用HE染色,在光學顯微鏡下觀察。甲狀腺炎癥程度分級主要依據甲狀腺濾泡破壞程度和淋巴細胞浸潤。“-”代表陰性;“+”代表有淋巴細胞浸潤,濾泡腔內充滿膠質,濾泡上皮細胞變扁平;“++”代表有淋巴細胞浸潤,出現較多的大濾泡腔,部分有融合破壞;“+++”代表有淋巴細胞浸潤,50%的濾泡腔壁斷裂、破壞;“++++”代表所有的濾泡腔遭到破壞或者沒有濾泡腔存在。
15轉錄組建庫與測序
每組隨機取9只小鼠的一葉甲狀腺組織,分別稱量,各加入500μL Trizol 裂解液,放入研磨機中,研磨30s,取出靜置5min,使組織細胞充分裂解。4℃、12 000 g離心5min。將上清轉入加有100μL氯仿/異戊醇(24∶1)的EP管中,顛倒振蕩混勻。4℃、12 000 g離心8min。將上清轉入加有200μL異丙醇的離心管中,顛倒混勻置于-20℃冰箱靜置2h以上。4℃、17 500 g離心25min,棄上清,用09 mL 75%乙醇洗滌,上下顛倒懸浮沉淀,4℃、17 500 g 離心3min。棄上清,短暫離心后吸去殘留液體,晾干3~5min。用50μL DEPC水溶解沉淀。Aglient 2100 Bioanalyzer進行RNA定量。將每組9葉甲狀腺RNA隨機分成3個亞組(對照組分為C1、C2、C3;高碘組分為HI1、HI2、HI3),每個亞組取3只小鼠等量的RNA進行混勻。然后分別取等量 1μg 亞組RNA樣品,使用oligodT磁珠進行純化。將純化的mRNA依次進行片段化處理,cDNA合成,末端修復和接頭連接,PCR反應及產物回收,建立最終文庫樣本。按照Illumina Hiseq 2500測序平臺的操作說明制備上機樣本,進行測序;測序結束后,整理數據,并進行生物信息學統計和分析。
16測序結果的分析
共得到6個樣品原始測序結果,平均產出為550 Gb/樣品。然后過濾去除測序的原始數據(raw reads)包含低質量、接頭污染以及未知堿基N含量過高的序列。使用HISAT[8]將過濾后的序列(clean reads)與參考基因組序列進行比對,分析樣品之間的可比性。然后對組間基因表達差異性分析和差異基因的京都基因和基因組數據庫(KEGG)的通路注釋分析。
17統計分析
利用SPSS l30軟件進行統計分析。正態計量資料用±s表示,兩兩比較采用t檢驗;非正態計量資料用中位數M(p25~p75)表示,組間比較選用秩和檢驗,相關性分析采用Spearman線性相關;計數資料的比較采用χ2檢驗,檢驗水準α=005。
2結果與分析
21小鼠模型的驗證
由表1可見,與C組相比,HI組小鼠血清中TPOAb和TSH水平顯著升高,而血清FT3水平降低,差異均有統計學意義(P<005)。HI組小鼠表現出自身免疫性甲狀腺炎的血清學特征。由圖1可見,C組甲狀腺組織形態和結構正常,而HI組小鼠甲狀腺組織則出現了濾泡擴張和融合,濾泡內膠體積聚,甲狀腺濾泡上皮細胞扁平以及少量淋巴細胞浸潤。結合血清學結果,本研究通過適宜碘和過量碘飼養NOD·H2h4小鼠分別建立了甲狀腺正常小鼠和EAT小鼠模型。
22小鼠甲狀腺組織轉錄組差異表達分析
針對每個樣本的原始測序數據進行質量評估,經過測序數量質量剪切及統計,與小鼠參考基因組對比,進行轉錄組整體質量評估。
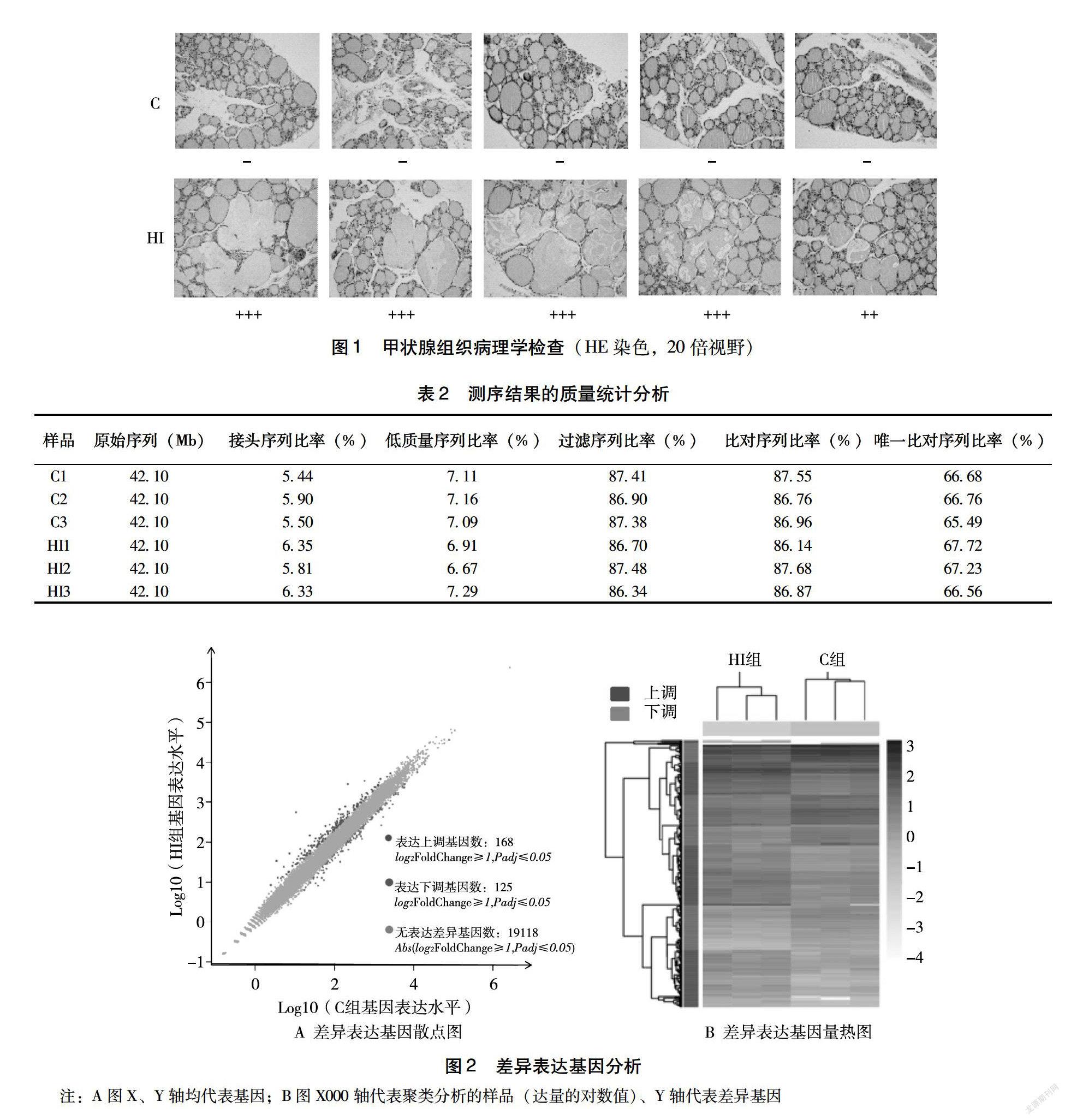
221測序結果質量分析測序的原始數據包含低質量、接頭污染以及未知堿基N含量過高的序列。數據分析之前需要去除這些序列以保證結果的可靠性。得到clean reads之后,使用 HISAT[8]將其與參考基因組序列進行比對。平均每個樣品的比對率達到 8699%,同時樣品間均勻的比對率表明樣品之間的數據具有可比性(表2)。
222組間差異表達基因分析圖2結果顯示,C組和HI組高碘組的基因轉錄表達存在一定差異性,其中304個基因表達有顯著統計學差異。如圖2A所示,使用散點圖展示差異表達基因(DEG)的分布。與C組相比,HI組有168個基因的表達水平降低、125個基因的表達水平升高。并且對每組 DEG 作表達量熱圖(圖2B)。
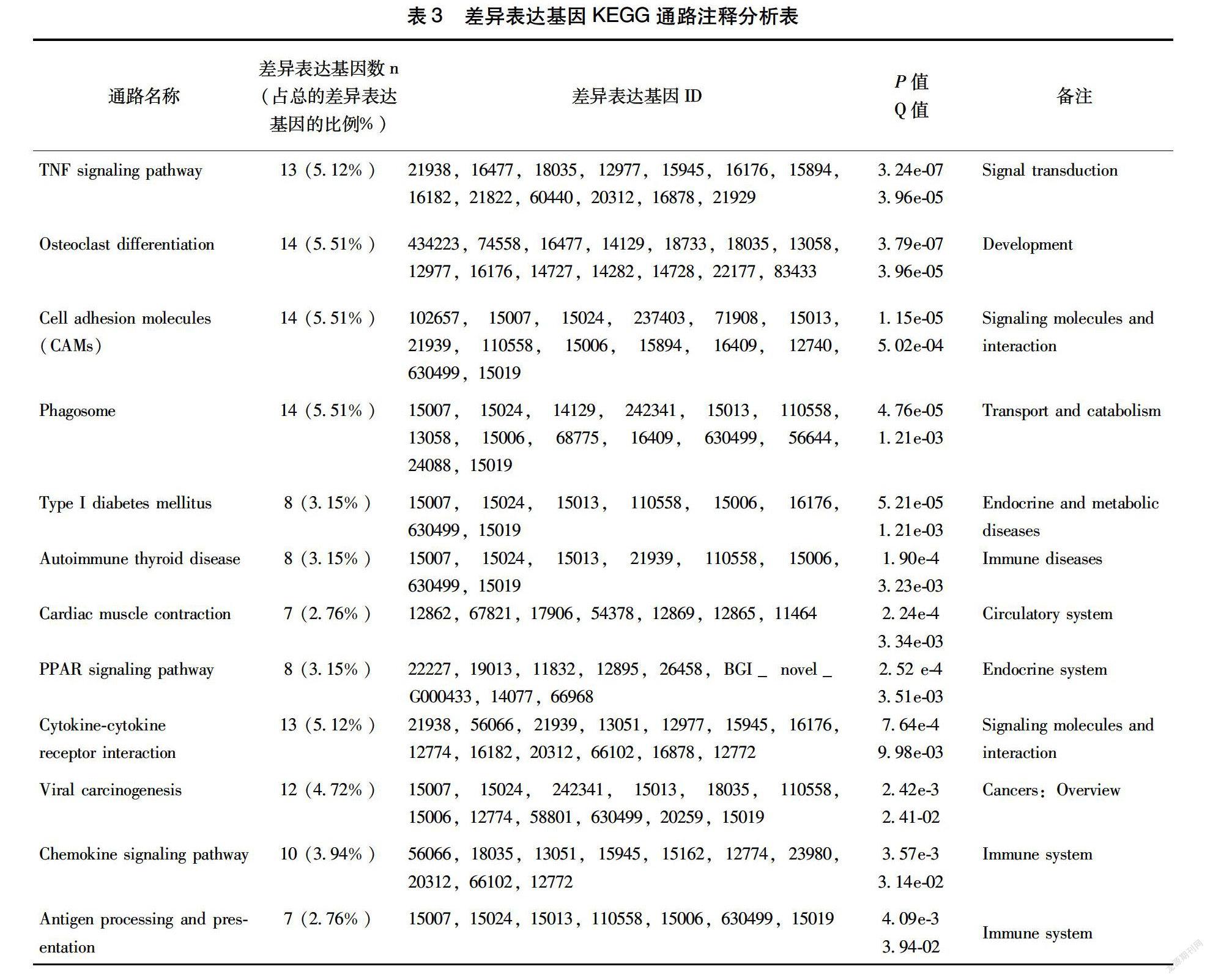
223差異表達基因的KEGG分析將差異表達基因進行KEGG通路注釋分析。根據P值和Q值從大到小進行排列(表3)。其中與機體免疫反應和炎癥發生密切相關的TNF信號轉導通路,細胞粘附分子(CAMs)、細胞因子受體相互作用和趨化因子信號通路,以及抗原處理及呈遞均在高碘誘發的EAT小鼠甲狀腺組織中過度激活。
細胞因子主要包括腫瘤壞死因子(TNF)、白細胞介素(IL)等[9]。研究發現,AITD患者血清中TNF水平顯著升高[10],且高碘刺激還可誘導AITD患者甲狀腺組織分離細胞中TNFα的高表達[11]。同樣,本研究中TNF通路在EAT小鼠甲狀腺中也異常活躍,其中TNFα誘導蛋白3(Tnfaip3)、TNF 受體超家族1b(Tnfrsf1b)、IL1、IL18等基因呈高表達狀態。除了細胞因子通路,在機體免疫應答過程中,細胞趨化因子則參與淋巴組織的發生與分化過程。現已證實,甲狀腺內淋巴細胞和甲狀腺濾泡細胞均能產生CC和CXC細胞趨化因子,它們促進了炎癥發展過程[12]。本研究發現,EAT小鼠甲狀腺組織中CXC趨化因子配體10/11/16(Cxcl10/Cxcl11/Cxcl16)基因轉錄水平顯著升高。其中,Cxcl10和Cxcl11分子水平被證實在AITD患者血清中顯著升高[1315]。另外,CAMs通路能夠介導細胞間或細胞與細胞外基質間相互接觸和結合,是免疫應答重要的分子基礎。細胞間粘附分子1(Icam1)能促進甲狀腺細胞與淋巴細胞的粘附與識別[16]。結果顯示,Icam1轉錄水平在高碘誘發的EAT小鼠甲狀腺中高于適碘對照組,且CAMs cd40在HI組也是高表達的。可見碘過量攝入會過度激活甲狀腺內多條交錯復雜的分子通路共同促進EAT的發生發展。
KEGG分析還發現,高碘攝入能夠改變甲狀腺組織相容性抗原處理呈遞關鍵基因的轉錄水平,主要表現為EAT小鼠甲狀腺H2組織相容性抗原中H2Q2、H2Q8、H2Q10、H2T10、H2K2基因的轉錄水平的增高。甲狀腺組織相容性抗原發生變化,可能會引起相容性抗原處理呈遞的紊亂,最終導致甲狀腺受到自身免疫細胞的攻擊。當然,NODH2h4小鼠的H2抗原相關基因表達水平的升高與其AITD遺傳傾向性的特征可能有關,而過量碘攝入則誘發了這一改變。
3結論
通過適宜碘和過量碘飼養NOD·H2h4小鼠成功建立了甲狀腺正常小鼠和EAT小鼠模型。經對比分析兩組小鼠甲狀腺組織的轉錄組學,揭示出碘攝入過量可能會過度激活細胞因子、細胞趨化因子、CAMs以及抗原處理呈遞等相關的分子通路,共同誘發和促進了小鼠甲狀腺炎的發生發展。然而,轉錄組的這種變化是否會隨著碘干預時間、濃度和動物模型類型的不同帶來結果上的差異仍有待于進一步的研究。
感謝中國醫科大學滕衛平教授課題組惠贈NOD·H2h4小鼠。◇
參考文獻
[1]Luo Y,Kawashima A,Ishido Y,et alIodine excess as an environmental risk factor for autoimmune thyroid disease[J].Int J Mol Sci,2014,15(7):1289512912
[2]Rayman M PMultiple nutritional factors and thyroid disease,with particular reference to autoimmune thyroid disease[J].Proc Nutr Soc,2019,78(1):3444
[3]Kwon H,Kim W G,Jeon M J,et alAgespecific reference interval of serum TSH levels is high in adolescence in aniodine excess area:Korea national health and nutrition examination survey data[J].Endocrine,2017,57(3):445454
[4]國秀娟碘過量對碘缺乏NODH2h4小鼠甲狀腺形態、功能和自身免疫機制影響的實驗研究[D].沈陽:中國醫科大學,2007
[5]高天舒,李靜,滕衛平中、輕度碘過量對大鼠甲狀腺濾泡上皮凋亡及Fas/FasL表達的影響[J].中國地方病學雜志,2005,24(3):267270
[6]譚雪,徐菁,馬巍,等Bcl2家族參與碘誘發自身免疫性甲狀腺炎小鼠甲狀腺細胞凋亡[J].衛生研究,2019,48(2):273278
[7]劉偉,郭光艷,秘彩莉轉錄組學主要研究技術及其應用概述[J].生物學教學,2019,44(10):25
[8]Kim D,Langmead B,Salzberg S LHISAT:a fast spliced aligner with low memory requirements[J].Nat Methods,2015,12(4):357360
[9]李群芳,武蕾,姜寧鵬細胞因子的研究概況[J].山東畜牧獸醫,2019,40(11):6769
[10]Gu L Q,Zhu W,Pan C M,et alTumor necrosis factor alpha (TNFalpha)polymorphisms in Chinese patients with Graves disease[J].Clin Biochem,2010,43(3):223227
[11]劉超,段宇,蔣須勤,等碘化鈉對人甲狀腺細胞IL6、IFNγ和TNFα基因表達的影響[J].上海免疫學雜志,2001,21(1):1820
[12]于秀杰,李慶欣,劉澤兵,等細胞趨化因子CCL21及CC趨化因子受體7在過量碘和甲狀腺球蛋白免疫誘發的NOD小鼠甲狀腺炎中的表達[J].中華地方病學雜志,2015,34(4):260264
[13]俞靈鶯,馬麗珍細胞因子與橋本甲狀腺炎及其相關防治進展[J].中國中西醫結合雜志,2016,36(3):379383
[14]胡天一,劉戈力趨化因子CXCL10及其受體CXCR3與Graves病[J].天津醫科大學學報,2010,16(4):693696
[15]趙冬靜初發Graves病患者~(131)I治療前后血清CXCL10、CCL22水平變化及相關研究[D].濟南:山東大學,2012
[16]張志友,方佩華細胞間粘附分子1與自身免疫性甲狀腺疾病[J].國外醫學(內分泌學分冊),2000,20(4):175178

