血清鈣磷水平在唑來膦酸治療過程中對乳腺癌骨轉移病灶進展的診斷價值
徐 蓓, 李 倩, 周宇紅, 劉天舒
復旦大學附屬中山醫院腫瘤內科,上海 200032
乳腺癌患者易于出現骨轉移,有研究[1]表明,在復發轉移性乳腺癌患者中,骨轉移率可高達70%。惡性腫瘤侵犯骨組織常導致嚴重的骨痛和骨相關事件(skeletal-related events, SREs),在luminal B型乳腺癌、有姑息性放療病史、初次發現骨轉移時伴有高鈣血癥、以及唑來膦酸等藥物治療未滿2年的患者中最為多見[2]。雙膦酸鹽具有抗骨吸收,抑制破骨細胞功能,降低腫瘤相關的骨質溶解,緩解骨痛等作用,所以目前已經成為治療骨轉移的標準藥物,但它仍然不能完全避免骨轉移病灶的進展[3]。由于骨轉移病灶的進展不僅導致嚴重的并發癥,也影響治療決策,故早期發現尤為重要。
目前,乳腺癌骨轉移的診斷大多依賴于骨的成像技術,包括CT、MRI和PET/CT等,特別是PET/CT在檢測骨轉移病灶的靈敏度方面得到越來越多的認識[4]。但這些影像學檢查方式大多存在早期檢測靈敏度不足、價格昂貴等缺點,特別是對于已經明確有惡性腫瘤骨侵犯的患者,接受雙膦酸鹽治療后,通過影像學再次評估原有骨轉移病灶的局部進展情況尚存在爭議[5]。骨活檢雖是診斷的金標準,但不是所有的骨轉移瘤患者均需要活檢,且具有侵入性和一定的操作風險,患者的接受程度不一。
近年來,骨代謝的生化指標成為骨轉移診斷和病情監測的研究熱點[6]。本研究旨在探討乳腺癌骨轉移患者血鈣和血磷水平的變化與骨病灶進展之間的關系,評估影像學確診進展之前的血鈣和血磷水平的變化程度是否可作為骨轉移灶進展的預測指標。
1 資料與方法
1.1 一般資料 選取復旦大學附屬中山醫院腫瘤內科2013年1月至2019年12月收治的女性乳腺癌骨轉移患者。所有患者均經手術切除標本病理證實或細胞學檢查證實為乳腺癌,并經影像學檢查提示存在骨轉移。在發現骨轉移后,所有病例均予4 mg唑來磷酸注射液加入0.9%氯化鈉100 mL靜脈滴注,15~30 min內輸入,第一年每4周1次,1年以后每3個月1次。治療前后均囑患者多飲水。在唑來磷酸治療的過程中每月復查肝腎功能、電解質,并定期行影像學復查,在隨訪過程中是否出現明確的骨轉移病灶進展。同時,患者不伴有除乳腺癌以外的其他部位惡性腫瘤,無嚴重心、肝、腎功能障礙。
1.2 乳腺癌骨轉移的診斷標準 符合下列2個條件者可診斷為乳腺癌骨轉移:(1)有明確的乳腺癌病史,并排除其他部位內分泌腫瘤或惡性腫瘤疾病;(2)ECT骨顯像有多發病灶,并經X射線檢查和(或)MRI檢查和(或)CT檢查診斷為骨轉移。
骨轉移進展的診斷標準:在上述標準的前提下,X射線檢查和(或)MRI檢查和(或)CT檢查發現新發腫瘤溶骨性或混合性骨破壞。
排除標準:(1)ECT骨顯像顯示單發骨病灶的患者,由于沒有骨病灶的穿刺病理,不能明確診斷為乳腺癌骨轉移的;(2)ECT骨顯像提示有骨多發病變,但是X線檢查、CT檢查和(或)MRI檢查均不能診斷的。
1.3 血鈣、血磷水平 收集患者確診乳腺癌并不伴有骨轉移時的血鈣和血磷水平作為基線狀態,收集患者骨轉移進展前1個月、2個月、3個月和6個月時的生化血鈣和血磷水平。血鈣水平正常參考值為2.25~2.75 mmol/L。血磷水平正常參考值為1.00~1.60 mmol/L。
1.4 統計學處理 應用SPSS 20.0統計軟件進行分析,計數資料采用χ2檢驗,血鈣和血磷水平隨時間的改變程度應用單樣本t檢驗,檢驗水準(α)為0.05。
2 結 果
2.1 患者一般情況 根據納入和排除標準,本研究共納入我院收治的女性乳腺癌患者42例,平均年齡(53.67±11.07)歲。15例(35.7%)未絕經,27例(64.3%)已絕經。組織學分級Ⅰ~Ⅱ級的35例(83.3%)。雌激素受體(ER)陽性的29例(69%),孕激素受體(PR)陽性的28例(66.7%);HER-2 11例(26.2%)陽性。按2011年St.Gallen乳腺癌專家共識分型,其中luminal A型25例(59.5%),luminal B型8例(19.0%),HER-2陽性型3例(7.1%),三陰型6例(14.3%)。初次發現骨轉移時伴有內臟轉移者24例(57.1%),伴有腦轉移者4例(9.5%),見表1。

表1 入組患者的一般資料 n(%)
2.2 患者血鈣和血磷水平的變化程度 患者血鈣和血磷水平在骨轉移進展前1個月、2個月、3個月和6個月時,相較基線狀態時變化的程度均無統計學差異(P均>0.05),見表2和圖1。
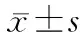
表2 影像學確診骨轉移病灶進展前1個月、2個月、3個月和6個月時,血清鈣和磷濃度較基線狀態的變化程度

圖1 影像學確診骨轉移病灶進展前1個月、2個月和3個月時,血清鈣濃度和血清磷濃度較基線狀態的變化程度
3 討 論
大多數復發轉移的乳腺癌患者會出現骨轉移,盡管在乳腺癌骨轉移的病理學方面和治療領域均有了長足的進步,乳腺癌患者骨轉移的監測和全程管理仍然是復雜的和具有挑戰性的。乳腺癌骨轉移往往會引起血鈣和血磷水平的變化,甚至發生危及生命的嚴重的高鈣血癥,在乳腺癌患者隨訪過程中,血鈣水平變化有時可以較影像學檢查更早地發現首次骨轉移的證據[7]。
唑來膦酸作為雙膦酸鹽的一種,是骨吸收的抑制劑,能夠被骨骼的破骨細胞選擇性吸收,抑制破骨細胞的活性,誘導其凋亡,預防和減少骨質的丟失,減輕骨痛和顯著降低發生高鈣血癥的風險,并且它控制血鈣水平的作用不受患者基礎血鈣水平和腎功能狀態的影響,也不受甲狀旁腺激素相關蛋白濃度、患者年齡、性別和惡性腫瘤種類的影響[8]。
但是,唑來膦酸不能取代抗腫瘤的化療和放療以及鎮痛治療,也不能完全避免治療期間SREs的再次出現。有研究分析702例骨轉移的乳腺癌患者,發現較高的體質量指數(body mass index, BMI)和溶骨性骨轉移是SREs發生的預測因素[9]。臨床上觀察到的部分SREs的發生與患者的骨轉移病灶的進展或者應激相關。
在雙膦酸鹽使用過程中以及結束后一定時期內,出現新的骨轉移病灶或原有骨轉移病灶進展的患者,其血鈣和血磷水平的變化受兩方面的影響:骨轉移病灶的進展有可能會導致高鈣血癥;唑來膦酸的使用會抑制血鈣的升高。在這種情況下,血清鈣和磷濃度的變化是否仍然可以預測患者的骨轉移病灶進展情況沒有明確的結論,既往的文獻也沒有具體探討過。
本研究表明,于影像學確診的骨轉移病灶進展前1個月、2個月、3個月和6個月時,持續接受雙膦酸鹽治療患者的血鈣和血磷水平相較基線狀態時的變化程度均無統計學差異,也就是說血鈣和血磷水平的變化不能較影像學檢查更早反映骨轉移病灶進展的情況。
有文獻報道,患者的血清肌酐和尿素氮水平對血鈣和血磷也有影響,主要是影響他們的排泄情況[10]。在本研究中,患者的腎功能情況對血鈣和血磷的影響較小,因為在回顧性收集資料時,凡是治療過程中血清肌酐和尿素氮水平出現過異常升高的患者均被排除。
OPTIMIZE-2研究[11]提示,滿一年的4周1次的唑來膦酸治療后,在骨轉移病灶穩定的情況下,將唑來膦酸的劑量頻率從每4周1次減少到每12周1次,患者發生SREs的幾率并沒有明顯增加,還可以減少下頜骨壞死的發生率。基于此項研究結論發表于2017年,我們入組的患者中2017年之后的用藥有部分采取的仍然是持續的每4周1次的唑來膦酸治療,部分患者在治療次年采用每12周1次的治療模式,這可能也在一定的程度上影響了血清鈣磷水平的變化。為盡量減輕治療模式的影響,和期望更早期發現骨轉移病灶進展的趨勢,我們同時收集了影像學確診進展之前的6個月和3個月的血清濃度,但是仍然沒有發現有統計學意義的變化。
唑來膦酸在各種骨疾病,如骨質疏松癥,多發性骨髓瘤或實體瘤的骨轉移的治療中使用,可以治療高鈣血癥,甚至有研究證實它可以導致低鈣血癥。Zuradelli等[12]評估240例雙膦酸鹽治療過程中血鈣降低的程度,患者平均年齡為62歲,其中包括122例(50.9%)乳腺癌,發現38.8%的患者出現低鈣血癥。出現低鈣血癥的患者中,評估為G1的有48.4%,G2的有39.8%,G3的為10.8%,還有1.1%出現嚴重達G4的血鈣降低。他們還報道,任何級別低鈣血癥的中位發生時間是治療開始后的2.3個月(范圍波動于0~34.9個月),從而推測雙膦酸鹽對血鈣水平的影響包括整個治療過程,并于停藥后仍有可能持續相當長的一段時間。所以12周的間隔時間可能并不會明顯減弱唑來膦酸對患者血鈣與血磷水平的影響。
此外,Zuradelli等[12]還提出血清白蛋白水平也有可能影響患者治療過程中的血鈣水平。本研究中,患者的血清白蛋白水平可能也在其中起到了一定的作用,但是具體是怎樣的作用,尚需要進一步的基礎實驗和臨床研究進行評估。
總之,本研究顯示,乳腺癌骨轉移患者在接受雙膦酸鹽治療過程中和治療結束后一定時期內,血清鈣和磷水平變化不能較影像學檢查更早地監測到骨轉移病灶進展的出現。受限于本研究為單中心回顧性研究,樣本量比較小,該結論還需要大樣本隨機研究來進一步證實。同時,病理作為診斷的金標準,本研究中的患者大多數沒有骨病灶穿刺活檢的病理診斷對新發病灶加以證實,盡管目前國際和國內的指南均沒有要求所有的骨可疑病灶都必需活檢病理診斷,既往骨轉移相關研究也很少采取骨病灶多處采樣活檢的方式,但主要依據影像學診斷可能還是對研究結果帶來了一定的偏差。值得注意的是,目前已經在研究中的部分骨代謝的生化指標,比如:骨鈣素被發現是診斷溶骨和成骨細胞轉移的最佳生物標志物之一,大多由于具有晝夜節律性或者是季節波動性,而同樣不能精確提示骨轉移灶的變化情況[6]。故目前尚缺乏能夠作為骨轉移進展評估標準的合適的生化指標。

