依帕司他對糖尿病周圍神經病變患者血清胱抑素C及多倫多臨床評分系統的影響
彭少林 楊水冰 沙永紅 楊井金 陸小玉 張玲 楊嬌嬌 唐維 岳成思 楊康 向建平 劉莉 張美彪
(1懷化市第一人民醫院內分泌代謝科 國家代謝性疾病臨床醫學研究中心懷化分中心,湖南 懷化 418000;2吉首大學醫學院)
糖尿病周圍神經病變(DPN)是一特異的糖尿病微血管并發癥,容易造成神經結構改變及功能障礙進而產生麻痛、發涼、感覺減退等臨床癥狀體征。據文獻報道,存在10%~20%的糖尿病患者在就診之初就已然發生了DPN,在糖尿病確診后的5年、10年、20年,DPN發生率為30%~90%〔1〕。鑒于DPN的發病率高且隱匿性強,如果不夠重視其影響或者采取的診療療措施不適當,則有可能產生嚴重感覺缺失、疼痛、潰瘍及感染等并發癥,進而導致機體損傷,最終發生截肢致殘風險〔2〕。DPN發病機制復雜,嚴格控制血糖是其治療前提,基于多種靶點的降糖藥物出現為DPN的治療提供了新武器。依帕司他是一種抑制DPN發病機制中醛糖還原酶的藥物,在DPN治療中有較好的療效及安全性。研究發現胱抑素(Cys)C為DPN的潛在血清生物標志物〔3,4〕。目前關于依帕司他對DPN的研究絕大部分涉及其神經傳導速度等方面影響,較少與CysC聯系。本研究旨在探討依帕司他治療DPN患者前后血清CysC與多倫多臨床評分系統(TCSS)變化,推測其可能的機制及療效。
1 資料與方法
1.1基本資料 2016年4月至2017年4月就診于懷化市第一人民醫院住院的2型糖尿病患者105例,區組隨機化分為單藥治療組(E組)、聯合治療組(EM組)、甲鈷胺對照組(M組)各35例。參與研究的入組者均符合WHO 1999年中關于糖尿病的診斷標準及2017版糖尿病防治指南中有關DPN診斷標準〔5〕。排除標準:①伴有腦卒中等腦血管疾病后遺癥及頸腰椎疾病;②存在格林巴利綜合征;③存在心、肝、腎功能嚴重受損;④存在靜脈栓塞、淋巴管炎在內的嚴重動靜脈血管性疾病;⑤妊娠期、惡性腫瘤、藥物試驗過敏者;⑥近期(1個月內)有使用或正在使用甲鈷胺、依帕司他、大劑量糖皮質激素;⑦存在精神狀態異常、行為反常不能進行該項研究者及未履行簽署知情同意書。該項研究獲得醫院倫理委員會的審批,所有入組者由本人或其法定代理人見證下簽署知情同意書。治療12 w后進行隨訪,刪除失訪數據并完善補充其他數據資料后最終得到E組33例(男19例,女14例),EM組30例(男12例,女18例),M組34例(男21例,女13例)。三組基線資料無統計學差異(P>0.05)。見表1。
1.2干預方法 基礎治療:入組的研究對象均根據《中國2型糖尿病防治指南》進行生活方式干預(包括糖尿病飲食及運動),同時平穩降糖(口服降糖藥物或者胰島素,入組之前和之后方案基本不變),調控血脂藥物基本一致(入組之前和之后方案基本不變)。
E組:基線治療措施+依帕司他片(商品名稱唐林,由揚子江藥業集團南京海陵藥業有限公司生產,批準文號是國藥準字H20040840)50 mg/次,3次/d。EM組:基礎治療措施+依帕司他片(用法同E組依帕司他用法)+口服甲鈷胺片(商品名稱奇信,由揚子江藥業集團南京海陵藥業有限公司生產,批準文號是國藥準字H20052325)0.5 mg/次,3次/d。M組:基線治療措施+甲鈷胺片(用法同EM組甲鈷胺用法)。整個治療周期為12 w。
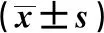
表1 3組基線資料水平比較
1.3監測項目及指標 一般臨床資料:包括年齡、性別、身高、體重、體重指數、血壓、糖尿病病程等。
生化指標檢測:前日夜間禁食至少8 h,次日清晨空腹抽取肘靜脈血3 ml送至檢驗科專用生化檢測儀器檢測血糖(包括空腹及餐后2 h)、糖化血紅蛋白、肝功能、腎功能、血脂、CysC等。
神經癥狀與體征評分:所有研究入組患者采用多倫多臨床評分系統(TCSS)〔6〕評估DPN患者的臨床癥狀與體征,由專人登記每一名入組者治療前后各相關指標數據并匯總。
1.4統計學方法 采用SPSS21.0軟件進行方差分析,LSD-t檢驗及χ2檢驗。
2 結 果
2.1各組治療前后血糖控制情況 治療后3組空腹血糖、餐后2 h血糖、糖化血紅蛋白均有不同幅度降低,但均無統計學差異(P>0.05)。見表2。
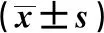
表2 3組治療前后血糖控制情況比較
2.2各組CysC水平比較 組內比較,3組治療前后CysC濃度有統計學差異(P<0.05,P<0.01)。E、EM組治療后CysC水平較M組明顯降低(P<0.05),EM組治療后CysC較E組下降更明顯(P<0.05)。見表3。

表3 3組治療前后血清CysC水平變化
2.3各組TCSS變化情況比較 治療前各組TCSS評分無統計學差異(P>0.05)。組內比較,M組治療后TCSS評分較治療前下降,但差異無統計學意義(P>0.05);E、EM組治療前后TCSS評分差異有統計學意義(P<0.05,P<0.001)。治療后EM組較其余兩組TCSS評分顯著下降(P<0.001)。見表4。
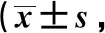
表4 3組治療前后TCSS評分情況分)
3 討 論
神經細胞為一永久性細胞,一旦發生損傷則難以進行修復,輕者產生感覺異常等癥狀,重者發生永久性壞死。DPN的發病具體機制牽涉多種通路,彼此間相互制約聯系且較為復雜,一旦發生DPN臨床上僅能改善相關癥狀及體征,難以真正逆轉損傷,且目前尚缺乏特效治療手段。醛糖還原酶(AR)是多元醇通路中催化反應速度最慢的一種酶,高血糖時,AR在人體內極為活躍的接受還原型輔酶Ⅱ提供的氫元素,形成新的化合物后將體內葡萄糖進一步轉化成山梨醇,過度激活多元醇通路,造成山梨醇產生過多堆積;此外上述過程中可導致體內肌醇過多消耗、過度氧化應激等,致使神經元細胞的神經結構及功能發生變化導致神經損傷〔7〕。依帕司他為一種AR抑制劑,研究發現其可與AR結合并抑制其活性,這一過程是可逆的、非競爭性的;當其抑制上述酶的活性后,葡萄糖向山梨醇轉化過程受到影響,使得山梨醇生成量減少,從而抑制多元醇通路的激活,減輕氧化應激反應,控制細胞炎性反應與程序性死亡,改善微循環障礙,調節能量代謝的失衡,提高鈉-鉀-三磷酸腺苷(ATP)酶活性,有利于神經組織的損傷修復〔7,8〕。國內的一項多中心研究也顯示〔9〕,依帕司他不僅能改善DPN患者麻木、疼痛等臨床癥狀,還能修復神經損傷進而提高神經傳導速度〔10,11〕。本研究結果與李平等〔9〕研究結論一致。
CysC是一種微小的小分子蛋白,由120個氨基酸肽鏈組成,約13 kD,Anastasi團隊發現其是一種半胱氨酸蛋白酶可逆性的競爭抑制劑,在細胞內蛋白質和多肽的分解代謝中起重要作用。研究發現〔12~14〕,CysC可作為糖尿病診斷后用于監測神經病變發生的危險因子。CysC是一種內源性半胱氨酸蛋白酶的抑制劑,在體內適宜條件下能夠抑制蛋氨酸合成酶等酶的活性,造成分解同型半胱氨酸的代謝過程受阻,使得同型半胱氨酸蓄積,進而導致微血管的內皮細胞受損,同時同型半胱氨酸還可以抑制舒血管物質一氧化氮的合成,使微血管血流減少從而導致神經纖維缺血損傷〔15,16〕。本研究提示聯合治療對CysC影響更大,推測可能機制為依帕司他減輕氧化應激和抑制多酚通路來降低CysC水平。此外,有研究表明CysC還可以激活體內單核/巨噬細胞等炎性細胞產生炎癥因子發生炎癥反應,血管平滑肌增殖,血管內皮細胞功能受損發生微血管病變引起DPN〔17〕;此外,高水平的CysC可擾亂體內凝血-纖溶系統、損傷血管內皮細胞導致產生DPN〔8〕。研究發現依帕司他能通過抑制蛋白激酶通路上調內皮細胞一氧化氮的產生〔7〕。因此,依帕司他亦可能通過上述機制降低CysC產生。
綜上,依帕司他可能通過降低氧化應激反應、控制細胞炎性反應、改善微循環障礙等作用機制來降低DPN患者血清CysC水平。本研究也存在以下不足:該研究推測依帕司他可能通過降低氧化應激反應等來降低CysC水平,但未就具體氧化應激指標(如超氧化物歧化酶等)、內皮細胞功能相關指標(如一氧化氮等)進行檢測,下一步需完善。因此,本研究提示依帕司他聯合甲鈷胺治療方案降低TCSS評分的作用非常明顯,能夠顯著減緩DPN患者臨床癥狀。由于本研究樣本數量偏少,觀察周期較短,還需大樣本、長時間觀察隨訪。

