富馬酸替諾福韋二吡呋酯聯合雙重血漿分子吸附系統序貫血漿置換治療慢加急性乙型肝炎肝衰竭患者療效分析
董 靜,劉龍梅,陳照林,陳 曦,宋海燕,呂榮德,張駿飛,劉 波
乙型肝炎相關性慢加急性肝衰竭(HBV related acute-on-chronic liver failure, HBV-ACLF)是最為常見的肝病危重癥,是指在慢性肝臟病變的基礎上,在短期內出現以凝血功能障礙和高黃疸為主要特征的急性肝損傷,病死率可達到60%~80%。早期判斷疾病進展和積極治療對改善預后具有重要的意義[1,2]。在內科綜合治療的基礎上早期給予人工肝(artificial extracorporeal liver support,AELS)治療,可獲得病情控制,有時疾病進展,則需要進行肝移植[3]。血漿置換(plasma exchange,PE)、血液灌流(hemoperfusion,HP)和雙重血漿分子吸附(double plasma molecular absorb system,DPMAS)是目前國內常用的人工肝治療模式。三種人工肝治療方法均可顯著控制疾病進展,但也各自存在局限性[3-5]。PE存在血漿供應不足和過敏反應等風險[6],HP是血液吸附治療,其缺點在于其不能有效地吸附小分子毒物,且對與白蛋白結合的毒素,活性炭的吸附能力也很差,同時還可能激活補體系統而引起系統炎性反應。DPMAS可較好地解決PE血漿供應不足的問題,同時可有效清除血清內毒素、炎癥介質和細胞因子,被更多地應用于治療HBV-ACLF患者,但該治療無法有效改善患者的凝血功能,仍需要PE進行輔助[7]。富馬酸替諾福韋二吡呋酯(tenofovir disoproxil fumarate, TDF)可很快使高HBV DNA載量的患者血清病毒降低至檢測線以下[8]。本研究探討了TDF聯合DPMAS序貫PE治療HBV-ACLF患者的近期療效,現報道如下。
1 資料與方法
1.1 臨床資料 2016年9月~2019年9月聯勤保障部隊第901醫院感染病科住院治療的HBV-ACLF患者50例,男39例,女11例;年齡32~68歲(52.2±15.1歲)。診斷符合2012年中華醫學會感染病學分會和肝病學分會發布的《肝衰竭診治指南》的標準[3]。納入標準:①為HBV感染者,血清HBsAg陽性超過6個月;②血清總膽紅素(total bilirubin, TBIL)>171μmol/L,血漿凝血酶原活動度(prothrombin time activity, PTA)<40%。排除標準:合并其他類型的病毒性肝炎或人類免疫缺陷病毒感染、膽汁性、酒精性和自身免疫性肝病或藥物中毒、已接受肝臟移植、嚴重的腎功能不全、長期接受抗凝藥物治療患者。將患者分為觀察組25例和對照組25例,分別采用TDF聯合PE序貫DPMAS治療和TDF聯合PE治療。本研究通過第901醫院醫學倫理委員會批準,患者簽署知情同意書。
1.2 治療方法 給予所有患者常規內科綜合治療,包括苦參堿、丁二磺酸腺苷蛋氨酸、多烯磷脂酰膽堿、促肝細胞生長素、血漿和白蛋白等基礎治療和TDF(韋瑞德,GSK)300mg口服,1次/d,抗病毒治療。在對照組,予以PE治療,采用肝素鈉鹽水對管路進行預處理,血流速度為100~150 ml/min,血漿分離速度為20~30 ml/min,新鮮冰凍血漿置換量為2000~3000 ml,置換時間為1.5~2.0 h。每例患者平均治療2~3次,間隔2~3 d;觀察組在前述綜合內科治療的基礎上進行PE序貫DPMAS治療,主要治療儀器包括DX-10血液凈化機(珠海健帆)、OP-08W型血漿分離器(旭化成,日本)、HA330-Ⅱ 樹脂血液灌流器(珠海健帆)和BS330血漿膽紅素吸附器(珠海健帆)。具體方法如下:使用血漿置換模式連接管路,預先用0.9%氯化鈉注射液1000 ml預充,排盡管路和柱體內氣體,再用含肝素鈉20 mg的生理鹽水500 ml進行肝素化預充,約30 min后達到整個管路肝素化,連接、密閉管路,用10~20 mg肝素抗凝,依據患者特征,調節肝素使用量。治療前,常規給予地塞米松5 mg靜脈注射、10%葡萄糖酸鈣20 ml持續微泵注入,術中將血流速度設置為100~120 ml/min,吸附時間為120~180 min,或達到血漿處理量3600~5400 ml。在DPMAS治療結束后,將血液泵流量調至最小,夾閉動靜脈端,前后夾閉吸附柱端,更換至“單模血漿置換”模式,調節分漿泵、返漿泵比例為1:1,血漿分離24%,溫度38℃,血漿連接返漿泵,打開廢液端夾子,打開動脈端靜脈端夾子,對血液泵調速,血流速度設置為100~120 ml/min,新鮮冰凍血漿置換量為600~1000 ml,置換時間為30~40 min。在治療結束后,采用硫酸魚精蛋白注射液對抗肝素,劑量為肝素用量的一半,最高<50 mg。治療間隔2~3 d。依據患者病情,調整DPMAS序貫PE治療的次數。在治療過程中密切監測血壓、脈搏和心率等生命指標。
1.3 檢測和檢查 使用日立7600全自動生化分析儀和上海長征醫學科學有限公司的試劑檢測血生化指標;使用貝克曼庫爾特ACL200全自動凝血分析儀和南京碧云天生物檢測公司提供的試劑檢測凝血功能指標;使用Sysmex XE-2100全自動血液分析儀及其配套試劑檢測血常規指標,并分別計算血小板/淋巴細胞比值(PLR)、中性粒細胞/淋巴細胞比值(NLR);使用武漢明德生物科技股份有限公司提供的QMT8000免疫定量分析儀及其配套試劑檢測血降鈣素原(免疫層析法);采用ELISA法檢測血清白細胞介素-6(北京熱景生物技術股份有限公司)。
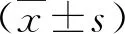
2 結果
2.1 兩組血生化指標和凝血功能指標的比較 在治療12周末,觀察組血清TBIL、ALT、INR顯著低于對照組,而血清ALB和PTA水平顯著高于對照組,差異有統計學意義(P<0.05,表1)。
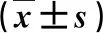
表1 兩組血生化指標和凝血功能指標比較
2.2 兩組血清炎癥因子和模型指標的比較 在治療12周末,觀察組血清PCT、IL-6、PLR和NLR水平顯著低于對照組,差異有統計學意義(P<0.05,表2)。

表2 兩組血清炎癥因子和模型指標比較
2.3 轉歸情況 在治療12周末,兩組并發癥發生率比較無統計學差異(P>0.05,表3)。在隨訪觀察過程中,對照組生存12例(48.0%)例,死亡13例(52.0%),其中2例死于上消化道出血,4例死于肝腎綜合征,3例死于肝性腦病,4例死于肺部真菌感染;觀察組生存18例(72.0%,P<0.05),死亡7例(28.0%),其中1例死于上消化道出血,2例死于肝腎綜合征,1例死于肝性腦病,3例死于肺部真菌感染。

表3 兩組并發癥發生率(%)比較
3 討論
抗病毒治療是HBV相關肝衰竭治療的基本用藥,并顯著改善了HBV-ACLF患者的預后[9-11]。TDF對核苷類初治及經治的慢性乙型肝炎患者均表現出較好的療效,且耐藥性極為少見[12]。
PE采用血漿分離和置換等量新鮮冰凍血漿治療,可有效補充凝血因子,同時清除內毒素、膽紅素、膽汁酸等內源性毒素,還可清除循環免疫復合物等大分子物質[13-14]。但PE無法清除血漿水溶性毒素,對肝性腦病的改善作用也極為有限[15]。DPMAS采用新型膽紅素吸附柱及血液灌流器,兩者聯合進行雙重血漿吸附。其中新型膽紅素吸附柱,如陰離子交換樹脂吸附柱,可實現與膽紅素的高效結合,而新型血液灌流器,如中性大孔樹脂吸附柱,具備大孔結構和大比例表面積,可高效吸附與蛋白結合的毒素或炎癥介質[16]。DPMAS序貫PE可實現協同和互補作用,增強了對膽紅素的清除能力,更為有效地清除水溶性物質和與蛋白質結合的炎癥介質,進而改善ACLF患者內環境,緩解肝性腦病,促進肝臟功能恢復[17]。本研究顯示,采用DPMAS序貫PE治療的觀察組患者在治療后血清ALT、TBIL、ALB、PCT、IL-6和INR顯著下降。本研究顯示采用DPMAS序貫PE治療的患者血清PCT降低更為迅速,提示該方案可獲取更好的短期預后。生存分析結果顯示觀察組12周生存率較高。本研究進一步探討了不同治療方案對患者近期PLR和NLR的影響。研究顯示,基線PLR和NLR過高提示霍奇金淋巴瘤或肝衰竭近期預后差[18-20]。本研究顯示,觀察組患者治療后PLR和NLR降低更為顯著。上述結果提示,以TDF作為基礎抗病毒的治療方案,聯合DPMAS和PE可更為有效地促進HBV-ACLF患者血清毒素的清除,進而改善患者的近期預后。既往報道內科治療HBV-ACLF患者的近期生存率為38%~39.5%,而人工肝系統治療患者生存率的改善并不確切[19]。HBV-ACLF患者近期生存率主要決定于其疾病分期,而人工肝系統治療對晚期患者生存率的影響并不顯著。

