磷酸川芎嗪通過激活AMPK 對HT22 細胞在氧糖剝奪損傷中的保護作用
劉劍敏 董俊麗 唐靜宜 陳 凡
(武漢市第一醫院, 湖北武漢430022)
缺血性腦損傷致殘率和致死率高,是人類生命健康的重要威脅[1];因此,開發治療腦缺血再灌注損傷的藥物是當前研究的熱點之一。大量研究結果表明,川芎嗪可保護線粒體[2]、促進能量代謝[3]、清除氧自由基、抗炎[4]、抑制鈣超載、維持細胞鈣穩態[5?6]、抗細胞凋亡[7]等多方面抗心腦細胞缺血再灌注損傷及感染性腦水腫所致的腦組織損傷。同時,也有研究[8]表明川芎嗪對腦微血管內皮細胞損傷具有一定保護作用。川芎嗪對腦神經細胞缺血再灌注損傷的保護機制仍未明確。本實驗采用小鼠海馬神經元HT22 細胞,通過氧糖剝奪(oxygen and glucose deprivation,OGD) 的方法離體模擬腦缺血再灌損傷,初步探討磷酸川芎嗪對HT22 細胞攝取葡萄糖能力及保護作用機制。
1 材料
1.1 細胞株 小鼠海馬神經元細胞系HT22 細胞(武漢大學典型培養物保藏中心)。
1.2 藥物與試劑 磷酸川芎嗪(中國食品藥品檢定研究院,純度為99.2%,批號100845?201702),臨用前用培養基配成相應濃度,過濾除菌后備用;DMEM/F12 培養基、胎牛血清、胰酶(美國Gibco 公司);CCK?8 試劑盒(碧云天生物技術研究所);DMSO (美國Sigma 公司);連二亞硫酸鈉(南京化學試劑一廠);p?AMPK 抗體(Thr172,兔抗鼠一抗)、AMPK 抗體(美國Cell SignalingTechnology 公司);其余試劑均為國產市售分析純。磷酸鹽緩沖液用前稀釋使用。
1.3 儀器 2306?2 型CO2培養箱(美國Shellab 公司);SW?CJ?2FD 型超凈工作臺(蘇州安泰空氣技術有限公司);BX?51 型倒置相差顯微照相系統(日本Olympus 公司);ELX8 全自動酶標儀(德國Bioztek 儀器公司);Western blot電泳裝置 (美國Bio?Rad 公司);Western blot 轉膜裝置(北京六一儀器廠);凝膠成像系統(以色列DNR 公司)。
2 方法
2.1 HT22 細胞培養 HT22 細胞培養采用含10%滅活胎牛血清的高糖DMEM 培養基,細胞常規培養于37 ℃、平衡濕度、含5%CO2和95%O2的培養箱中培養。細胞常規復蘇后傳代1~2 代進行模型建立,以后每隔2 d 全量換液,或根據培養基顏色定期換液,直到相關實驗結束。
2.2 造模與分組 當HT22 細胞長至近70% 時,用0.125%胰酶消化,調整細胞濃度至1×105個/mL,接種于24 孔板,繼續培養細胞長滿單層厚進行分組。因在缺血性腦損傷治療領域明確具有能量代謝機制的陽性對照藥缺乏,故未設置陽性對照。將細胞隨機分為空白對照組、模型組、磷酸川芎嗪(5、10、15 μg/mL) 組,每組6 孔,磷酸川芎嗪在OGD 前預處理24 h。上述各組孵育24 h 后,空白對照組各孔加入2 mL 高糖DMEM 培養基,OGD 模型組和磷酸川芎嗪預處理組各孔加入含連二亞硫酸鈉(2 mmol/L)的無糖DMEM 培養基,于培養箱內(37 ℃,5% CO2、95%N2) 孵育4 h,最后復糖復氧24 h。以CCK?8 試劑盒測定各組細胞存活率,細胞存活率=(OD給藥組/OD空白對照組)×100%。
2.3 葡萄糖攝取能力檢測 參考文獻[9?10],測定磷酸川芎嗪對HT22 細胞葡萄糖攝取能力的影響。通過檢測2?脫氧葡萄糖熒光類似物(2? [N? (7?nitrobenz ?2? oxa ?1,3 ?diaxol ?4?yl) amino] ?2? deoxyglucose,2?NBDG) 的熒光強度來評價各組細胞對葡萄糖攝取活性。各組處理后的HT22 細胞,加入2?NBDG (100 μmol/L) 孵育30 min,以4 ℃PBS 清洗3 次,設定激發波長為488 nm,發射波長為542 nm,通過熒光顯微鏡及全自動酶標儀探測各孔熒光強度,并通過熒光強度與每孔細胞的數量比值表示HT22 細胞葡萄糖攝取能力,最后結果以空白對照組為100% 進行換算。
2.4 Western blot 法檢測HT22 細胞AMPK、p?AMPK 蛋白表達 收集各組實驗處理后的HT22 細胞,以蛋白提取試劑盒進行總蛋白提取,采用BCA 法檢測蛋白濃度。采用SDS?PAGE 電泳,配制10%分離膠,5%濃縮膠,蛋白上樣量為30 μg,進行電泳 (80 V,30 min;隨后110 V,60 min),切膠,轉膜(250 mA 恒流,90 min),室溫下5%脫脂奶粉封閉90 min,TBST 清洗后,加入一抗p?AMPK(1 ∶500)、AMPK (1 ∶500)、β?actin (1 ∶2 000),4 ℃孵育過夜;TBST 清洗,加入二抗孵育(1 ∶2 000) 孵育1 h。TBST 清洗3 次,將ECL 發光液A、B 各500 μL 等量混合后,將NC 膜浸泡在混合液里,避光1 min,掃描儀掃描條帶,應用Image J 軟件對蛋白信號結果進行分析。
2.5 統計學分析 利用SPSS 22.0 軟件進行統計分析,并使用Graph Pad Prim 6 軟件繪圖,數據以() 表示。多組間比較采用方差分析,組間兩兩比較采用LSD 法,以P≤0.05 為差異具有統計學意義。
3 結果
3.1 磷酸川芎嗪對HT22 細胞活性的影響 如圖1 所示,OGD 模型組HT22 細胞核固縮,胞體膨脹甚至破裂,細胞膜不完整,折光性差;隨著磷酸川芎嗪濃度的增加,HT22細胞胞體變得飽滿,邊緣逐漸光滑,且有較強折光性;從細胞形態學上,磷酸川芎嗪對OGD 損傷HT22 細胞具有保護作用。如圖2 所示,與空白對照組比較,模型組HT22細胞存活率降低(P<0.01),而磷酸川芎嗪預處理后,隨著濃度增加,細胞存活率呈升高趨勢,其中磷酸川芎(10、15 μg/mL) 存活率升高(P<0.05,P<0.01)。
3.2 磷酸川芎嗪對HT22 細胞2?NBDG 的攝取的影響 如圖3 所示,與空白對照組(100±0.26)%相比,經OGD 處理后HT22 細胞對2?NBDG 的攝取能力下降 [(45.17±0.92)%,P<0.01];經5 μg/mL 磷酸川芎嗪預處理后,細胞對2?NBDG 的攝取能力增加到(75.37±2.08)%;與模型組比較,15 μg/mL 磷酸川芎嗪預處理下的HT22 細胞對2?NBDG 的攝取能力增加到[(108.00±3.02)%,P<0.01]。糖氧剝奪造成HT22 細胞活性下降,對2?NBDG 的攝取能力顯著下降;磷酸川芎嗪預處理可提高HT22 細胞對2?NBDG的攝取能力。

圖1 各組HT22 神經元形態學變化(標尺=50 μm)
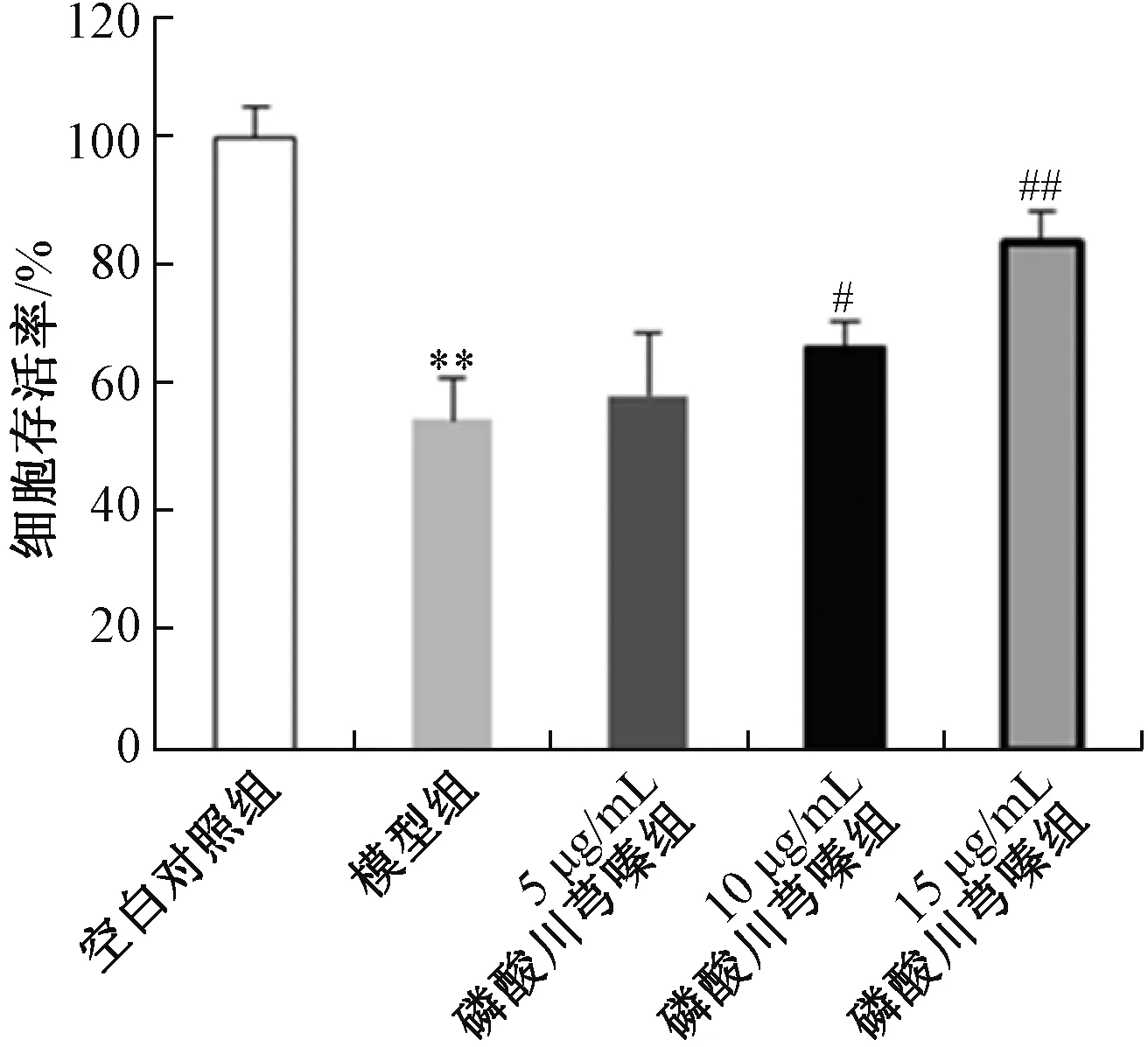
圖2 磷酸川芎嗪對HT22 細胞存活率的影響(n=3)

圖3 磷酸川芎嗪對HT22 細胞2?NBDG 攝取的影響(n=3)
3.3 磷酸川芎嗪對糖氧剝奪下HT22 細胞p?AMPK 蛋白表達的影響 如圖4 所示,與空白對照組比較,OGD 并不改變HT22 細胞中AMPK 表達,磷酸川芎嗪預處理也不改變HT22 細胞中AMPK 表達。與空白對照組比較,OGD 上調HT22 細胞中p?AMPK 的表達(P<0.05);同時,HT22 細胞p?AMPK 隨著磷酸川芎嗪濃度的增加而增加,其中15 μg/mL 磷酸川芎嗪組p?AMPK 增加具有統計學意義(P<0.05)。以上實驗結果表明OGD 能促進HT22 細胞p?AMPK的表達,同時,磷酸川芎嗪預處理明顯激活AMPK 而上調p?AMPK 的蛋白表達。

圖4 各組細胞p?AMPK、AMPK 蛋白表達(n=3)
4 討論
缺血性腦損傷有很高的致殘率和致死率,是威脅人類生命健康的一個重要原因,因此,其預防和治療非常重要。短時氧糖剝奪可模擬在某些疾病狀態下(如腦卒中) 引起的氧糖供應缺乏,延時再灌則反映氧糖供應缺乏的基礎上恢復氧糖供應后細胞的損傷狀況,即氧糖剝奪再灌注可模擬機體的缺血?再灌注損傷。本研究采用小鼠海馬神經元細胞系HT22 細胞,是為了更好的模擬缺血?再灌注損傷時腦內神經元的活性變化。
2?脫氧葡萄糖(2?DG) 為天然D 型葡萄糖衍生物,其2 位氧可被熒光基團NBD 取代,成為熒光標記的2?NBDG。它與2?DG 類似,都可通過葡萄糖轉運體GLUT1 識別轉運入細胞內[9]。2?NBDG 常被用作細胞葡萄糖攝取的敏感探針,細胞攝取2?NBDG 后熒光強度的變化可以通過熒光酶標儀、激光共聚焦掃描成像和流式細胞儀等技術檢測,其中以熒光酶標儀檢測法更簡單快速易行[10]。本研究發現在OGD 發生后,HT22 細胞活性下降,對2?NBDG 的攝取能力大大下降;在磷酸川芎嗪預處理下,HT22 細胞對2?NBDG的攝取能力隨著磷酸川芎嗪濃度的增加而逐漸增加,這提示磷酸川芎嗪對神經元缺血再灌注損傷的保護作用,可能與細胞對葡萄糖的攝取有關。
研究者發現AMPK 通過增加在胞內的葡萄糖轉運以及糖酵解,維持AMP 與ATP 穩態,而使得細胞生存[11?12]。本研究中無論是OGD 處理,還是磷酸川芎嗪預處理均不改變HT22 細胞中AMPK 的表達;然而,OGD 可以激活HT22細胞AMPK,上調p?AMPK 表達。AMPK 作為細胞能量代謝的關鍵調節器,正常生理條件下無活性,任何導致AMP/ATP 升高的因素(如缺血缺氧、氧化應激等),均會激活AMPK[13]。本研究中隨著磷酸川芎嗪濃度的增加,HT22 細胞對2?NBDG 攝取能力的增加,是否與p?AMPK 表達上調存在一定關聯,值得進一步研究。磷酸川芎嗪有可能通過激活AMPK,增加在胞內的葡萄糖轉運,而發揮對神經元缺血再灌注損傷的保護作用。p?AMPK 參與產能反應,促進葡萄糖攝取、糖酵解等,使得ATP 產生增加,同時抑制蛋白質合成等耗能反應,減少ATP 消耗[14]。在短期能量缺乏下,p?AMPK 通過促進星形膠質細胞增加糖酵解[15]。也有研究表明長時間過度激活AMPK 會加重腦組織損傷,Compound C (AMPK 抑制劑) 具有神經保護作用[16]。產生以上不一致結果的原因可能與實驗細胞、模型制作等差異有關[17]。如何在合適的時間給予合適強度的激活AMPK 干預,可能是實現腦缺血保護的關鍵。
綜上所述,在HT22 細胞氧糖剝奪損傷模型中,磷酸川芎嗪預處理可上調p?AMPK 表達,增加HT22 細胞的對葡萄糖的攝取,維持了胞內的能量平衡,從而發揮對缺血再灌注損傷的保護作用。

