電針和CO2激光灸對奧沙利鉑所致周圍神經毒性大鼠的外周保護機制
施舍,范神棟,王鳳嬌,張雪慧,王珂,具紫勇
(1.上海中醫藥大學,上海 201203;2.上海中醫藥大學附屬岳陽中西醫結合醫院,上海 200437)
奧沙利鉑(oxaliplatin, OXA)作為第三代鉑類抗腫瘤藥物,具有高效性、低毒性和安全性,廣泛應用于結直腸癌、胰腺癌和胃癌的治療[1]。然而,奧沙利鉑往往會引起周圍神經病變,主要包括感覺異常,例如機械性異常性疼痛或冷異常性肢體感覺異常[2]。作為最主要的劑量限制性毒性,奧沙利鉑誘導的周圍神經病變(oxaliplatin-induced peripheral neuropathy,OIPN)嚴重影響了癌癥患者的生存質量[3]。目前尚無確定的治療策略可預防這些不良反應[4]。臨床研究表明,無論是針刺治療還是艾灸治療均能緩解奧沙利鉑所致的周圍神經毒性[5-6],但兩者之間是否具有相似的效應和機制尚不明確。電針是在傳統手針基礎上發展起來,其刺激參數具有良好的可控性[7]。同樣,CO2激光灸是在傳統艾灸的基礎上發展而來的一種光灸刺激方法,能較好地模擬傳統隔物灸的效應發揮治療作用,同時具有較好的可重復性[8-10]。因此,為了探討電針和 CO2激光灸治療OIPN的可能機制,筆者進行了本項研究。
1 材料與方法
1.1 實驗動物與分組
成年健康清潔級雄性 SD大鼠 40只,體質量(200±20)g,由上海西普爾-必凱實驗動物有限公司提供[SCXK(滬)2013-0016],飼養于上海中醫藥大學動物實驗中心。自由進食飲水,每日光照 12 h。動物實驗倫理委員會批準編號為201710002。用SPSS21.0軟件產生隨機化分組方案。隨機取10只大鼠作為對照組;其余30只造模成功的大鼠隨機分為模型組、電針組、和CO2激光灸組,每組10只。
1.2 主要試劑與儀器
奧沙利鉑(南京制藥廠有限公司,批號H20000686);兔抗瞬態電壓感受電位錨定蛋白 1(transient receptor potential ankyrin 1, TRPA1)多克隆抗體(Thermo Fisher);鼠抗神經生長因子(nerve growth factor, NGF)單克隆抗體(Santa Cruz);羊抗兔、羊抗鼠二抗(上海威奧生物科技有限公司);Von-Frey纖維絲(DanMic Global,美國LLC公司);冷熱板測痛儀(YLS-21A,濟南益延科技發展有限公司);針灸毫針(GB2024-94,蘇州醫療用品廠有限公司);韓氏穴位神經刺激儀(HANS-200E,南京濟生醫療科技有限公司);CO2激光灸療儀(SX10-C1,上海萬奇光電技術有限公司);透射電子顯微鏡(JEM-1230,日本電子株式會社廣州事務所)。
1.3 模型制備
將奧沙利鉑溶液充分溶解于 5%的葡萄糖溶液,濃度為 1 mg/mL;除空白組外,其余大鼠每隔 1 d以2 mg/kg劑量給予共4次腹腔注射(第1天,第3天,第5天和第7天),建立OIPN模型[11],對照組采用相同的造模方法用等體積的5%葡萄糖溶液進行腹腔注射。
1.4 干預方法
大鼠最后一次奧沙利鉑注射后,第2天開始治療,隔日 1次,共 7次。電針組取雙側足三里穴,使用0.25 mm×13 mm毫針直刺大鼠膝關節后外側,腓骨小頭下約5 mm處,深度7 mm,針刺完畢后,針灸針與韓氏電針儀相連,頻率為2 Hz,電流強度為1 mA,選連續波,每穴每次30 min。CO2激光灸組使用CO2激光灸療儀灸雙側足三里穴,功率80 mV,每穴每次15 min。
1.5 觀察指標與檢測方法
1.5.1 大鼠機械性痛覺敏化測試
各組大鼠于造模前、造模后、電針和 CO2激光灸第4次和第7次治療后進行機械性痛覺敏化測試。將各組大鼠分別放于測試架的金屬網上,測試前將大鼠放于金屬網上 15 min。參考之前的報道[12-13],采用“up-down”的方法測定大鼠 50%縮足閾值(paw withdrawal threshold, PWT)。采用 1 g、4 g、10 g、15 g、26 g、60 g的Von-Frey纖維絲進行刺激,以纖維絲呈現“S”形為度,每次持續5 s,大鼠的每側足底分別測量 6次,每一次測量需要和上一次測量時間間隔6 s以上,大鼠在刺激時間內或在移開纖維絲時所立即出現的快速的抬足反應記為陽性反應。
1.5.2 大鼠冷刺激敏感度測試
各組大鼠于造模前、造模后、電針和 CO2激光灸第4次和第7次治療后進行測試。打開冷熱板測痛儀,將溫度設定在 4℃,待板上溫度恒定并達到設定溫度時,將大鼠置于冷板上,記錄5 min內大鼠抬足或舔足的次數,連續測定3次,取平均值為最后結果[14]。
1.5.3 大鼠坐骨神經電鏡下組織形態學觀察
于最后一次痛閾測試結束后,各組大鼠腹腔注射深度麻醉,俯臥位固定,鈍性分離坐骨神經2 cm左右。將用于Western blot檢測的坐骨神經用錫箔紙包裹迅速凍于液氮中,然后轉移至-80℃冰箱中保存備用。而用于透射電鏡觀察實驗的坐骨神經則置于 4℃預冷的2.5%戊二醛緩沖液中固定,按照說明操作進行清洗、固定、滲透等步驟,最后在透射電子顯微鏡下觀察并拍照。
1.5.4 TRPA1、NGF蛋白表達檢測
對坐骨神經組織進行蛋白上清液的制備和濃度測定。每個樣本取30 μg蛋白上樣,10%聚丙烯酰胺凝膠電泳,轉膜,分別加入一抗 TRPA1、NGF(濃度分別為1:1000和1:1200)和GAPDH,4℃孵育過夜,加二抗孵育。超敏ECL化學發光液與膜反應2 min,然后在暗室中利用X膠片進行感光、顯影和定影。
1.6 統計學方法
應用 SPSS21.0統計軟件對所有數據進行統計處理。符合正態分布的計量資料以均數±標準差表示,對于不同時間點的比較,采用重復測量的方差分析;對于多組間比較方法,釆用單因素方差分析,均繼以LSD進行兩兩比較。以P<0.05表示差異具有統計學意義。
2 結果
2.1 各組大鼠PWT值比較
與對照組比較,模型組造模后各時間點 PWT值顯著降低(P<0.01)。與模型組比較,電針組治療4次和7次后大鼠PWT值顯著上調(P<0.01)。但CO2激光灸組大鼠 PWT值與模型組比較,各時間點差異均無統計學意義(P>0.05)。詳見表1。
表1 各組大鼠PWT值比較 (±s)
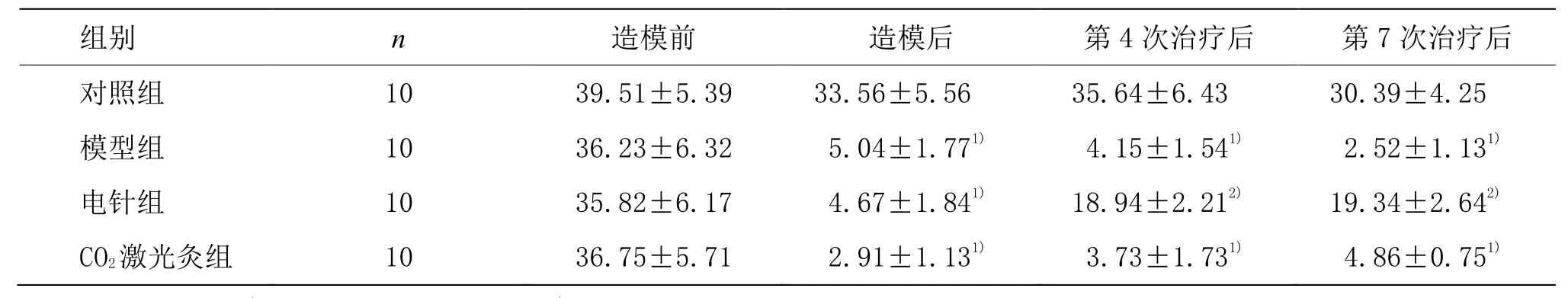
表1 各組大鼠PWT值比較 (±s)
注:與對照組比較1)P<0.01;與模型組比較2)P<0.01
組別 n 造模前 造模后 第4次治療后 第7次治療后對照組 10 39.51±5.39 33.56±5.56 35.64±6.43 30.39±4.25模型組 10 36.23±6.32 5.04±1.771) 4.15±1.541) 2.52±1.131)電針組 10 35.82±6.17 4.67±1.841) 18.94±2.212) 19.34±2.642)CO2激光灸組 10 36.75±5.71 2.91±1.131) 3.73±1.731) 4.86±0.751)
2.2 各組大鼠冷刺激敏感度比較
與對照組比較,模型組造模后各時間點冷刺激抬足反應率顯著升高(P<0.05)。與模型組比較,電針組和CO2激光灸組在治療4次和7次后大鼠冷刺激抬足反應率顯著下調(P<0.01)。詳見表2。
表2 各組大鼠冷刺激敏感度比較 (±s)
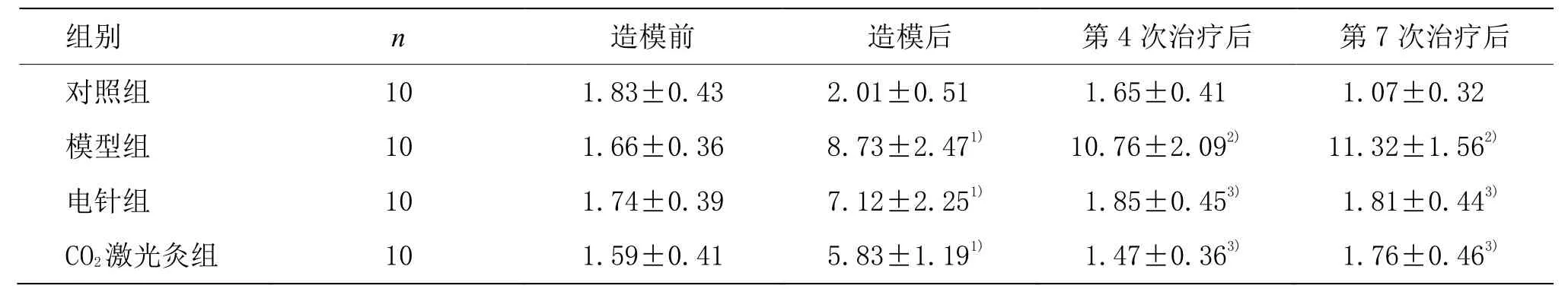
表2 各組大鼠冷刺激敏感度比較 (±s)
注:與對照組比較1)P<0.05,2)P<0.01;與模型組比較3)P<0.01
組別 n 造模前 造模后 第4次治療后 第7次治療后對照組 10 1.83±0.43 2.01±0.51 1.65±0.41 1.07±0.32模型組 10 1.66±0.36 8.73±2.471) 10.76±2.092) 11.32±1.562)電針組 10 1.74±0.39 7.12±2.251) 1.85±0.453) 1.81±0.443)CO2激光灸組 10 1.59±0.41 5.83±1.191) 1.47±0.363) 1.76±0.463)
2.3 各組大鼠坐骨神經電鏡下組織形態學比較
對照組大鼠坐骨神經有髓神經纖維髓鞘致密均勻、結構完整,中心為突觸,其外有明暗相間的同心板層髓鞘結構,其內有排列整齊的微絲、微管,無髓神經纖維正常。模型組大鼠坐骨神經有髓神經纖維髓鞘板層增厚、不均勻,排列略疏松紊亂,結構分層變性溶解,偶見斷裂缺損,可見脫髓鞘,部分軸突有萎縮和變性的改變,也可見軸漿內部分線粒體腫脹。電針組和 CO2激光灸組大鼠坐骨神經形態較模型組有一定改善。詳見圖1。
2.4 各組大鼠坐骨神經TRPA1和NGF蛋白表達的比較
與對照組比較,模型組大鼠坐骨神經區域 TRPA1的蛋白表達明顯上調(P<0.01),而NGF的蛋白表達明顯下調(P<0.01)。電針或 CO2激光灸治療后,與模型組相比,電針組和CO2激光灸組TRPA1表達均明顯下調(P<0.01),而 NGF的表達明顯上調(P<0.01,P<0.05)。詳見圖2。
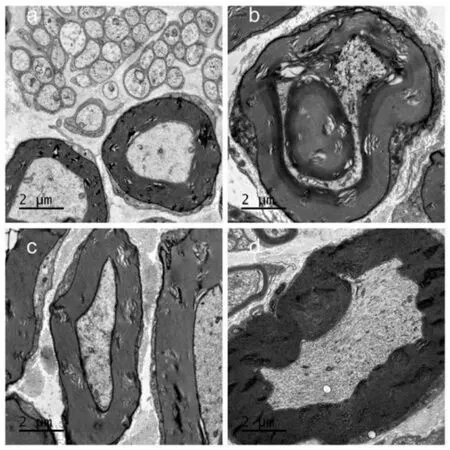
圖1 各組大鼠坐骨神經電鏡形態
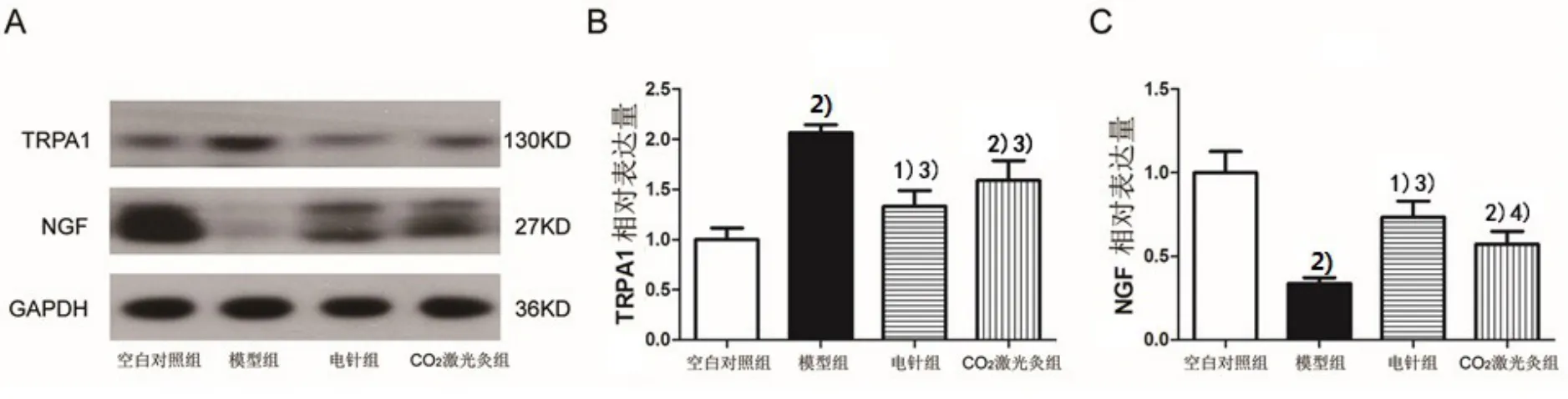
圖2 各組大鼠坐骨神經TRPA1和NGF蛋白水平的比較
3 討論
奧沙利鉑誘導的周圍神經病變(OIPN)臨床以肢端感覺異常、刺痛、麻木、無力、遇冷誘發或加重,腱反射減退等為主要癥狀。在中醫學中屬“痹證”“血痹”范疇,其主要病機為氣血兩虛、瘀血阻絡[15]。《素問·五臟生成》:“血凝于膚者,為痹。”汪機的《醫學原理》:“有氣虛不能導血榮養筋脈而作麻木者。有因血虛無以榮養筋肉。以致經隧澀而作麻木者。”沈金鰲在《雜病源流犀燭》中指出:“麻,氣虛是本,風痰是標;木,死血凝滯于內,而外挾風寒,陽氣虛敗,不能運動。”針灸療法可激發經絡經氣,達到舒筋活絡、調節陰陽的作用,進而緩解或改善OIPN的損傷[16]。電針和艾灸均能改善奧沙利鉑引起的神經毒性[5,17]。本研究表明電針能夠有效改善大鼠奧沙利鉑所致的機械痛敏,同時改善異常的冷痛覺,CO2激光灸可有效改善其冷痛敏。研究發現電針可以有效降低大鼠奧沙利鉑所致痛覺過敏和超敏反應,與改善OIPN大鼠的坐骨神經傳導速度密切相關[18]。本研究發現OIPN大鼠坐骨神經損傷出現髓鞘變性為主的病理改變,提示OIPN可導致外周神經的組織結構變性和損傷。經過電針和CO2激光灸干預后,坐骨神經在神經組織形態學上有一定程度的改善,表明電針和 CO2激光灸在治療奧沙利鉑所致周圍神經病變中發揮著重要作用。本研究筆者采用了隔日1次進行干預的方式,主要是基于筆者前期臨床和實驗研究取得良好的效果[19-20]。間隔干預是一種有效的干預手段,如每周給予1~2次針刺刺激能明顯改善乳腺癌患者化療藥引起的周圍神經病變[21]。連續每日刺激同樣能有效改善 OIPN[5,22]。但兩種刺激方式是否在療效上存在差異,有待后續的進一步臨床研究。
TRPA1是一種瞬間受體電位離子通道,作為環境刺激物傳感器,它可以將多種信號從外周傳遞至中樞,在冷覺、溫覺、機械刺激以及疼痛感受中發揮重要作用[23]。雪旺細胞作為一種周圍神經的膠質細胞,可為外周神經軸突提供支持,并且形成髓鞘。雪旺細胞上TRPA1的異常激活與神經病理性疼痛密切相關,沉默TRPA1可減弱異常性疼痛感知[24]。研究發現OIPN時大鼠背根神經節 TRPA1的表達增加,并認為這一改變與OIPN時的冷痛覺異常正相關[25]。本研究結果顯示OIPN時大鼠坐骨神經的TRPA1表達增加,且電針和CO2激光灸均可在一定程度上下調 TRPA1表達的異常增高,與之前的報道相一致。NGF作為一種分泌型的多肽物質,在調節和維持神經元的存活、生長和分化等方面發揮重要作用[26]。本研究結果顯示電針和 CO2激光灸治療后可抑制坐骨神經 NGF表達的下調。臨床研究表明,外周血中NGF的表達水平與化療藥物導致的外周神經病變呈負相關[27]。當外源性給予高劑量的NGF可以有效抵抗奧沙利鉑誘導的神經元死亡[28]。最近研究發現,提高坐骨神經和背根神經節的 NGF表達是丹參酮ⅡA抑制奧沙利鉑誘導的痛覺過敏和神經元凋亡[27,29],筆者研究結果與此相一致。提示奧沙利鉑誘導的外周神經病變導致了NGF的下調,而通過電針和CO2激光灸等方法可能部分恢復 NGF的表達,從而改善了外周神經病變的程度,進而改善了奧沙利鉑誘導的痛覺過敏。而NGF作為傳遞疼痛的重要分子,可以調控一些與疼痛相關的功能蛋白的表達從而誘發疼痛[30]。特別是在背根神經節和脊髓 NGF介導的信號通路的改變,往往影響傳入感覺信號的調節,并最終導致神經性疼痛的發展[31]。一項針對糖尿病性神經病患者的Ⅱ期試驗發現,給予 NGF可減輕神經性疼痛[32],而Ⅲ期試驗卻發現與安慰劑相比,兩組神經病變癥狀無差異[33]。可見 NGF信號與神經保護及神經性疼痛狀態之間關系極為復雜。坐骨神經中NGF信號在OIPN中的作用有待進一步研究。
綜上,電針和CO2激光灸改善奧沙利鉑所致周圍神經毒性,可能與調節坐骨神經TRPA1和NGF水平有關。

