良好實驗室規范下生態毒理測試SOP的日程設計與合規化管理
汪丹,姚洪偉,周芳麗
1. 上海化工院檢測有限公司,上海 200062 2. 上海化工研究院有限公司,上海 200062
經濟合作與發展組織(Organization for Economic Co-operation and Development, OECD)良好實驗室規范(Good Laboratory Practice, GLP)原則中對GLP的定義為:“GLP是一種有關非臨床人類健康和環境安全試驗的設計、實施、查驗、記錄、報告及歸檔等組織過程和條件的質量體系”。其中,“設計”是GLP實驗的前提和關鍵環節,任何GLP研究都必須在研究啟動之前具備周詳和可操作的計劃,也就是研究計劃書。所以,研究計劃作為控制生態毒理研究實施的書面文件,無論從邏輯性還是科學性來說,重要性不言而喻。
在OECD GLP法規中,將研究計劃定義為:“規定研究實施的目的和試驗設計,以及其修訂內容的書面文件”。因此,研究計劃必須滿足2個要點,一是內容必須清楚,二是必須為最新正式版。從內容上來說,計劃書需要符合5W1H原則(who(誰去做),why(為什么),when(何時做),where(何地做),what(做什么),how(怎么做)),具體為人員職責、測試場所、測試時間、測試對象、操作內容和實施方式。從管理上來說,最為重要的就是控制所有參與操作的人員都能獲取最新版的正式計劃書。這才能確保試驗人員能夠了解試驗內容,提前準備和安排生物、材料和儀器等,確保在試驗開始時試驗體系和設備等處于良好狀態。
在生態毒理研究中,每個研究都可能是由多個不同活動組成的復雜過程,研究周期短則幾個小時,長至幾年不等,整個過程需要多個操作人員和技術人員共同配合。因此,為了確保研究實施有序合理、人員配合默契以及資源使用高效,尤其對于那些時間周期長、牽涉操作復雜的研究,計劃書的設計就成為研究成功與否的關鍵要素,而其中最為關鍵的要素就是時間的安排和規劃。
在實際工作中,GLP測試機構在計劃書中的時間安排和日程管理方面,存在很多疑惑,有時難以在合規性和實踐性中間找到平衡點,比如,如何定義第一次采集數據的活動和最后一次采集數據的日期?如果實際日期與預計日期不一致時,是否要進行修訂或者開展偏離流程?試驗起始日期是否應該與研究啟動和結束日期存在邏輯關聯性?
所以,試驗機構希望能夠建立一種機制來合理地定義和設計計劃書中的試驗日程,使其即能滿足GLP法規和監管機構要求,同時也能靈活應對試驗操作中的隨時可能發生的不確定性情況。因此,結合生態毒理研究的實際工作流程,從法規規定、檢查要求、研究屬性和科學管理等幾個方面出發,對該問題進行探討。
1 GLP法規對計劃時間的管理要求(Proposed date requirements of the GLP regulations)
在OECD、美國食品藥品監督管理局(United States Food and Drug Administration, US FDA)、美國環境保護局(United States Environmental Protection Agency, US EPA),日本厚生省等發布的GLP法規中,以及瑞士的GLP法令(Ordinance on Good Laboratory Practice, OGLP)和歐盟的GLP法規中,均有對計劃書中試驗時間點的定義和規定,部分監管機構也發布了指南進一步對計劃書時間點的要求進行解釋,這都為檢測機構在實際管理中提供了指導和參考。
1.1 OECD GLP法規中的規定
OECD GLP法規[1]規定計劃書中至少應該包括研究啟動時間(項目負責人批準計劃書的簽名日期)、預計的試驗開始時間和預計的試驗完成時間,在研究報告中應該包括試驗開始和試驗完成日期。
OECD GLP法規給出了以下4個時間點的定義:(1)研究啟動時間:項目負責人簽署計劃書的日期;(2)試驗開始時間:第一次采集研究相關數據的日期;(3)試驗完成時間:最后一次采集研究相關數據的日期;(4)研究完成時間:是指項目負責人簽署最終報告的日期。
其中,研究開始和研究完成日期定義很容易理解,并已經在業內形成共識。但是對于預計試驗開始時間和預計試驗完成時間的定義卻比較寬泛,也曾引起行業內的廣泛討論。
1.2 US FDA的GLP法規中的規定
美國共有3部GLP法規,分別是US FDA管理的《非臨床研究的良好實驗室規范》(21 CFR Part 58)(簡稱FDA GLP法規),US EPA管理的《聯邦殺蟲劑、殺真菌劑和滅鼠劑條例》(FIFRA)的GLP法規(40CFR 160 GLP)(簡稱FIFRA GLP)和《有毒物質控制法》(TSCA)的GLP法規(40 CFR 792)(簡稱TSCA GLP),FIFRA GLP與TSCA GLP法規內容基本一致。
FDA GLP法規在非臨床研究的良好實驗室管理方面具有很高的權威性,自1979年開始實施,適用范圍為食品、色素添加劑、動物用藥、人用藥、生物產品、人類醫用設備、診斷制劑及電子產品和動物食品添加劑等。
1978年版的FDA GLP法規(§58.120(a)(4))[2]規定:“計劃書中需要列明試驗預計開始和結束日期”。但是實際上,由于不同測試領域的機構對該條款的理解不同,最后實際的做法相去甚遠,所以,US FDA在1981年發行的《GLP問題與回復指南》[3]中特別對該規定進行了解釋,首先,US FDA明確說明項目負責人(SD)在編制計劃書時,應該在計劃書中給出包括預計試驗起始日期在內的日程,而這個試驗預計起始日期的設置允許一定的靈活性。其后,US FDA結合實際為測試機構提供了具有參考價值的做法,具體如下:將預計的試驗起始時間分別設置為第一次施藥日期和最后一次施藥的日期,或是試驗體系開始分配到研究的日期和解剖最后一只動物的日期,或是接受試驗體系的日期到最終病理學診斷的日期。
但是,US FDA在1984年發布的GLP法規修訂版[4]中,提議刪掉上述§58.120(a)(4)條款,理由是根據§58.120(b)條款(已批準的計劃書發生的任何修改或者修訂,必須說明理由,經SD批準簽字和簽署日期后與原計劃書一同保管),計劃書批準后試驗日期發生改動時,項目負責人必須對研究計劃進行修訂。但是從另外一個角度來說,US FDA認為測試機構在試驗日程設計和安排方面具有自主決定權。所以為了避免因日程變化而修訂計劃書的情況,US FDA提議刪掉§58.120(a)(4)條款。隨后,在1987年發布的FDA GLP法規最終修訂版[5]中,原§58.120(a)(4)規定被刪除(表1)。自此,US FDA不再要求計劃書中必須包含預計的試驗開始和試驗結束日期。自該版本后,后續所有US FDA發行的GLP法規都不再對計劃書的預計試驗起始時間有強制規定。
同時,在與FDA GLP法規一脈相承的日本厚生省頒布的《藥物非臨床良好實驗室管理法規》中,也沒有對計劃書的試驗開始和試驗結束日期有任何規定。
1.3 US EPA的GLP法規中的規定
US EPA起草GLP法規時內容基本引自US FDA,但是隨著雙方對法規的幾次修訂,現行的EPA GLP法規與FDA GLP法規存在幾點不同,比如在計劃書時間的管理上,US EPA沒有采納US FDA的管理理念。
因為US EPA同時監管TSCA GLP和FIFRA GLP,2個法規內容基本一致,所以下文以FIFRA GLP(40CFR 160)為代表進行闡述。
在FIFRA GLP(§160.3)[6]中,給出了試驗開始和試驗結束日期的定義:(1)試驗開始日期:試驗樣品添加到試驗體系的第一個日期;(2)試驗結束日期:從研究中直接收集數據的最后一個日期。
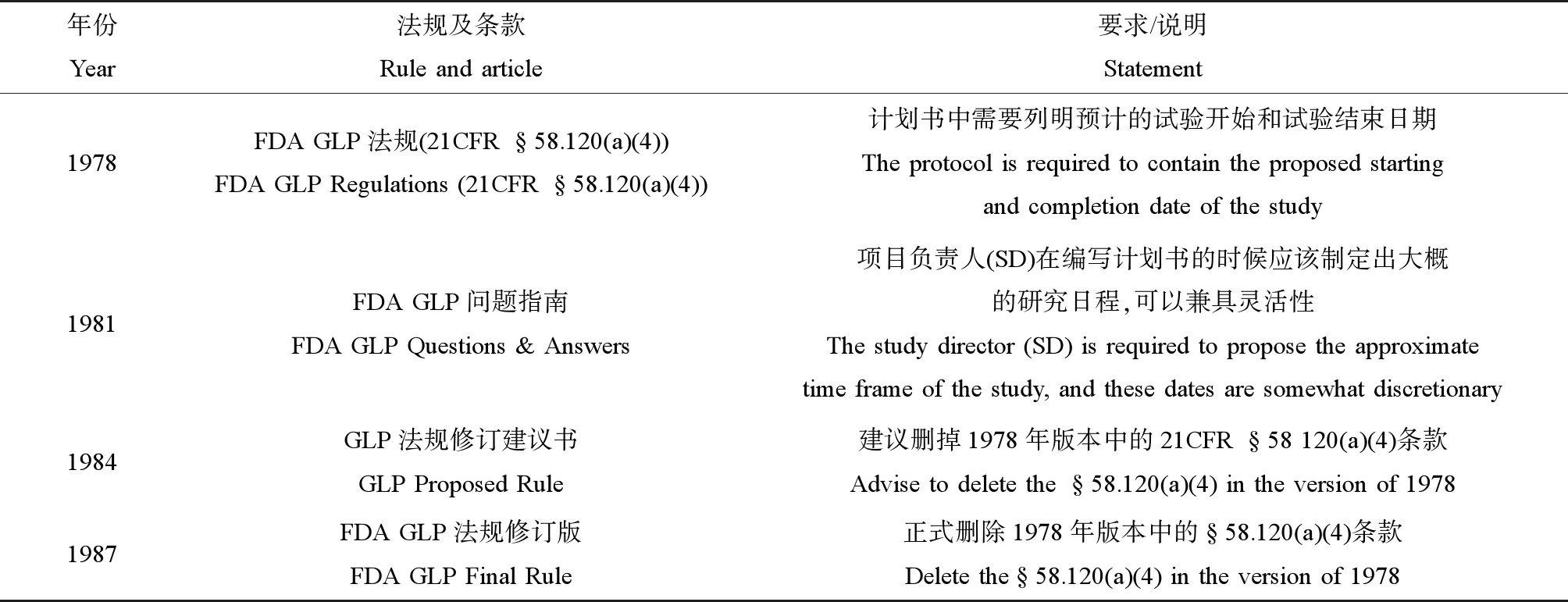
表1 美國食品藥品監督管理局(US FDA)對計劃書中試驗開始和試驗結束日期的歷史規定Table 1 The United States Food and Drug Administration (US FDA) historical rules about the proposed experiment beginning date and finishing date in protocol
40CFR(§160.120(4))中規定:“計劃書中應該包括預計的試驗開始和試驗結束日期”。
FIFRA GLP法規與FDA GLP在計劃書修改方面的規定是相同的,也就是“批準后的計劃書的任何修改或者修訂需要說明理由,并且經SD簽字和注明日期,與計劃書一同保管”,所以,對于需要符合EPA GLP法規的研究來說,計劃書發生的任何修改,比如時間修改等,都需要進行研究計劃修訂的流程。
1.4 瑞士法規中的規定與解釋
瑞士實施的GLP法規是OGLP法令,該法令從2000年3月1日開始實施,作為歐盟國家和OECD成員國,瑞士的OGLP法規與OECD GLP法規和符合性監管內容基本相同,包括對試驗起始日期的定義和計劃書修訂的規定。
在瑞士官方發布的GLP法規解釋說明文件[7]中,對如何定義試驗開始和結束的日期給出了具體的解釋。根據瑞士OGLP法規,試驗開始和結束的日期應該是收集研究相關數據的開始和結束日期。如果在試驗之前有所謂的預實驗,比如采集研究的基線值,那么試驗開始日期應該是預實驗的開始日期。因為這2個日期的定義很寬泛,所以在制定計劃書時最好進行解釋和說明,建議可以采用以下2種做法:(1)在每個研究的標準操作規程(SOP)中,描述試驗開始/結束日期對應的具體操作或活動。(2)研究計劃中給出預計的試驗開始日期和完成日期,同時說明該日期對應的具體操作。
1.5 德國聯邦風險評估研究所(Bundesinstitut für Risikobewertung, BFR) GLP檢查手冊中的規定
作為歐盟國家和OECD成員國,德國GLP法規也是基于OECD的GLP法規,要求計劃書中需要列出預計的試驗開始日期和預計的試驗結束日期。
在德國GLP檢查手冊[8]2.8.4.8條中明確規定,在進行研究審計時,要核對研究計劃、原始數據和最終報告的一致性,其中明確說明:“比較研究計劃、原始數據和最終報告之間試驗開始日期和完成日期的一致性”,由此可以了解到,德國檢查官會在GLP監管檢查中,核查這些時間點是否一致。
1.6 日本環境省(MOE)GLP法規中的規定
雖然,日本厚生省發布的GLP法規不要求計劃書提供試驗起始日期,但是日本環境省的化學品GLP法規[9]中的規定保持與OECD GLP中的規定一致,也就是要求在計劃書中給出試驗起始日期,定義與OECD的規范相同。而為了幫助機構理解,日本環境省發布的測試機構自查手冊[10]給出了部分生態毒理測試的建議試驗開始日期和試驗結束日期(表2)。將上文所述的所有GLP法規中對研究計劃中時間點的規定和要求總結于表3中。

表2 日本在化學品測試機構自查手冊中的建議[10]Table 2 Recommendations in the Japan’s self-inspection manual for chemical testing organizations[10]
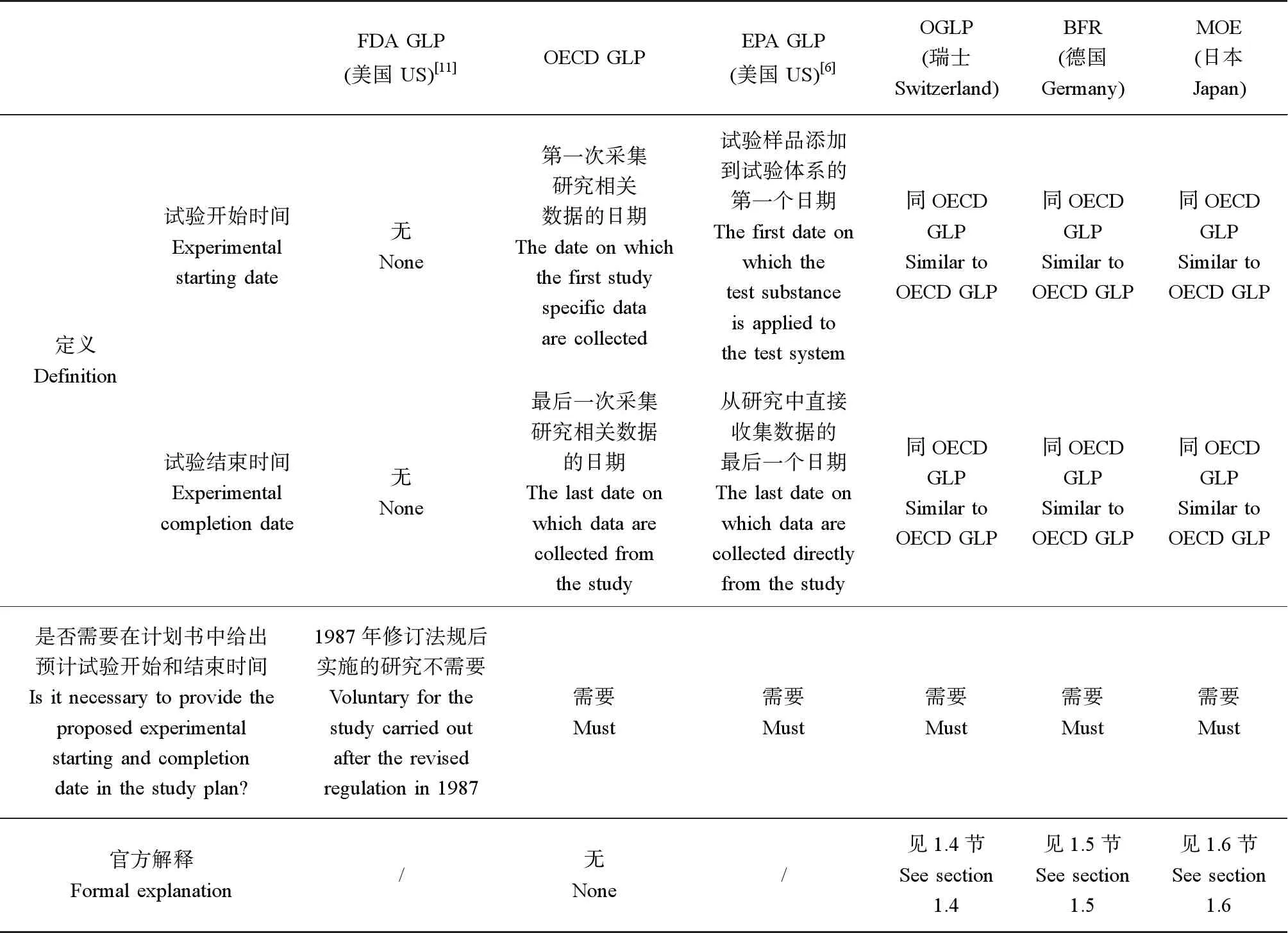
表3 各GLP法規中對研究計劃中時間點的規定和要求Table 3 Rules and requirements of each GLP regulation on protocol time points
2 GLP法規中時間定義的解讀與討論(Interpretation and discussion of date definition in GLP)
從上述的GLP法規和其解釋文件中了解到,不同國家和組織對于這2個時間點的設計和規定是不相同的,這表明,不同監管機構對這些時間點的定義也有著不同的意見,但是無論如何,遵從OECD GLP規范的測試機構還是需要在試驗計劃書中給出這些時間點。
在進行時間點的設計時,不管出于任何目的,都不建議將法規的定義生搬硬套使用。對于那些會開展多種類型、多種試驗體系的GLP機構來說,千萬不要采用“一刀切”的方式,試圖為不同類型的研究設計出一種通行的、萬能的定義,因為那些看起來“一勞永逸”的定義,反而會給試驗人員在實操中帶來困惑和不解,以及后期面對質量保證(QA)人員和GLP檢察員詢問時需不斷解釋和說明。
從GLP規范給出的定義可以看出,時間安排的核心點有2點:其一是識別“活動”,其二是定義“開始”與“結束”。
對于前者,“活動”應該是“與研究有關的”相對應的,那么何種活動是“與研究有關的”呢?比如,動物到達機構時進行健康檢查,設備校準與計量,馴養期的生物環境參數測量以及培養基溶液配制,這些是否與研究相關?從廣義的角度來說,這些數據都是與研究有關的,但是這些明顯不適合用于做為具體研究活動的代表或者標識。
比如,以魚類的毒性研究為例,如果將魚類馴養作為“與研究有關的”活動,那么意味著計劃書中的試驗開始日期就是受試魚引進的日期,但是事實上,受試魚在用于試驗之前,將經歷適應期(至少7 d)、馴養期(至少14 d),以及敏感性測試,所以基本上所有的受試魚在用于試驗前都已經在實驗室生活了至少2個月時間,之后才能用于測試。而對于魚類試驗來說,一般不會提前2個月啟動研究計劃,因此,如果“研究啟動日期”晚于“試驗開始日期”,時間邏輯上來說不夠合理。另外,通常受試魚都是大批量地馴養在實驗室,供應于一定周期內(比如1 a)的所有魚類研究,也就是說,同一批次的受試魚將用于多個研究,所以魚的馴養僅屬于“與研究有關的”通用性活動,而非“與具體研究有關的”指代性活動。同時在魚的馴養期間,所有相關的活動,比如運輸、引進、適應和馴養,都詳細記錄在生物檔案中,并通過設施檢查進行核查。因此,從時間邏輯和質量保證角度來說,采用生物馴養作為“研究有關活動”的標志是不科學的。
對于第2個關鍵點“開始”與“結束”的定義,需要符合時間邏輯順序,OECD GLP法規沒有給出4個時間點之間的邏輯性。根據GLP法規中的要求“在研究啟動之前應該有書面研究計劃”可知,研究啟動也就是SD簽署計劃書時肯定有了書面計劃書。雖然,GLP法規中沒有規定試驗開始日期必須在研究啟動日期之后,也就是沒有規定相關數據的收集必須在研究啟動之后才能進行;但是,從常識上來說,正常的流程應該是先有計劃書,然后開展研究活動,這樣才能確保研究有序執行;所以從這種邏輯上來推斷,研究計劃中的試驗預計開始日期應該在研究啟動之后。[12]
3 生態毒理GLP研究活動的屬性(Activities categorization and property in ecotoxicology GLP study)
研究計劃工作中最為困難的任務之一就是日程和進度安排,項目負責人要把可用的資源、人員和活動工作量協調好,考慮好各項活動之間的相互依賴關系,預見可能出現的問題或者不可預期的活動時間,然后制定出計劃日程。為了清楚地說明GLP研究中相關活動的關鍵性和在研究中所起的作用,根據活動產出結果的作用來劃分活動的屬性,簡單地將活動分為生產活動、支持活動和管理活動[13],具體定義如下。
生產活動:如果該活動能夠得到可量化的實體結果,那么該過程就稱為生產活動;支持活動:如果該活動能夠為生產活動提供必要的無形實體支持,那么該活動稱為支持活動;管理活動:為機構管理運行提供支持的活動稱為管理活動。圖1給出了3種活動之間的關系,并給出了一些簡單的活動任務內容。
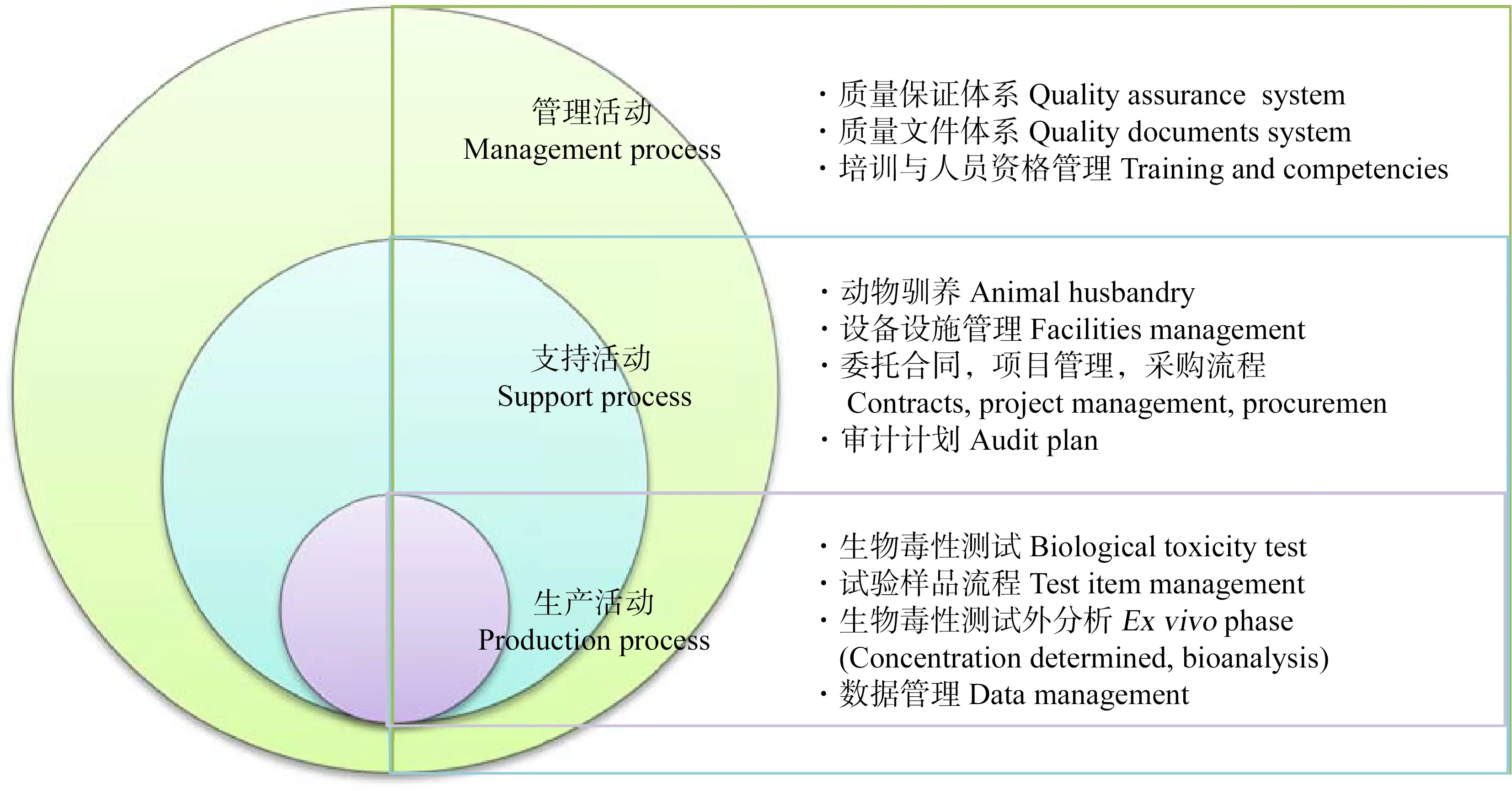
圖1 GLP研究的活動屬性圖示Fig. 1 Activity categorization illustration in GLP study
為了進一步闡述不同活動在研究中受關注的程度以及研究中各個環節的屬性,以常規的生態毒理研究流程為例,結合質量保證部門所實施檢查活動的性質,對各個相關的活動進行歸類(表4)。
如上所述,生產活動作為產生最終數據和結果的過程,與管理活動和支持性活動共同組成了完整的研究,從研究實施的角度看,生產活動的失敗或者失誤會直接導致數據缺失或者結果錯誤,從而直接影響研究結果和結論。而可能導致生產活動失敗的重要原因之一就在于研究計劃的日程不合理,比如,對活動任務完成周期的錯誤估計,對不同活動關聯影響缺乏前瞻性,日程變化時通知試驗人員存在滯后性等。
但是,要注意的是數據處理和分析這類生產活動,對于大多數研究來說,數據統計、處理和分析產生的數據屬于二次數據,它發生的時間是在所有實驗數據已經采集之后,相對于其他生產活動,它的發生比較獨立。更為重要的是,因為整個統計和分析的過程易于采用直接方法重現和復核。所以數據處理和分析時間安排比較靈活和寬松,相關人員在時間安排上擁有較大的自主權。所以,為了確保研究計劃時間安排能夠對研究實施進行有效控制,不建議采用統計分析時間作為試驗完成日期的節點。
4 生態毒理GLP研究日程安排要點(Key point of planning schedule for ecotoxicology GLP study filed)
對于不同類型生態毒理GLP研究,生物毒性試驗、試驗樣品處理和生物毒性測試生產活動的順序是不同的。
比如,對于按照OECD化學品測試方法301開展的快速生物降解試驗,試驗順序為:配制施用形式的樣品—試驗樣品開始暴露(活性污泥接種物體系)—試驗期間數據記錄—試驗樣品停止暴露(活性污泥接種物體系)—試驗結束—數據處理,按照活動屬性來說,對應的活動應該是:試驗樣品流程—生物毒性測試—數據管理(圖2)。
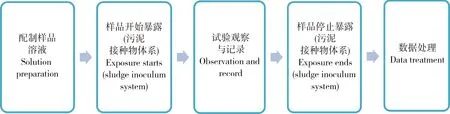
圖2 快速生物降解試驗的生產活動順序Fig. 2 Sequence of the production processes in ready biodegradation test
對于藻類生長抑制試驗來說,活動的順序是:定量分析方法驗證—配制樣品溶液—樣品與生物體系作用—試驗過程—停止樣品與生物體系作用—癥狀觀察—試驗溶液濃度分析,也就是生物毒性測試外分析—試驗樣品流程—生物毒性測試—生物毒性測試外分析(圖3)。
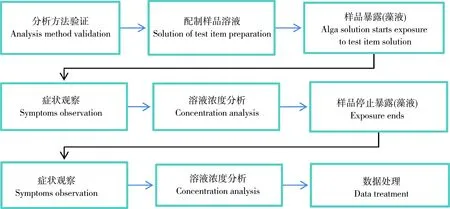
圖3 藻類生長抑制試驗的生產活動順序Fig. 3 Sequence of the production processes in alga growth inhibition test
大多數情況下,生態毒理類研究啟動時的活動節點是樣品流程或者是生物毒性測試外分析(例如化學分析),而試驗完成對應的活動節點是生物毒性測試或者是生物毒性測試外分析(可能是病理分析,也可能是化學分析)。

表4 生態毒理GLP研究過程活動屬性分類及對應的質量保證活動Table 4 Categorization and property of processes in ecotoxicology GLP study and quality assurance actions
如果沒有生物毒性前/后分析(比如化學分析)的情況,可以將試驗開始日期定義為樣品配制日期,或者是樣品開始暴露的日期,試驗完成日期可以設置為生物體系與樣品結束相互作用的日期。
對于有生物毒性測試外分析的情況,可以采用多場所試驗管理或者研究專題管理的方式進行處理。
(1)多場所試驗管理
將定量分析試驗部分作為多場所研究的試驗階段管理,其分析負責人作為該階段的負責人。主研究計劃中的試驗開始日期定為配制樣品的日期,試驗完成日期定義為最終癥狀觀察的日期或者結束暴露的日期,主研究計劃中的階段研究計劃將開始定量分析方法驗證與溶液分析結束的日期作為試驗階段開始和結束的日期。
(2)研究專題管理
將定量分析方法驗證的開始日期作為試驗開始日期,將濃度分析結束的日期作為試驗結束日期,因為定量分析方法的日期可能受到儀器狀態、儀器安排等非預期因素的影響,所以時間安排上可以設置為時間段(比如2~3 d),時間段必須合理,不能過于寬泛。
5 研究實施中計劃時間變化的處理(Handling the time change during implementation)
對于批準后的計劃書中時間發生變化的情況,有些機構認為時間上的變化屬于管理性的內容,無需進行修訂或者開展偏離流程,但是這可能違反GLP法規的規定。OECD GLP[1]規范中規定:“研究計劃的修訂是指試驗項目啟動以后對試驗計劃進行的有意修改。研究計劃中的修訂需要有明確的理由,并經過項目負責人的同意,簽名并注明日期,與計劃書一同保存”。在OECD GLP NO.3文件“GLP管理機構準則試驗機構檢查與試驗項目核查實施指南”[14]中的試驗的實施中規定,試驗計劃書的任何修改由項目負責人簽字并注明日期。
所以,如果計劃書中規定了預計的時間,那么該內容就屬于計劃書的一部分,相關的改動就應該屬于研究計劃修訂,需要說明理由,獲得SD的批準,并且與原研究計劃一同保存。
從計劃角度,計劃書中時間安排的目的是協調各個試驗人員之間的配合,確保各方能在試驗前提前做好準備,所以當預計時間安排發生變化時,應該通過一種合理和有效的方式及時告知相關人員,而研究計劃的修訂流程就是一種比較有效和合規的流程,并且確保試驗人員能夠獲得最終版的計劃書及其修改。
雖然,GLP法規接受對計劃書進行修訂,但是過于頻繁的修訂可能會讓監管機構懷疑測試機構在項目管理能力上存在不足,從而使研究陷于風險度較高的境地,引起監管部門對研究可靠性和可信性產生質疑。
因此,如果計劃書中試驗起始日期的活動定義為隨機性較強的活動,比如生物稱重、設備開機和稱量等,那么實際操作中,這一類的活動的發生比較靈活,所以如果以這類活動為試驗起始日期的節點,那么就比較容易產生因為時間修改導致的計劃偏離。
如果既想避免不斷修訂計劃書帶來的工作量,以及忘記修訂導致的計劃偏離,又想確保試驗人員和QA人員及時跟進最新計劃履行工作,那么首先應該按照GLP的規定,在計劃書中給出預計的試驗開始和結束日期以及對應的活動內容,對于這些出現在最終計劃書中的活動應該是易于理解和界定的,并且是較為固定的活動。其次,建立獨立文件或記錄作為日程安排表,即方便實驗人員參照實驗進度表執行試驗計劃,且防止操作遺漏,但是,在使用獨立的日程安排表時,需要在項目負責人、試驗人員和質量保證人員之間建立合理的溝通機制,確保相關人員能及時了解日程的安排和變化。
獨立的日程表上一般會包括生物稱量和分組、施藥日期、溶液更換日期、癥狀觀察日期、環境參數測定日期、采樣日期和化學分析日期等,同時還應該包括計劃實施的日期、實際實施的日期和試驗人員等信息。在設計日程表時,需要獲得所有可能會參加該研究的試驗人員的同意。比如,在設計水生試驗樣品定量分析日程時,關于采樣時間、分析樣本轉交時間和分析時間等,項目負責人需要先與分析人員和試驗人員進行溝通和協商。
6 總結與討論(Discussion and conclusion)
在GLP實驗室中,研究計劃的日程設計非常關鍵,不僅涉及到數據采集、設備調配、場地安排、人員分配和QA檢查等多個方面,也會從側面反映實驗室管理能力和技術實力。雖然,在US FDA的法規中,已經不再需要對試驗開始和結束日期進行描述,但是OECD GLP法規、EPA GLP法規以及德國、瑞士和日本環境省的GLP監管機構始終都保持了對計劃書中預計試驗開始和試驗完成日期的定義和規定。而在生態毒理領域的GLP實驗室,基本是按照OECD GLP或者EPA GLP法規體系來管理的,所以相關的計劃書中必須體現試驗起止日期。
為了更加合理地對研究日程進行規劃,本文提出了按照活動屬性分解研究活動的方法,有利于了解各個活動之間的影響程度和相互依賴性,并識別出研究中對結果具有直接影響的活動,將這類活動稱為生產性活動,其發生和結束的時間可對應到計劃書中試驗開始和結束的日期。將該方法與具體研究類型結合,按照研究中生產性活動發生的先后順序,分別識別試驗開始和完成時對應的活動,從而確定研究計劃中最合理的時間設計。這既能滿足計劃書合理性要求也符合前瞻性的理念。
GLP法規的初衷是為了確保研究的質量和重現性,而研究科學性更多要依賴于實驗室的技術能力和人員水平,所以,GLP規范和研究項目不可截然分開,也就是管理和實踐必須結合。有時當談到GLP規范時,人們會認為這是對科學研究的一種束縛,因為GLP規范確實給實驗室增加了大量文檔性工作,但是當我們對法規具備了足夠的了解,并且能夠結合科學管理觀做到統籌兼顧,將可能出現的問題解決在前端,可以極大地避免重復性勞動和無解的內部爭議,提高工作效率,提升測試機構的管理水平和測試效率,逐步地提升我國GLP測試機構在國際上的認可度。

