短乳桿菌來源重組β-半乳糖苷酶初步分離純化與酶學特性研究
李 潔, 宮路路, 柳陳堅, 崔霖蕓, 張 寧
(1.遵義醫藥高等專科學校基礎教學部,貴州遵義563000; 2.昆明理工大學生命科學與技術學院,云南昆明650500)
β-半乳糖苷酶,又稱乳糖酶,英文名稱βgalactosidase,簡寫為GAL,國際酶學委員會將其命名為 EC3.2.1.23[1],為蛋白家族 GHF-2 類型.該酶能夠水解乳糖,生成半乳糖和葡萄糖,用來回收乳清中的乳糖,生產功能性食品添加劑[2].利用其水解活性水解牛奶中的乳糖,制成低乳糖牛奶,抑或制成腸溶片作為藥物,治療乳糖不耐受癥[3].利用其水解產物半乳糖作為供體,未分解的乳糖為受體,合成低聚半乳糖 GOS(galacto-oligosaccharide)[4].由此可見,β -半乳糖苷酶在醫藥行業、食品行業上應用廣泛[5].
自然界中,產生β-半乳糖苷酶的生物種類很多,廣泛存在于動物、植物、微生物[6],尤其是微生物,如真菌、酵母菌、細菌.其中,研究較多的微生物有大腸桿菌(Escherichia coli)、枯草芽孢桿菌(Bacillus subtils)、巨大芽孢桿菌(Bacillus megaterium)、乳桿菌(Lactobaills)、乳鏈球菌(Streptococcus lactis)、雙歧桿菌(Bifidobacterium)、乳酸克魯維酵母(Klyeromyces lactis)、乳酸脆壁酵母(Klyveromyces lacis fragilis)、黑曲霉(Aspergillus niger)、米曲霉(Asperillus oryzae)等[7].
鑒于產β-半乳糖苷酶的微生物來源豐富,本研究以此為啟發,以云南傳統發酵豆豉為原料,進行β-半乳糖苷酶乳酸菌篩選.在宋園亮等[8]的努力下,篩選得到一株產β-半乳糖苷酶乳酸菌,經16S rDNA鑒定為短乳桿菌(Lactobacillus brevis).結合分子克隆技術,將該菌來源β-半乳糖苷酶基因在大腸桿菌中進行表達,得到一株產β-半乳糖苷酶重組大腸桿菌菌株,將其命名為 E.coli BL21/p ET28abgaB-18(以下簡稱18號菌株).結合鎳柱分離技術對重組菌株表達的β-半乳糖苷酶進行分離,并對其酶學性質進行測定.
1 實驗部分
1.1 材料
1.1.1 菌種 本實驗室保存的重組18號菌株.
1.1.2 試劑 卡納霉素(TaKaRa 公司)IPTG;聚丙烯酰胺,考馬斯亮藍R-250,溴酚藍,咪唑,NiSO4·6H2O(上海生工);鄰硝基苯酚-β-D-半乳糖苷(ONPG),ONP(Sigma公司);碳酸鈉(天津試劑三廠),磷酸二氫鈉,磷酸氫二鈉(天津市風船化學試劑).
1.1.3 儀器 恒溫搖床(上海智城分析儀器有限公司),超聲波細胞破碎儀(天翎儀器TL-650Y)高速離心機(SIGMA K 3-18),鎳柱(Qiagen),水平電泳儀(GENIUS),金屬浴(FUNAKOSHI),普通恒溫培養箱(NAPCO6500TC),紫外分光光度計(Genova).
1.2 方法
1.2.1 β-半乳糖苷酶重組18號菌株誘導表達 吸取18號重組菌株20μL菌液接種至大腸桿菌培養基LB液體培養基5 mL中,加入20μL卡那霉素溶液(質量濃度為100μg/mL)后混勻.恒溫搖床(溫度為37 ℃,轉速270 r/min)振蕩培養12 h.吸取4 mL 培養液,擴大接種至400 mL LB液體培養基中,37℃,270 r/min 條件下培養,待菌體OD600達到0.6時,加入400 μL IPTG(200 mg/mL)誘導培養4 h.培養液于4℃,5 000 r/min離心10 min,棄上清液后加入磷酸鹽緩沖液(pH值為7.5)4 mL,置于冰水內超聲破碎,離心20 min(溫度4 ℃,轉速12 000 r/min).收集上清液,沉淀,用磷酸鹽緩沖液懸浮待用.
1.2.2 β-半乳糖苷酶重組18號菌株蛋白純化 向經10 mmol/L PBS 平衡緩沖液(pH 7.4)處理的鎳柱內加入1.2.1中的上清液,用不同濃度咪唑的平衡緩沖液沖洗鎳柱,并收集;選擇合適的收集液待用.
1.2.3 重組β-半乳糖苷酶蛋白SDS-PAGE電泳 分別取未純化的細胞破碎液的上清液和沉淀,以及經鎳柱純化后的蛋白液各5μL,與5μL 5×SDS-PAGE Loading Buffer混合,100℃煮沸10 min,13 000 r/min 離心 10 min;取離心上清液25μL進行SDS-PAGE電泳.
1.2.4 重組β-半乳糖苷酶酶活測定 β-半乳糖苷酶酶活單位定義為1 mL菌液產生的β-半乳糖苷酶在35℃、pH 7.5的條件下,每分鐘水解ONPG產生1μmol鄰硝基苯酚(ONP)所需要的酶量定義為一個酶活性單位,以U/mL表示.
反應體系為250μL重組β-半乳糖苷酶蛋白液,與等量體積ONPG溶液混勻,35℃恒溫孵育30 min,加入250 μL 碳酸鈉溶液終止反應[9].檢測反應體系在OD420處的吸光度.每個反應體系平行測量3次(下同),并計算酶活.
1.2.5 重組β-半乳糖苷酶最適溫度和最適pH測定 將反應體系(詳見1.2.4,下同)分別在不同溫度(-5、0、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90 ℃)的水浴條件下進行酶促反應,結束后按照1.2.4進行檢測.
在最佳反應溫度下,將反應體系置于不同pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5)[10]的緩沖液中進行酶促反應,結束后按照1.2.4進行檢測.
現在當地鄉鎮派出所警力嚴重不足。由于基層警務需要承擔大量的人口管理事務,兩勞釋放人員、精神病人、重點信訪人員都屬于基層警務的職責內容。警察執法在村莊社會中的重點是鄉村治安,解決糾紛只是派出所功能的一部分[37]。在“羊吃花生”案中,“青楞”故意制造糾紛以報復自己用水不得。“青楞”侵犯的對象是村里的門頭大戶,“青楞”知道現在不能用拳頭解決問題,于是才敢公然挑戰權威勢力。按理,“青楞”的行為應該受到制裁,但村干部的調解無法解決問題,而派出所嚴格依法辦事,也不再理會警務職責之外的鄉土利益訴求。
1.2.6 重組β-半乳糖苷酶熱穩定性和pH穩定性測定 將重組β-半乳糖苷酶置于不同溫度[11](30、40、50、60、70、80 ℃)進行熱處理 2 h,結束后按照1.2.4 進行檢測.
將重組β-半乳糖苷酶置于pH值分別為3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0 的緩沖液中處理 1 h[12],結束后按照 1.2.4 進行檢測.
1.2.7 金屬離子對重組β-半乳糖苷酶活性影響的測定 吸取重組β-半乳糖苷酶純化液25μL,依次加入225μL質量分數0.2%的CaCl2·2H2O、CuSO4·7H2O、FeSO4·7H2O、FeCl3·6H2O、Mg-SO4·7H2O、KCl、MnSO4、BaCl2和 ZnSO4等不同金屬離子溶液,加入250μL ONPG溶液誘導培養,以未處理酶液作為對照,依據1.2.5的測定結果,選定最適溫度、最適pH進行酶促反應,結束后按照1.2.4 進行檢測.
1.2.8 初步純化的重組 β-半乳糖苷酶 Km與Vmax測定 在35℃,pH 7.5條件下,測定不同濃度ONPG的酶促反應速率,根據米氏方程計算出β-半乳糖苷酶的Km和Vmax大小.
按照雙倒數作圖法(Lineweaver-Burk法)將米氏方程改寫為
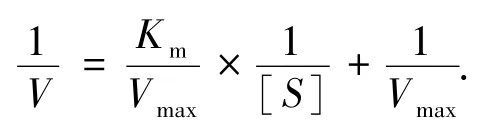
根據酶活標準曲線計算不同[S]對應V,求出二者倒數,以1/V對1/[S]作圖繪制直線.橫軸截距為 x=-1/Km,得 Km=-1/x;縱軸截距為 y=1/Vmax,得Vmax=1/y,并計算出β-半乳糖苷酶Km和Vmax大小.
2 結果與討論
2.1 重組β-半乳糖苷酶酶活測定在測定1.2.2中分離得到的重組β-半乳糖苷酶活性時發現,當按照1.2.4方法進行酶促反應時,吸取鎳柱分離得到的重組β-半乳糖苷酶蛋白液250μL加入到含等量體積ONPG溶液的反應容器中,溶液立即變成黃色(黃色為反應產物ONP的顏色,反應前無色).由于酶促反應時間很短,難以計算反應時間.其原因是酶濃度過高,反應進程過快,影響酶促反應速率測定,需探索重組蛋白的反應濃度.按照稀釋倍數 45、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200 進行稀釋,其結果如圖1所示,在低于45倍濃度進行稀釋時,稀釋后的酶液與底物反應很快,很難把握酶促反應時間;繼續加大稀釋倍數,酶促反應速率逐步平緩下降.本實驗選擇稀釋100倍(稀釋便捷,反應時間可控,可檢測性強)酶液參與酶促反應測定.
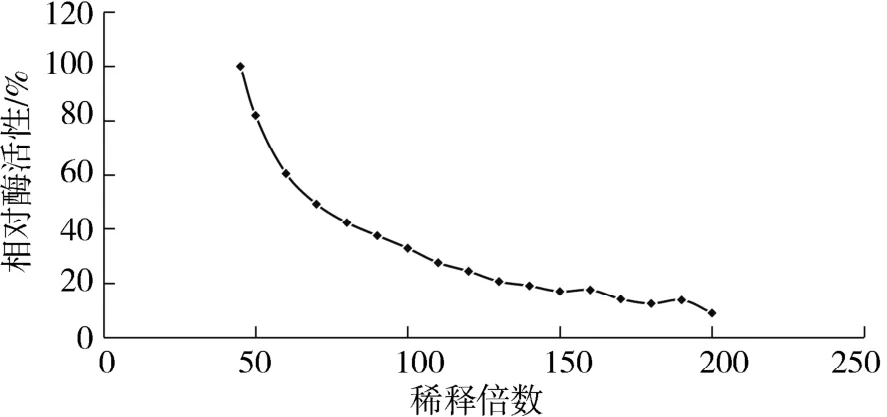
圖1 酶促反應稀釋倍數測定Fig.1 Determination of dilution multiple of enzymatic reaction
將酶液稀釋100倍后,測定酶活,再換算成每1 mL重組大腸桿菌菌液酶活,得到重組β-半乳糖苷酶酶活為16.5 U/mL,即每1 mL重組大腸桿菌菌液的酶活為16.5 U.
2.2 重組β-半乳糖苷酶SDS-PAGE電泳圖譜將1.2.2中純化酶液進行SDS-PAGE電泳,其結果如圖2所示.在泳道1中,66.2和35 kDa處有清晰蛋白條帶,推測為重組β-半乳糖苷酶的2個亞基,電泳圖譜中亦有雜蛋白條帶.因此,該方法只能對重組蛋白進行初步分離純化.
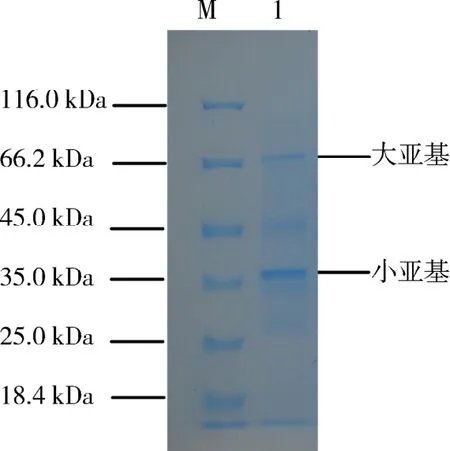
圖2 重組菌株18號菌株SDS-PAGEFig.2 The SDS-PAGE figure of recombinant strain No.18
圖3中,泳道1為重組菌株細胞裂解液上清液,在上清液中很難判斷重組蛋白條帶;泳道2為細胞裂解液沉淀,在細胞裂解液沉淀中可發現重組蛋白的表達(圖3中大、小亞基所示).由此可見,重組蛋白主要出現在細胞裂解液沉淀中,結合圖2,則說明上清液中有重組蛋白,但與沉淀中蛋白量相比較少,蛋白主要在沉淀中,因此,該蛋白主要以包涵體形式存在于細胞中.
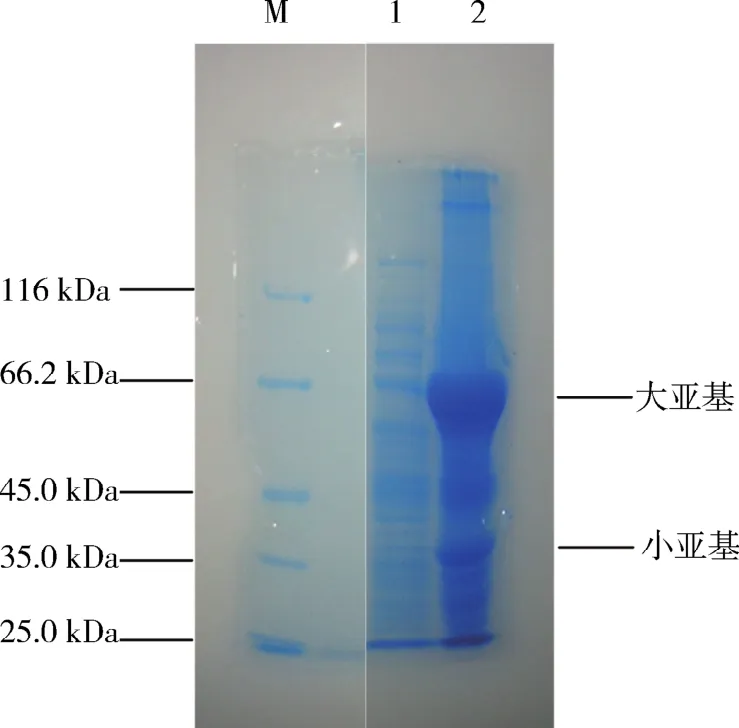
圖3 18號菌株由來胞內蛋白電泳結果Fig.3 Results of intracellular protein electrophoresis of strain No.18
2.3 重組β-半乳糖苷酶最適反應溫度和最適pH將β-半乳糖苷酶與ONPG混勻后置于不同溫度條件下進行反應,待結束后測定其OD420的吸光度,繪制相對酶活曲線如圖4(為便于數據處理,以下作圖均按照相對酶活繪制).可以看出,溫度在0~35℃變化時,隨著溫度升高,相對酶促反應速率逐漸加快,35℃時達到最大.因此,得到其最適溫度為35℃.隨著反應體系溫度升高,相對酶促反應速率逐漸下降:在35~50℃時,相對酶促反應速率下降緩慢;在50~85℃時,相對酶促反應速率下降明顯;大于85℃時,相對酶促反應速率接近于0,推測酶在此時處于失活狀態.
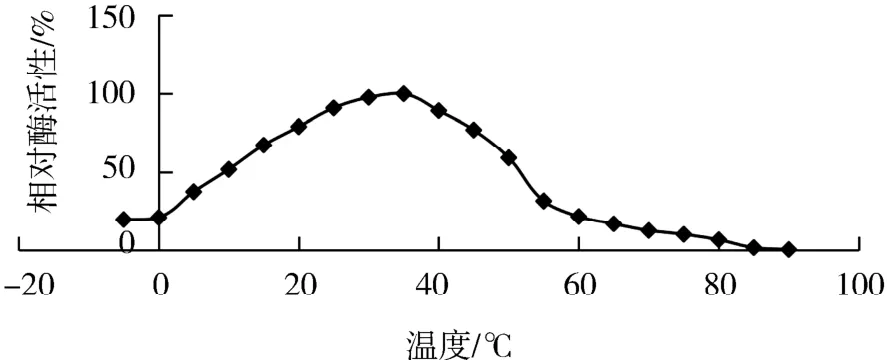
圖4 Lb.brevis GJ1-3來源β-半乳糖苷酶最適反應溫度Fig.4 The optimum temperature ofβ-galactosidase from Lb.brevis GJ1-3
將β-半乳糖苷酶與底物混勻后置于不同pH緩沖溶液中進行酶促反應,待結束后測定其OD420的吸光度,并探討pH對該酶活性影響.根據實驗測定結果,繪制相對酶活曲線如圖5(以最大反應速率做參考).可以看出,pH值為0~5.0時,相對酶促反應接近于0;pH值為5.0~6.5時,相對酶促反應速率迅速上升;pH值為6.5~8.0時,相對酶促反應速率比較穩定;pH值為7.5時,相對酶促反應速率達到最大,得到該酶最適pH值為7.5.當溶液pH值大于8.0時,相對酶促反應速率急劇下降;pH值為8.5~10.5的范圍內,相對酶促反應速率接近于0,推測酶在此時處于失活狀態.
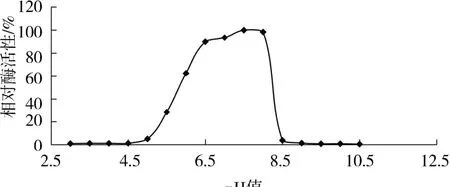
圖5 Lb.brevis GJ1-3來源β-半乳糖苷酶最適pHFig.5 The optimum p H ofβ-galactosidase from Lb.brevis GJ1-3
2.4 重組β-半乳糖苷酶熱穩定性和pH穩定性將β-半乳糖苷酶與底物混勻后,置于不同溫度條件下孵育2 h,在最佳反應條件下(35℃,pH 7.5)進行酶促反應,并測定其OD420的吸光度,繪制相對酶活曲線如圖6.可以看出:在溫度30~50℃范圍內,酶穩定性較好;當溫度升高到60℃以上時,相對酶活性急劇下降.推測酶在較高溫度下空間結構遭到破壞,影響了酶促反應.因此,該酶在30~50℃范圍內能夠保持很好的熱穩定性,較高溫度條件下極易失活,屬于常溫酶.
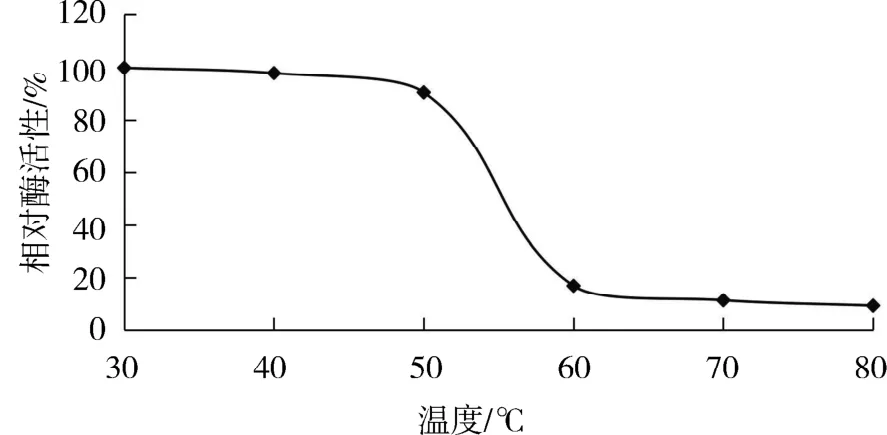
圖6 Lb.brevis GJ1-3來源β-半乳糖苷酶熱穩定性Fig.6 The thermal stability ofβ-galactosidase from Lb.brevis GJ1-3
將該酶置于不同pH緩沖液中孵育1 h,隨后將其置于最佳反應條件下反應,并測定其OD420的吸光度,繪制相對酶活曲線,探討不同pH條件下酶促反應速率,如圖7所示.結果表明:酶在pH值小于4.0的范圍內,相對酶活接近于0,說明其穩定性很差;pH值為4.0~8.0時,酶穩定性逐漸增加;當酶處在pH值為8.0以上溶液中,其穩定性很快下降;pH值大于11時,相對酶活趨近于0,推測其結構遭到破壞而失活.由此可見,該酶在pH 6.0~8.0范圍內具有較好的pH穩定性.
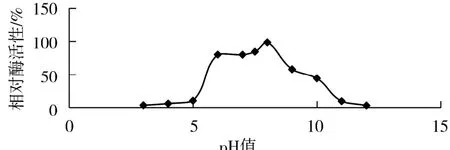
圖7 Lb.brevis GJ1-3來源β-半乳糖苷酶pH穩定性Fig.7 The p H stability ofβ-galactosidase from Lb.brevis GJ1-3
2.5 金屬離子對重組β-半乳糖苷酶活性影響將該酶與不同金屬離子醋酸鹽緩沖液(pH 7.5)混勻,測定不同金屬離子對酶促反應速率的影響,結果見表1.
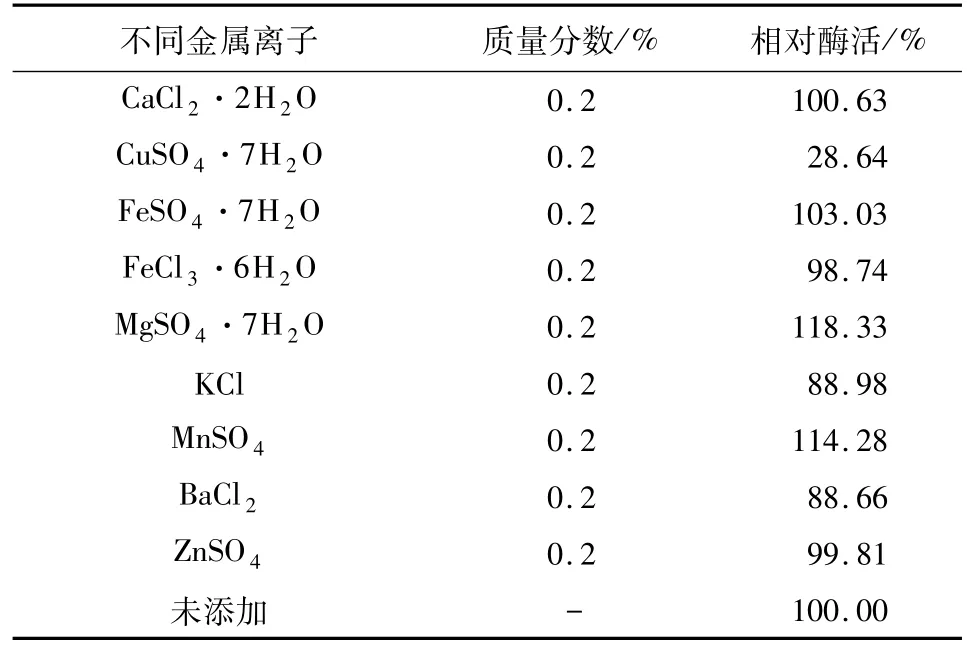
表1 金屬離子對Lb.brevis GJ1-3來源β-半乳糖苷酶活性的影響Tab.1 Effects onβ-galactosidase from Lb.brevis GJ1-3 by different irons
可以看出,在加入金屬離子 Mg2+、Mn2+的反應體系中,與未添加金屬離子對照組相比,重組β-半乳糖苷酶具有很好的催化活性,推測 Mg2+、Mn2+能夠促進酶促反應;在加入金屬離子Cu2+、Ba2+與K+的反應體系中,重組β-半乳糖苷酶與未添加金屬離子對照組相比,酶促反應速率都有所下降;Cu2+存在時酶活性下降至三分之一,明顯抑制了酶促反應;Ba2+與K+存在時,酶促反應速率也有一定下降.由此可見,Mg2+、Mn2+能夠很好促進酶促反應,是該酶的激活劑;Cu2+、Ba2+與 K+影響了酶促反應,具有一定抑制作用,為該酶反應抑制劑;其他金屬離子對酶促反應影響不大.
2.6 重組β-半乳糖苷酶 K m與 V max將重組β-半乳糖苷酶與一系列不同濃度ONPG溶液(2、4、8、10、16、20 mmol/L)均勻混合,在最適條件下進行酶促反應,分別測定不同ONPG濃度下的酶活性,并繪制出1/V 對 1/[S]直線,如圖8.通過計算得到Km=0.816 mmol/L,Vmax=45.87 mmol/(L·min).
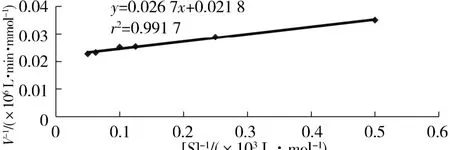
圖8 Lb.brevis GJ1-3來源β-半乳糖苷酶的動力學結果Fig.8 The kineties ofβ-galactosidase from Lb.brevis GJ1-3
3 結束語
本研究將β-半乳糖苷酶重組18號菌株在IPTG的誘導下進行表達.表達蛋白經處理后分別進行SDS-PAGE電泳,結果如圖2和圖3.在圖2中,第1泳道內有2個蛋白條帶,其相對分子質量在 66.2 和35 kDa 附近.結合 Pridmore[6]等報道的短乳桿菌全基因組序列,以及其編碼的β-半乳糖苷酶基因序列,利用DNAMAN軟件預測β-半乳糖苷酶的結構發現,該酶有2個大小亞基構成:編碼大亞基的核苷酸序列大小為1 887 bp,其編碼的蛋白質亞基大小為71.6 kDa;編碼小亞基的核苷酸序列大小為966 bp,其編碼的蛋白質亞基大小為34.5 kDa.圖2中蛋白條帶大致在這個數值附近,然其位置不是很理想,需進一步探討.除此之外,亦有雜蛋白出現,說明鎳柱親和分離效果不理想.在圖3中,有2個表達量很大的蛋白,上清液中目的條帶不明顯.利用上清以及上清蛋白純化液進行酶促反應時發現,加入酶液,反應變色,且反應瞬間結束,說明酶濃度高,底物相對較少,說明反應體系中有重組酶存在,且濃度很高,因此,需稀釋酶液.由此可見,18號菌株表達的重組β-半乳糖苷酶主要以包涵體形式存在于細胞內,僅有部分酶蛋白存在于細胞裂解上清液中,需進一步優化重組菌株培養條件,改善其酶分泌情況.
重組β-半乳糖苷酶最適溫度為37℃,屬于常溫酶,在30~50℃范圍內熱穩定性良好,50℃時能夠保留90%的相對酶活;60℃時相對酶活降低到10%以下.潘渠等[14]研究嗜酸乳桿菌β-半乳糖苷酶異源性表達時發現,β-半乳糖苷酶在60℃時仍能保持一半活性.說明溫度對該酶活性影響較大,較高溫度便會引起酶變性失活.重組酶最適pH值為7.5,在 pH 6.0~8.0范圍內,穩定性較好;pH 6.0時,相對酶活降到10%以下;當pH值增加到10.0時,酶仍保留50%相對酶活.說明該酶對酸比較敏感,對堿適應能力較強.與聶春明[10]研究相比,酶的 pH適應范圍較廣.Mg2+、Mn2+對該酶活性有一定促進作用,其中Mg2+促進作用較好,為酶的激活劑,Cu2+為其抑制劑.Chanalia 等[13]在研究乳酸片球菌來源的β-半乳糖苷酶活性時發現,Ca2+、Mg2+和 Mn2+對該酶具有活化作用.Wutor等[15]研究發現 Cu2+也是該酶的抑制劑.聶春明[10]研究金屬離子對乳酸桿菌來源重組β-半乳糖苷酶時發現,Mg2+具有很好促進作用,高濃度金屬離子會抑制β-半乳糖苷酶活性.宋園亮等[8]研究短乳桿菌β-半乳糖苷酶性質時發現,Mg2+、K+能夠促進酶活性,Ba2+和 Cu2+抑制酶活性.說明Mg2+為其激活劑,Cu2+為抑制劑.潘渠等[14]將嗜酸乳桿菌β-半乳糖苷酶基因在大腸桿菌中進行了表達,測得重組菌株β-半乳糖苷酶的 Km=2.18 mmol/L,Vmax=273 mmol/(L·min).在本研究中,經試驗測得該重組β-半乳糖苷酶特征性常數Km=0.816 mmol/L,最大反應速率 Vmax=45.87 mmol/(L·min).從 Km大小對比發現,短乳桿菌來源重組β-半乳糖苷酶與底物ONPG具有很好的親和力,然而最大反應速率不是很高.酶經鎳柱純化后,酶蛋白基本達到電泳純,但雜蛋白仍然存在.接下來將通過不同分離純化技術,對酶液進行進一步分離提純,獲得更多關于短乳桿菌來源β-半乳糖苷酶的性質,為其工業化應用以及科學研究提供更為詳盡的理論參考.

