橡膠樹樹皮總蛋白的提取方法比較①
梁 群 程 漢黃華孫③
(1海南大學(xué)熱帶農(nóng)林學(xué)院 海南海口570228;2中國熱帶農(nóng)業(yè)科學(xué)院橡膠研究所 海南海口571101)
巴西橡膠樹是大戟科橡膠樹屬植物,是天然 橡膠的最主要來源。橡膠樹樹皮組織中的乳管細(xì)胞作為橡膠樹中合成和貯存橡膠的重要組織,一直是研究的重點(diǎn)[1]。橡膠合成有賴于韌皮部中蔗糖等碳源的代謝和運(yùn)輸及乳管細(xì)胞中各種酶的合成反應(yīng);此外,橡膠樹寒害[2]、割面干涸(Tap‐ping panel dryness,TPD)[3]等生理綜合反應(yīng)都會涉及各種蛋白質(zhì)的表達(dá)和功能。樹皮蛋白的成功提取是研究其表達(dá)和功能的前提。然而迄今尚未見有較成熟的橡膠樹樹皮蛋白質(zhì)提取方法的報(bào)道。
在過去的幾十年里,已有多種植物蛋白樣品制備方法得到應(yīng)用,諸如丙酮沉淀法、TCA/丙酮沉淀法、苯酚提取法、TCA/丙酮-酚提取法、Trizol沉淀法、尿素-硫脲提取法等[4]。但是由于橡膠樹樹皮結(jié)構(gòu)復(fù)雜,木栓化嚴(yán)重,次生代謝產(chǎn)物豐富,蛋白含量低且雜質(zhì)含量高,使高質(zhì)量的蛋白樣品制備比較困難,至今尚未有橡膠樹樹皮中蛋白提取的標(biāo)準(zhǔn)方法。王斌等[5]使用改進(jìn)酚抽法提取巴西橡膠樹木質(zhì)部的蛋白,過程復(fù)雜且步驟繁瑣;袁坤等[6]使用尿素提取液提取方法無法成功獲得高豐度蛋白;谷瑞升等[7]比較了4種木本植物蛋白的提取方法,發(fā)現(xiàn)改良丙酮沉降法對木本植物葉片、懸浮細(xì)胞以及花藥蛋白提取有效。本研究以橡膠樹成熟大樹的樹干樹皮,為材料,比較TCA/丙酮沉淀法(方法1)、TCA/丙酮—雙乙法(方法2)、TCA/丙酮-Tris-HCl法(方法3)3種橡膠樹樹皮中總蛋白質(zhì)的提取方法,并對其進(jìn)行優(yōu)化。
1 材料與方法
1.1 材料
1.1.1 植物材料
所用材料為10年生未開割的巴西橡膠樹RRIM 600,采自海南省儋州國家橡膠樹種質(zhì)資源圃,以樹干木栓化的樹皮為材料,剝?nèi)『蟮臉淦そ?jīng)液氮速凍后,迅速置于–80℃冰箱備用。
1.1.2 主要試劑
丙酮、三氯乙酸、鹽酸、無水乙醇、乙醚、考馬斯亮藍(lán)G-250等,購自廣州化學(xué)試劑廠;尿素、硫脲、二硫蘇糖醇、苯甲基磺酰氟、三羥甲基氨基甲烷、聚乙烯吡咯烷酮、30%丙烯酰胺(29∶1)Acr/Bis、10% AP,購自北京索萊寶科技有限公司;蛋白定量試劑盒Bradford Protein Assay Kit,購自康維世紀(jì)生物科技有限公司。
1.1.3 主要儀器
研磨機(jī)為德國IKA分析研磨機(jī)-All basic,離心機(jī)為Thermo Scientific的HERAEUS Multifuge X1R,METTLER Toledo DELTA 320 pH計(jì),真空干燥機(jī)CentriVap Concentrator LABCONCO,超聲波破碎機(jī),MULTISCAN GO酶標(biāo)儀。
1.2 方法
1.2.1 橡膠樹樹皮總蛋白提取
TCA/丙酮沉淀法:參照Sarawanan等[8]的方法,在此方法基礎(chǔ)上稍作改進(jìn)。稱取一定量的樹皮置于液氮預(yù)冷過的研缽中,加入0.5%(m/m)PVPP防止研磨過程中氧化,反復(fù)加入液氮研磨至粉末;在研磨后的樣品中加入等體積的10%的TCA-丙酮溶液懸浮、0.1 mol/L PMSF、1 mol/L DTT至其終濃度分別為1 mmol/L、10 mmol/L,于-20℃靜置6 h或過夜后,以4℃、20 000 g離心15 min,棄上清;沉淀用等體積的預(yù)冷的丙酮溶液重懸浮(加入20 mmol/L DTT),于-20℃靜置1 h后,以4℃、20 000 g離心15 min,棄上清,用丙酮再重復(fù)洗2次直至沒有顏色;取出沉淀真空干燥約5 min,除盡有機(jī)溶劑;按照10 mg干粉末加入200滋L尿素裂解液(7 mol/L尿素、2 mol/L硫脲、4%CHAPS)的比例,再加入1 mmol/L PMSF、10 mmol/L DTT,超聲5 min,充分溶解1 h后,以4℃,35 000 g離心30 min,上清為所需的蛋白溶液。
TCA/丙酮—雙乙法:與TCA/丙酮沉淀法相比,在用TCA/丙酮清洗樹皮粉末3次并離心后,加入雙乙試劑(V乙醇∶V乙醚=1∶1),于-20℃靜置1 h后,以4℃,20 000 g離心15 min,棄上清;再加入丙酮重復(fù)洗2次直至沒有顏色。后續(xù)操作均與TCA/丙酮沉淀法相同。
TCA/丙酮-Tris-HCl法:按TCA/丙酮沉淀法的操作進(jìn)行至真空干燥獲得樹皮干粉后,用Tris-HCl(120 mmol/L Tris-HCl、20%甘油、4% SDS)溶液代替尿素裂解液溶解樹皮粉末,其他操作均與TCA/丙酮沉淀法相同。
1.2.2 蛋白定量
使用康為世紀(jì)生物科技有限公司的Bradford Protein Assay Kit測量蛋白質(zhì)濃度,以試劑盒中的牛血清蛋白(BSA)為標(biāo)準(zhǔn)蛋白質(zhì)制作標(biāo)準(zhǔn)曲線;取待測樣品1滋L于試劑盒中的考馬斯亮藍(lán)G-250顯色液中,使用MULTISCAN GO酶標(biāo)儀測其OD595值,蛋白質(zhì)濃度表示為mg/mL,重復(fù)3次以評估蛋白質(zhì)提取效率。
1.2.3 SDS-PAGE與Western blot
制作2塊SDS-PAGE膠,分離膠和濃縮膠的濃度分別是10%和5%;將上述3種方法提取的蛋白母液用SDS-PAGE上樣緩沖液稀釋,在100℃下煮沸5 min后迅速置于冰上,待其冷卻后加入孔中,50 V起始電壓,待樣品進(jìn)入分離膠后將電壓升到100 V;電泳完畢后將其中一塊膠進(jìn)行考馬斯亮藍(lán)R-250染色,另一塊膠進(jìn)行western blot實(shí)驗(yàn),具體實(shí)驗(yàn)步驟參考abcam官網(wǎng)[9]的方法。
2 結(jié)果與分析
2.1 三種橡膠樹樹皮總蛋白提取方法比較
采用的3種橡膠樹樹皮蛋白提取方法,在傳統(tǒng)的丙酮/TCA法的基礎(chǔ)上稍加改進(jìn)。橡膠樹樹皮經(jīng)過液氮研磨后,加入TCA/丙酮?jiǎng)驖{,經(jīng)過離心、真空干燥等步驟得到樹皮干粉;隨后加入尿素裂解液、雙乙試劑和Tris-HCl提取液溶解,經(jīng)過超聲波助溶破碎離心,得到樹皮總蛋白的粗提液(圖1)。由于傳統(tǒng)的提取方法最后的蛋白溶解時(shí)間過長,容易造成蛋白質(zhì)降解,因此改進(jìn)方法中主要優(yōu)化了提取液配方,以防止蛋白質(zhì)降解。TCA/丙酮-雙乙法是先使用雙乙試劑(V乙醇∶V乙醚=1∶1)清洗殘留丙酮,用尿素裂解液溶解提取;TCA/丙酮-Tris-HCl法采用Tris-HCl提取液(120 mmol/L Tris-HCl、20%甘油、4%SDS)。
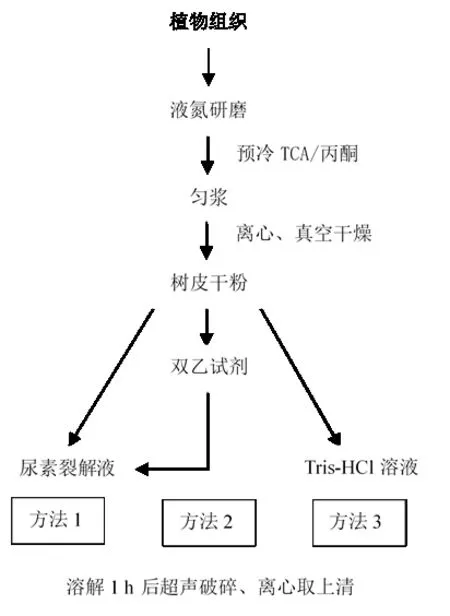
圖1三種蛋白質(zhì)提取方案的示意圖
2.2 三種總蛋白提取方法的提取效率比較
使用3種提取方案對蛋白質(zhì)提取物進(jìn)行定量比較,發(fā)現(xiàn)不同提取方法獲得的蛋白質(zhì)質(zhì)量有所差異。TCA/丙酮沉淀法耗時(shí)最少,且Western blot結(jié)果清晰,無雜帶,但總蛋白電泳可見的條帶數(shù)目最少,蛋白濃度偏低。TCA/丙酮—雙乙法耗時(shí)最多,可見條帶數(shù)目比TCA/丙酮要多,蛋白濃度相差不大。TCA/丙酮-Tris-HCl法耗時(shí)較少,提取蛋白的濃度最高達(dá)到3.21 mg/mL,SDS-PAGE電泳的條帶清晰,上樣孔干凈,泳道無拖尾,條帶數(shù)量最多。綜合來看,TCA/丙酮-Tris-HCl提取的蛋白質(zhì)量較好(表1)。
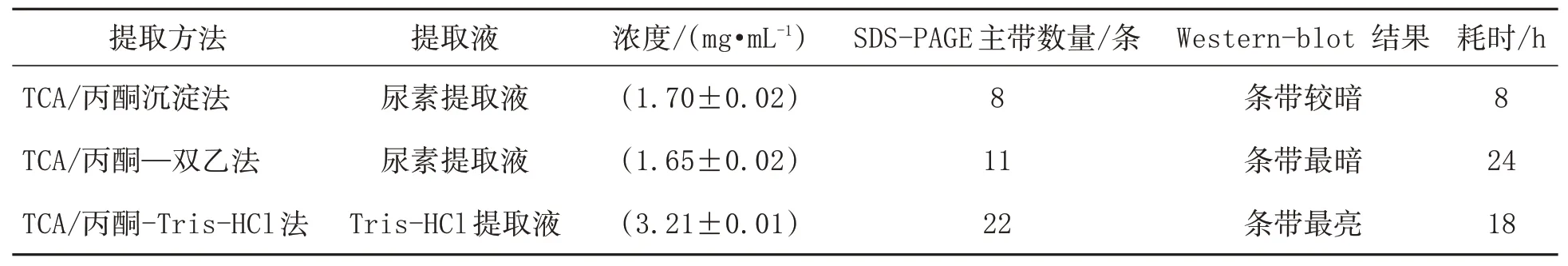
表1三種橡膠樹樹皮總蛋白提取方法的提取效果比較
2.3 三種總蛋白提取方法的電泳結(jié)果
將3種方法提取的蛋白進(jìn)行SDS-PAGE電泳分析,上樣量均為100滋g。電泳結(jié)束后進(jìn)行考馬斯亮藍(lán)染色與脫色,結(jié)果如圖2所示。TCA/丙酮法(泳道1)和TCA/丙酮—雙乙法(泳道2)提取的蛋白經(jīng)過電泳后,泳道背景較深,加樣孔中有殘留雜質(zhì),泳道拖尾嚴(yán)重,主帶難以區(qū)分,說明這2種方法提取的總蛋白中含有較多的雜質(zhì)。TCA/丙酮-Tris-HCl法(泳道3)提取的蛋白經(jīng)過電泳后,泳道背景最淡,加樣孔干凈無殘留,蛋白條帶清晰可見。使用Gel Image Analysis軟件分析膠圖可知,方法1檢測條帶數(shù)目為8條,方法2檢測條帶數(shù)目為11條,方法3檢測條帶數(shù)目為22條。表明TCA/丙酮-Tris-HCl法提取的橡膠樹樹皮總蛋白凝膠電泳效果最好。
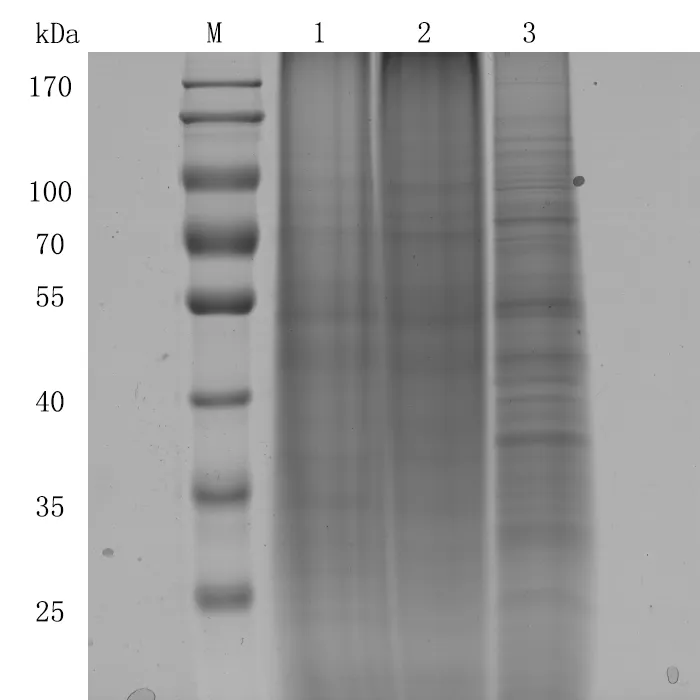
圖2不同提取方法提取橡膠樹樹皮總蛋白的單向電泳圖
2.4 三種蛋白提取方法的Western blot分析
將提取的蛋白質(zhì)經(jīng)SDS-PAGE電泳后,轉(zhuǎn)膜至PVDF膜,經(jīng)過Western blot分析后的結(jié)果如圖3所示。使用Western blot對橡膠樹樹皮中微管蛋白tubulin進(jìn)行定量分析可知,圖譜背景清晰,蛋白條帶清晰且位置大小正確。在使用相同上樣量的情況下,TCA/丙酮-Tris-HCl法的條帶更亮,常規(guī)TCA/丙酮沉淀法和TCA/丙酮—雙乙法的條帶較弱。推測原因可能是樣品雜質(zhì)較高導(dǎo)致這2種方法提取的蛋白量偏高。
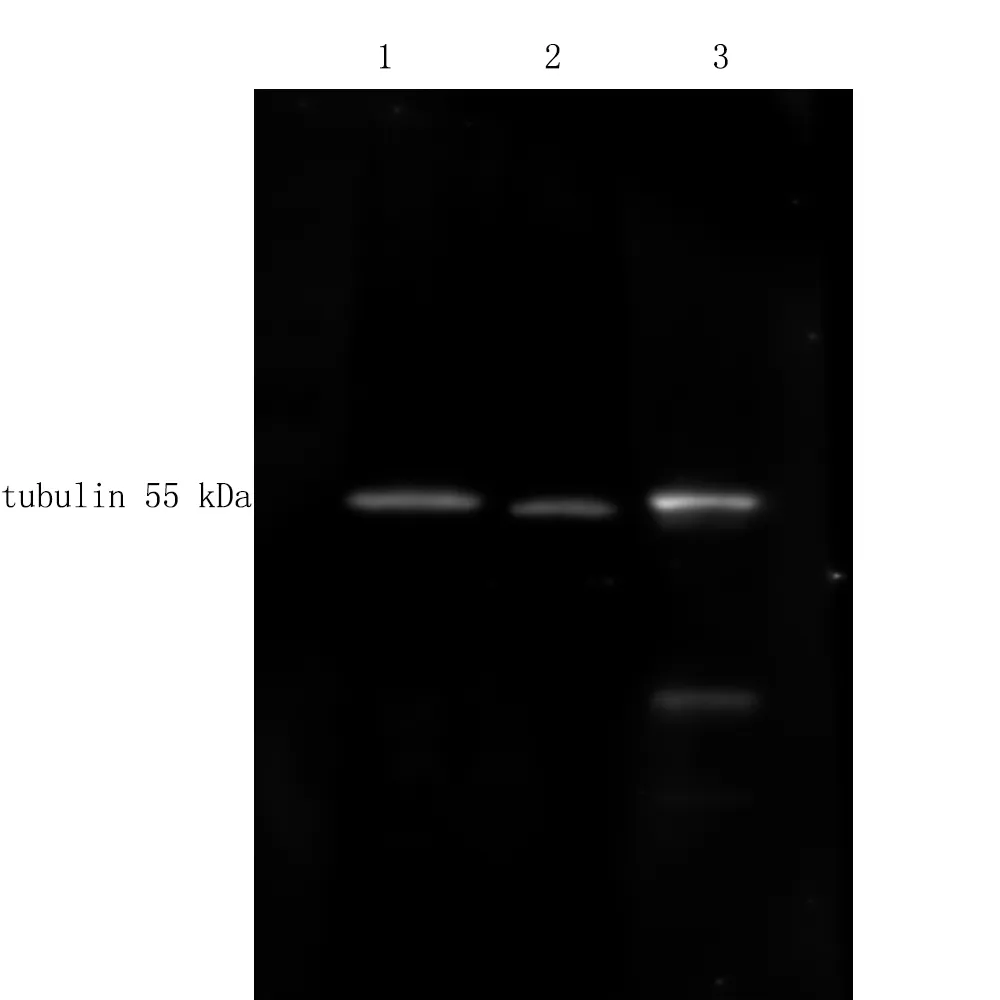
圖3 3種蛋白提取方法提取橡膠樹樹皮tubulin蛋白定量
3 討論
橡膠樹樹皮蛋白提取過程復(fù)雜,且研磨困難。本研究為了得到充分研磨好的樹皮粉末,首先使用剪刀剪碎樹皮,然后使用研磨機(jī)研磨樹皮,操作時(shí)間過長,因此可能會導(dǎo)致蛋白質(zhì)降解。因此,后續(xù)的提取方法中,在抑制蛋白降解方面要有所改進(jìn)。
常規(guī)TCA/丙酮提取法耗時(shí)少且容易操作,一般作為植物蛋白提取的初始方案,是目前提取植物蛋白的常用方法之一,具有降低次生代謝物質(zhì)干擾、減少蛋白降解等優(yōu)點(diǎn),但該方法常用于幼嫩組織中蛋白的提取,不適用于更為復(fù)雜的植物組織[10];該方法的一個(gè)最大缺點(diǎn)是蛋白質(zhì)很難重新溶解,而且樣品中的非蛋白成分很難除去,可能會丟失膜蛋白和疏水性蛋白[11]。用乙醇—乙醚洗滌以除去水溶性雜質(zhì)(包括高濃度的鹽離子),比傳統(tǒng)的TCA/丙酮法方法能更有效地排除雜質(zhì)干擾;TCA丙酮-Tris-HCl法的提取效果明顯比前2個(gè)方法更好,主要表現(xiàn)在蛋白條帶的數(shù)目以及條帶的清晰度,而且Tris-HC1法操作簡便,時(shí)間較短,成本適中,提取步驟簡單,減少了因處理步驟繁多而造成的蛋白質(zhì)損失,大大提高了試驗(yàn)結(jié)果的重復(fù)性[10]。
巴西橡膠樹作為一種重要的產(chǎn)膠作物,其主要經(jīng)濟(jì)價(jià)值均存在于樹皮中的乳管細(xì)胞。開展乳管及樹皮內(nèi)重要蛋白質(zhì)功能研究對于后續(xù)進(jìn)行橡膠合成及代謝調(diào)控研究至關(guān)重要。本研究通過比較3種橡膠樹樹皮蛋白質(zhì)提取方法,提出了一種簡單高效的橡膠樹樹皮蛋白提取方法,為進(jìn)一步開展橡膠樹樹皮內(nèi)重要蛋白功能研究提供了參考。
- 熱帶農(nóng)業(yè)科學(xué)的其它文章
- 鄉(xiāng)村經(jīng)濟(jì)振興視域下鄉(xiāng)賢文化培育研究①
- 經(jīng)濟(jì)新形勢下的農(nóng)產(chǎn)品產(chǎn)供銷網(wǎng)絡(luò)系統(tǒng)構(gòu)建①
- 基于供給側(cè)改革的農(nóng)產(chǎn)品結(jié)構(gòu)優(yōu)化機(jī)制研究①
- 我國芒果產(chǎn)業(yè)數(shù)據(jù)資源現(xiàn)狀與發(fā)展對策①
- 陜西省農(nóng)旅一體化發(fā)展策略分析①
- 不同空間插值方法在昭通烤煙種植區(qū)氣溫與降水估算中的適用性評價(jià)①

