慢性HBV感染者IFN-γ+NK細胞與Treg及IL-10的關系研究①
夏 天 馬晴晴 李小月 徐元宏 鄭美娟
(安徽醫科大學第一附屬醫院檢驗科,合肥 230022)
乙型肝炎病毒(hepatitis B virus,HBV)是嗜肝DNA病毒科成員,可導致慢性乙型肝炎(chronic hepatitis B,CHB)、肝硬化(liver cirrhosis,LC),甚至肝細胞癌(hepatocellular carcinoma,HCC),嚴重威脅人類健康[1]。雖然嗜肝性病原體如HBV感染可誘導肝臟免疫耐受,但肝臟耐受介導CHB進展至LC和HCC的原因尚未闡明。
調節性T(regulatory T cell,Treg)細胞表達CD4、CD25和Foxp3,通過細胞接觸或分泌免疫抑制性細胞因子抑制免疫效應細胞活性,介導負向免疫調控[2]。IL-10可介導抗病毒免疫應答的抑制作用,參與CHB發病[3]。研究表明IL-10可由 Treg、樹突狀細胞、骨髓來源的抑制性細胞(myeloid-derived suppressor cells,MDSCs)及Kupffer cell等分泌[4-6]。Treg與CHB患者外周血病毒載量及HBeAg有關,提示CHB患者 Treg細胞及其分泌的細胞因子在HBV感染中起重要作用[7]。
NK細胞是固有免疫系統的重要成員,亦是機體抗感染和抗腫瘤免疫的第一道天然防線,無需抗原的預先刺激即可直接殺傷被病毒感染的細胞或腫瘤細胞。本團隊前期研究發現,急性HBV感染NK細胞分泌的IFN-γ參與HBV清除,而CHB患者IL-10與NK細胞高表達抑制性受體NKG2A密切相關[8,9]。而CHB、LC和HCC患者NK細胞功能與Treg誘導的肝臟免疫耐受的關系尚不清楚。因此,本文擬探討HBV持續感染導致的CHB、LC及HCC患者NK細胞及IFN-γ+NK細胞與Treg及IL-10的相關性闡明,以期為HBV慢性感染及其進展疾病的發病機制及臨床治療提供理論支持。
1 材料與方法
1.1材料
1.1.1研究對象 選取安慶市第一人民醫院HBV相關肝病患者119例,其中CHB患者57例,LC患者40例, HCC患者22例。健康對照組(health controls,HC)選擇我院性別、年齡相匹配的體檢健康者27例。CHB、LC、HCC診斷分別符合《慢性乙型肝炎防治指南 2010年更新版》和《原發性肝癌診斷標準》,并排除HAV、HCV、HEV、HIV和其他嗜肝病毒感染,同時排除自身免疫性疾病等導致的肝損害及肝臟以外的惡性腫瘤。本實驗通過本院倫理委員會批準,所有參檢者知情同意。
1.1.2主要儀器和試劑 FACS Calibur型流式細胞儀、FACS CANTO Ⅱ PLUS型流式細胞儀、抗CD25-FITC、抗CD4-PE、溶血素、CBA Human Th1/Th2 Cytokine Kit 、BD MultiTEST IMK Kit均購自美國BD公司;抗Foxp3-APC內標染色試劑盒購自美國eBioscience公司;PMA、MON及ION購自Sigma公司;7600型自動生化分析儀購自HITACHI公司。
1.2方法
1.2.1Treg的檢測 取新鮮(<24 h)采集的EDTA抗凝全血標本100 μl,加入抗CD25-FITC、抗CD4-PE,避光孵育15 min,加1 ml溶血素,混勻,避光15 min,1 500 r/min離心5 min,棄上清,1 ml PBS洗滌,加入固定穿膜液4℃避光60 min,Buffer洗滌2次,棄上清,加Foxp3-APC,避光60 min,PBS洗滌2次,棄上清,加200 μl PBS,FACS Calibur型流式細胞儀檢測,DIVA軟件分析CD4+CD25+Foxp3+細胞比例。
1.2.2Th1/Th2細胞因子檢測 按照需要檢測的樣本數量配制Mixbead,1 500 r/min離心5 min,棄上清,加等體積Serum Enhancement Buffer,輕輕混勻后避光30 min;倍比稀釋標準品,得到原液、1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256,9個濃度的標準品。取流式管,每管加50 μl Mixbead,繼續加入50 μl血清或標準品,再加入50 μl抗體,振蕩,避光孵育3 h,加1 ml PBS,1 500 r/min離心5 min,棄上清,加300 μl PBS,FACS Calibur型流式細胞儀檢測,DIVA軟件和OriginPro軟件分析細胞因子濃度。
1.2.3外周血淋巴細胞亞群(CD3+、CD4+、CD8+T淋巴細胞、NK細胞)檢測 取2支流式管,分別編號A1、A2,A1管加入CD3-FITC/CD8-PE/CD45-PreCP/CD4-APC抗體20 μl,A2管加入CD3-FITC/CD16+CD56+-PE/CD45-PreCP/CD19-APC抗體20 μl,新鮮(<24 h)采集的EDTA抗凝全血標本各100 μl分別加入A1、A2管,混勻,避光孵育15 min,加入FACS Lysing溶血液2 ml,室溫避光孵育10 min。1 500 r/min離心5 min,棄上清,PBS洗滌細胞2次,重復離心棄上清,加入PBS 500 μl,FACS Calibur型流式細胞儀檢測。
1.2.4IFN-γ+NK細胞檢測 分離PBMC,配制含10%FBS的DMEM培養基、50 ng/ml PMA,2 mg/ml MON及500 ng/ml ION,將細胞加入1 ml培養基,刺激細胞后,加入表面標記NK細胞,固定外標后的細胞40 min,加穿膜液破膜,加入5 μl FITC-IFN-γ,4℃避光孵育60 min,加入1 ml PBS,棄上清,200 μl PBS重懸,FACS CANTO Ⅱ PLUS型流式細胞儀檢測。
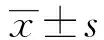
2 結果
2.1患者臨床資料 與HC組相比,CHB、LC、HCC組患者ALT、AST均顯著升高,差異有統計學意義(P<0.01)。見表1。
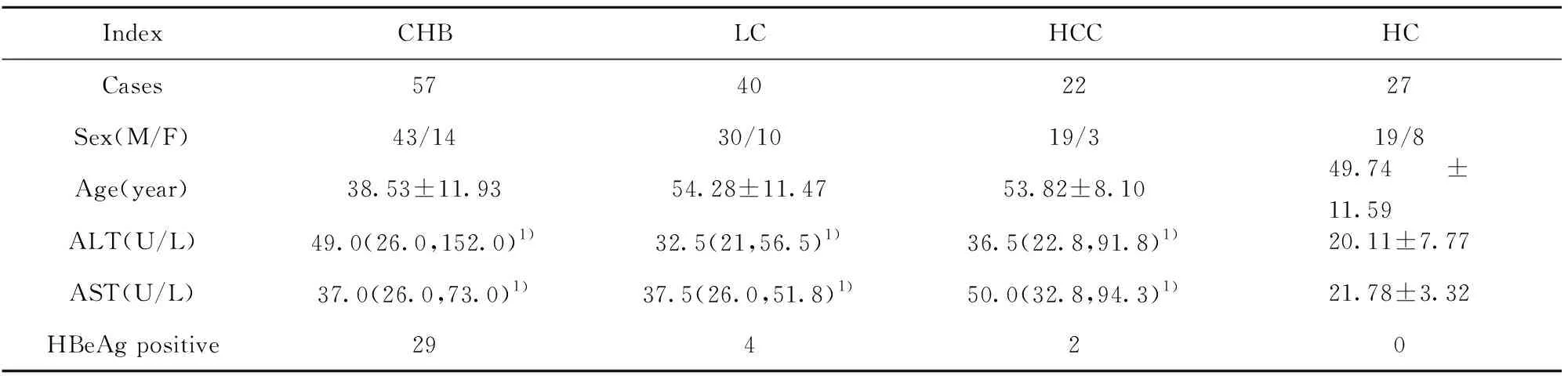
表1 各組臨床資料
2.2各組外周血Treg及細胞因子水平 外周血Treg的比例為CD4+CD25+Foxp3+Treg占CD4+T細胞的百分比。研究發現,與健康對照組相比,CHB、LC、HCC組外周血Treg百分比分別顯著升高(P<0.01);CHB、HCC組外周血Treg計數分別為(29.53±13.33)個/μl 和30.47(21.99,46.03)個/μl,顯著高于健康對照組(22.43±11.26)個/μl,差異有統計學意義(P<0.05)。CHB、LC及HCC組血清IL-10含量分別為1.56(1.22,2.63)pg/ml、1.94(1.30,3.30)pg/ml、2.81(1.91,3.63)pg/ml,均顯著高于HC組的1.21(1.05,1.46)pg/ml,差異有統計學意義(P<0.01)。結果見圖1、表2。在CHB組中,Treg和IL-10正相關(P<0.01,r=0.564),和IFN-γ有一定程度上的負相關(P<0.01,r=-0.342);LC組Treg和IL-10正相關(P<0.01,r=0.426);HCC組Treg和IL-10正相關(P<0.05,r=0.476)。
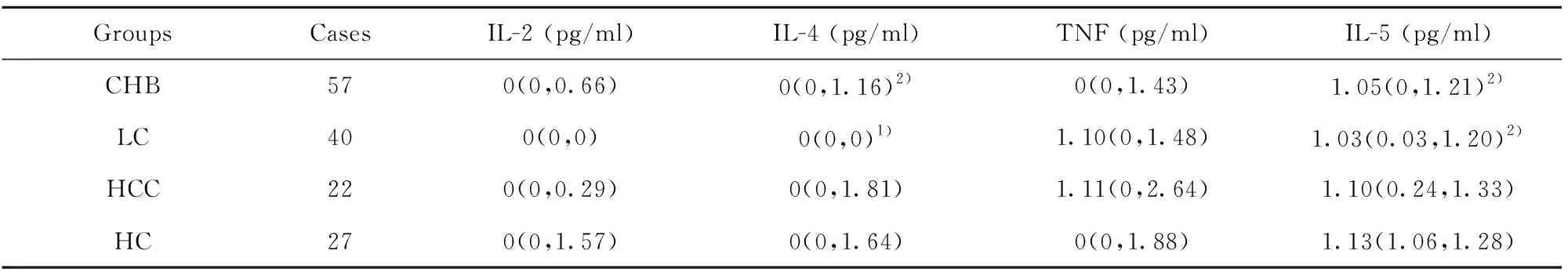
表2 各組外周血細胞因子水平
2.3各組外周血中CD3+、CD4+、CD8+T淋巴細胞及NK細胞變化 NK細胞在CHB、LC及HCC組中顯著低于HC組;除NK細胞外, LC組中CD3+、CD4+、CD8+T淋巴細胞與HC組相比,HCC組中CD8+T淋巴細胞與HC組相比,差異均有統計學意義(均P<0.05)。見表3。
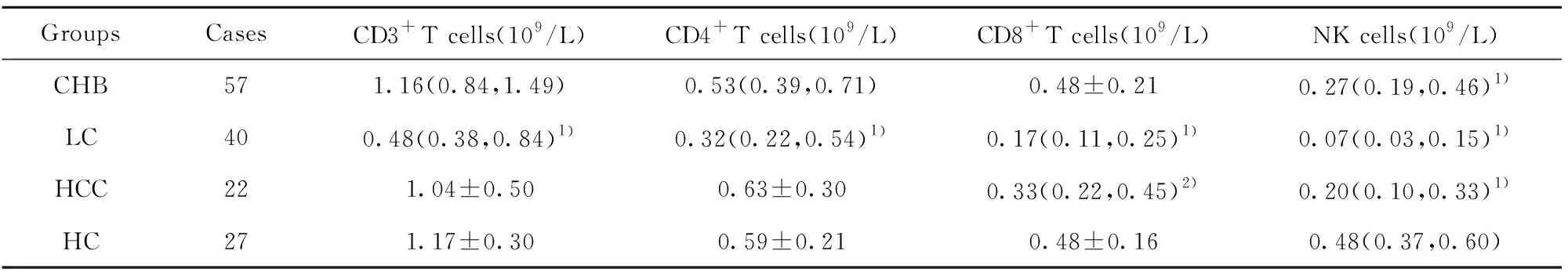
表3 各組外周血中CD3+ T、CD4+ T、CD8+T淋巴細胞、NK細胞的水平比較
2.4比較CHB、LC、HCC患者及健康對照者外周血IFN-γ+NK細胞的百分比及血清IFN-γ含量 CHB、LC及HCC組的IFN-γ+NK細胞比例分別為(76.18±6.79)%、(36.92±26.41)%及(35.03±21.31)%,均顯著低于HC組。CHB、LC、HCC組血清IFN-γ含量分別為0(0,1.47)pg/ml、0(0,1.57)pg/ml、0.55(0,1.57)pg/ml,均低于HC組,見圖2。
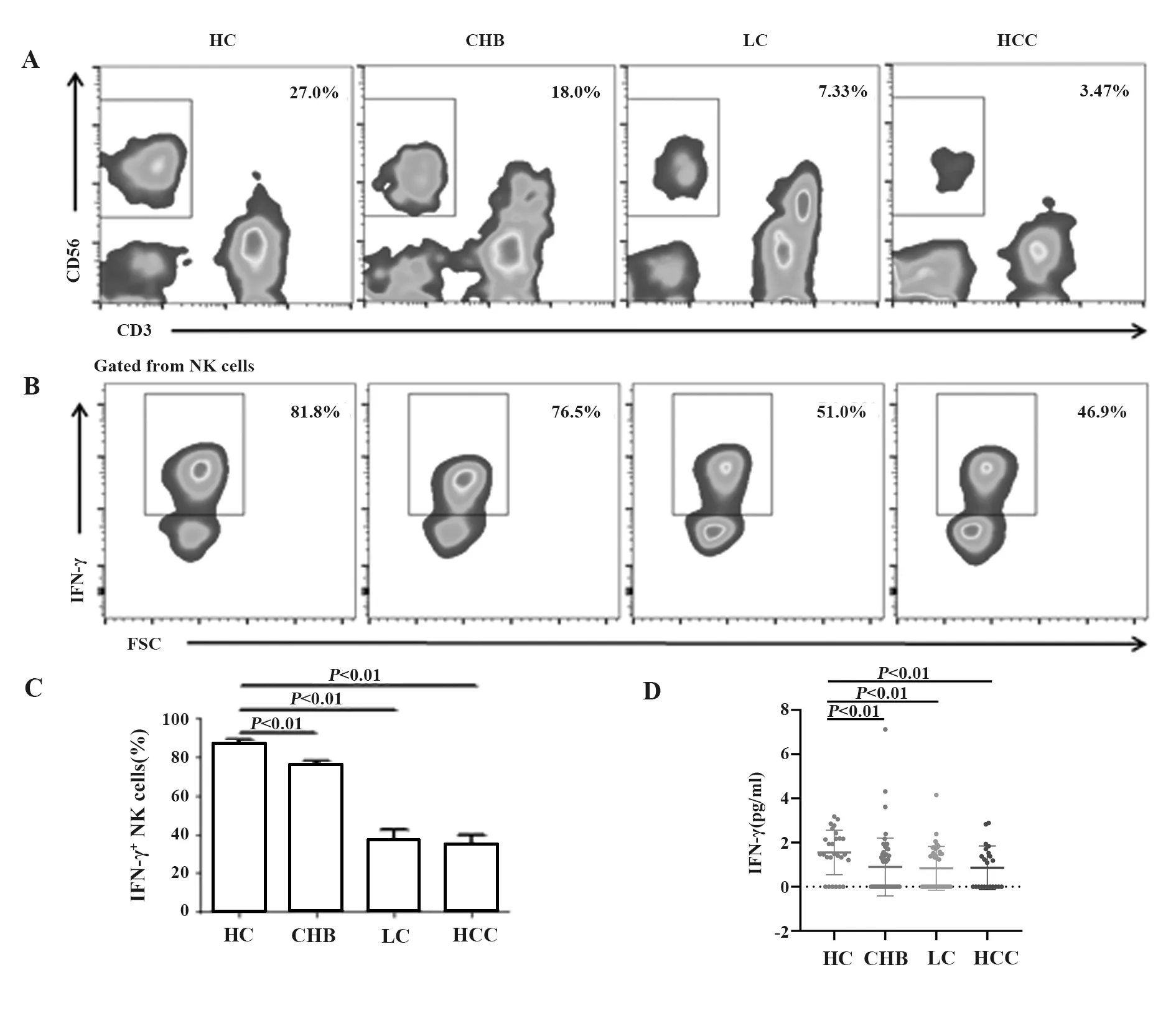
圖2 比較CHB、LC及HCC患者與HC組外周血IFN-γ+NK細胞的百分比及血清IFN-γ含量Fig.2 Comparison of percentages of IFN-γ+NK cells in peripheral blood and serum IFN-γ concentration among patients from CHB,LC and HCC and healthy controls
2.5CHB、LC及HCC患者外周血IFN-γ+NK細胞比例/NK細胞計數與Treg比例、IL-10水平的相關性分析 結果表明CHB患者組IFN-γ+NK比例與Treg比例、血清IL-10水平均負相關(P<0.05,r=-0.618;P<0.05,r=-0.635),血清IFN-γ水平亦與Treg細胞比例負相關(P<0.01,r=-0.342); LC患者外周血中NK細胞計數與Treg的比例負相關(P<0.05,r=-0.317),IFN-γ+NK細胞比例與血清中IL-10水平負相關(P<0.05,r=-0.514)。HCC患者組IFN-γ+NK細胞比例與Treg細胞比例、IL-10水平均負相關(P<0.01,r=-0.676;P<0.01,r=-0.615)。見圖3。
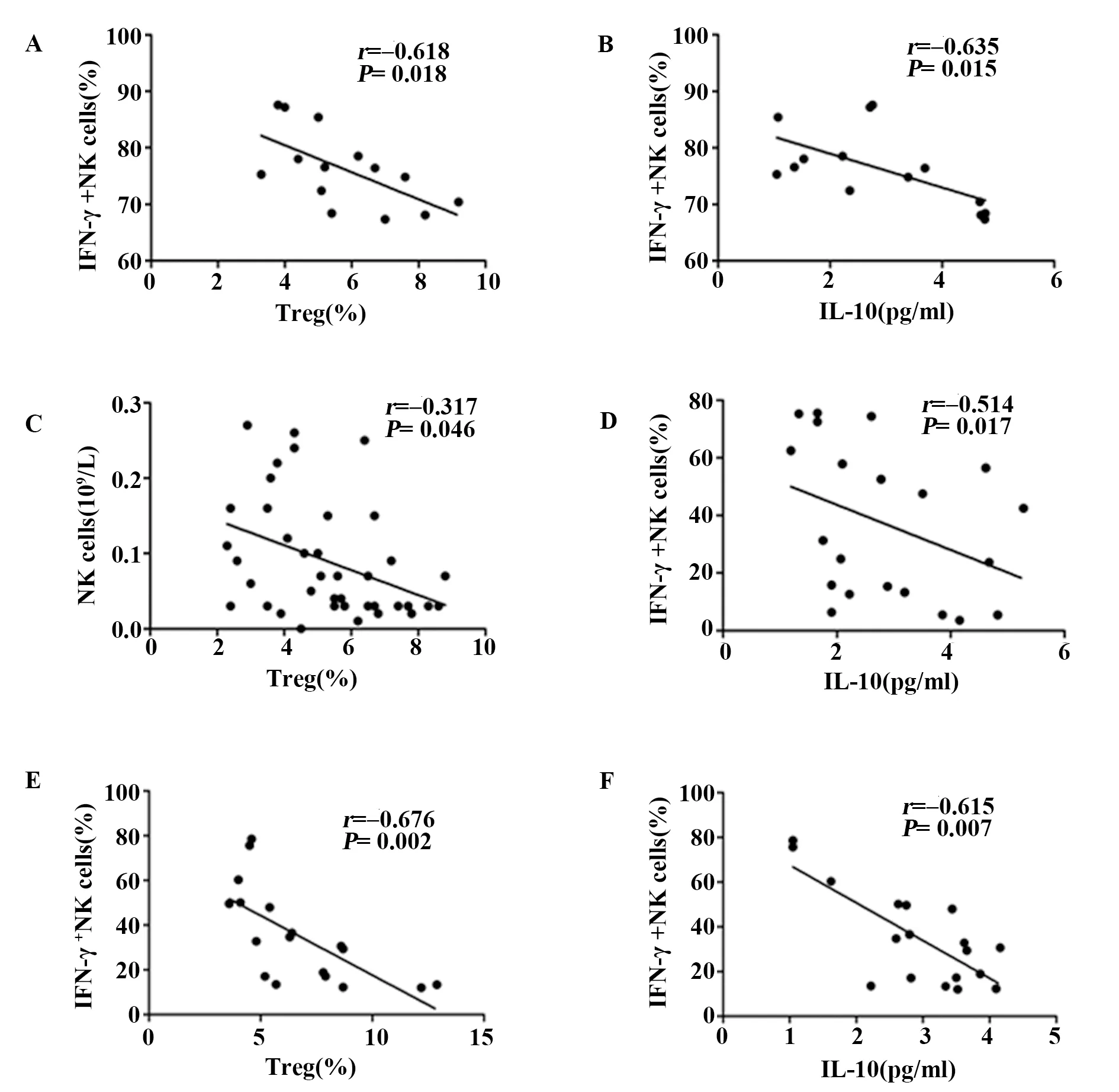
圖3 CHB、LC及HCC患者外周血IFN-γ+NK細胞比例/NK細胞計數與Treg細胞比例IL-10水平的相關性分析Fig.3 Correlation analysis of the ratio of IFN-γ+NK cells/NK cell count with Treg cell ratio and IL-10 level in peripheral blood of patients with CHB, LC and HCCNote:A,B.Correlation analysis of IFN-γ+NK cell percentages with frequencies of Treg in peripheral blood and serum IL-10 level in CHB patients;C,D.correlation analysis between number of NK cells and percentages of Tregs in peripheral blood,percentages of IFN-γ+NK cells and the level of IL-10 in serum of LC patients;E,F.Correlation analysis of frequencies of IFN-γ+NK cells with Tregs in peripheral blood and serum IL-10 level in HCC patients.
3 討論
Treg介導的免疫抑制效應可能是CHB發展的原因之一[10]。Treg約占正常人CD4+T細胞的5%~10%,具有免疫抑制功能,其重要表型為CD4+CD25+Foxp3+,最特異的標記之一是叉頭轉錄因子Foxp3[11]。本研究發現Treg細胞比例在CHB、LC、HCC患者外周血中明顯高于HC組,與既往研究結論一致[12]。慢性HBV感染中,Tregs隨HBV抗原負載增加而增加,且作為HBV的避難所,可避免免疫攻擊,減輕肝臟損傷[13]。肝癌通常在慢性肝炎和肝硬化的環境下發展,Tregs可能通過抑制免疫應答(如HBV)或控制腫瘤生長(如肝癌)促進持續性感染。Fu等[12]認為外周血CD4+CD25+Foxp3+Treg在數值上與疾病進展相關,可被認為是肝癌患者生存不良的預測因子,且Treg增加抑制CD4+輔助性T細胞反應,并促進肝癌進展。以上結果表明,HBV可能增強Treg的誘導。慢性HBV感染加上長期復發的免疫介導的肝損傷有助于LC和HCC發展。本研究發現Treg計數在CHB和HCC組高于HC組(P<0.05),而LC組Treg計數與HC組差異無統計學意義。本研究中,Treg計數通過血常規淋巴細胞計數×CD4+T%×Treg%得出,LC患者常伴有脾功能亢進,而脾功能亢進可引起外周血3系降低,淋巴細胞計數降低,可能是導致Treg計數在LC組和HC組中差異無統計學意義的原因。
Th1型相關細胞因子(如IL-2、TNF、IFN-γ)和Th2型相關細胞因子(如IL-4、IL-5、IL-10)是細胞因子的兩大類。Th1型細胞因子介導細胞免疫應答,而Th2型細胞因子主要介導體液免疫應答。由于細胞因子與HBV感染后炎癥發生密切相關,本研究檢測了Th1和Th2細胞因子在HBV感染疾病中的分泌水平。抑制性細胞因子IL-10可介導Treg的抑制功能,其可通過誘導肝臟耐受抑制肝臟炎癥損傷[14,15]。研究發現IL-10在CHB、LC、HCC患者外周血中明顯高于HC組,與Zekri等[16]的結論一致。研究表明IL-10表達增加是導致慢性HBV感染的主要因素[17]。IL-10可抑制宿主的抗HBV活性,導致體內HBV持續復制和表達。IL-10水平的升高與HBV血清滴度和肝臟炎癥程度有關,且介導纖維化進程及疾病進展[18]。CHB患者中,Treg和IL-10呈正相關,和IFN-γ存在一定程度的負相關,在LC和HCC中,Treg和IL-10亦呈正相關,可能由于HBV的存在增強Foxp3的表達和Treg細胞誘導作用[19]。Treg產生IL-10, IL-10不僅抑制Th1型細胞免疫反應,還可抑制Th1型細胞分泌細胞因子IFN-γ等[20]。研究表明,CD4+CD25+T細胞促進慢性HBV感染者免疫反應受損,劑量依賴性地抑制對HBcAg特異性的IFN-γ產生,還能抑制HBV特異性CD8+T細胞的增殖和IFN-γ的產生[21,22]。IFN-γ主要由活化T細胞和NK細胞產生,而IL-10可通過抑制NK細胞活性抑制IFN-γ[23]。
HBV感染期間,NK細胞作為宿主抵抗病毒感染和腫瘤的第一道防線在抗病毒免疫中發揮重要作用[24]。NK細胞表達大量的免疫識別受體(NK受體),維持NK細胞免疫應答和免疫耐受平衡。NK細胞受體的異常表達和肝臟NK細胞的功能障礙是導致慢性HBV感染和HCC的原因,且與肝癌預后不良顯著相關。腫瘤免疫細胞在宿主免疫防御及腫瘤進展中起重要作用。以NK細胞受體-配體系統為靶點的新藥和聯合治療策略可能對肝癌的免疫治療起積極作用[25]。本研究發現,在CHB、LC和HCC組中,NK細胞降低(P<0.01),與Li等[26]研究結果一致。
Yang等[27]觀察到HBV成分進入NK細胞,部分通過抑制核因子κB(NF-κB)和p38有絲分裂原激活蛋白激酶(MAPK)信號通路導致NK細胞功能障礙、細胞毒性和IFN-γ分泌降低。與本研究結果一致,IFN-γ水平在CHB、LC、HCC組有不同程度降低,可能是由于IFN-γ除NK T細胞、CD8+T細胞和Th1細胞外,還可由NK細胞產生[28]。本研究發現NK細胞在CHB、LC和HCC組中降低,為進一步證實,實驗人員隨機抽取一部分CHB、LC、HCC患者和HC組標本,檢測各組外周血NK細胞表達的IFN-γ占NK細胞的百分比。結果發現,與HC組相比,CHB、LC和HCC組IFN-γ+NK細胞的百分比降低(P<0.01),與Zhang等[29]的meta分析結果一致。
本研究發現在HBV進展中,CHB、HCC患者組IFN-γ+NK細胞比例與Treg細胞比例、IL-10水平均呈負相關;LC患者外周血NK細胞計數與Treg細胞比例呈負相關,IFN-γ+NK細胞比例與血清IL-10水平呈負相關,是因為Tregs參與慢性炎癥發生和腫瘤進展,且可抑制NK細胞[30]。此外,Treg通過分泌免疫抑制性細胞因子IL-10,引起NK細胞減少,從而產生耐受性和抑制性環境[31]。在CHB中,高水平IL-10產生可能參與抑制NK細胞產生IFN-γ[32]。CD4+CD25+Tregs以細胞接觸的方式直接抑制NK細胞的肝細胞毒性,對于揭示HBV相關肝病的免疫損傷機制和調節機制至關重要,Tregs的免疫抑制作用可能用于治療慢性乙肝病毒感染[33]。
本研究探討了HBV患者疾病進展過程中NK細胞與Treg及細胞因子的關系,通過檢測HBV進展過程中患者外周血NK細胞計數、IFN-γ+NK細胞比例、Treg百分比及計數及細胞因子濃度,闡述IFN-γ+NK細胞與Treg分泌的IL-10之間的關系,以期為了解乙型肝炎的發病機制及進展提供理論支持。研究表明NK細胞的功能缺陷在接受抗病毒治療的CHB患者中持續存在,但可通過特異性阻斷IL-10在體外逆轉[34]。近年NK細胞在肝纖維化中的作用受到廣泛關注,提示NK細胞有望成為肝纖維化治療的重要靶細胞和腫瘤治療的免疫靶點[35,36]。免疫療法正迅速發展為除外科、化學療法、放射療法和靶向治療外癌癥治療外的“第五支柱”。嵌合抗原受體(CAR)工程免疫細胞是腫瘤免疫治療中的具有廣泛前景的分支[37]。由于NK細胞不需要嚴格的HLA匹配,也不存在移植物抗宿主疾病的風險,因此CAR-NK細胞療法比傳統的CAR-T細胞療法更安全。本研究結果及本領域的其他研究進展提示或許可通過阻斷Treg或者IL-10恢復NK細胞功能,為CHB感染者提供有效治療;或者聯合CAR-NK細胞療法抑制HBV復制,阻止HBV的惡性進展,以上方式有望在HBV治療中發揮作用[16,37,38]。

