miR-411-3p靶向PAK2介導Wnt信號通路對口腔鱗狀細胞癌侵襲和轉移的影響及調控機制①
麥明思 趙 焱 馬 鍇 (三亞市人民醫院口腔科,三亞 572000)
口腔鱗狀細胞癌指發病于口腔,以鱗狀細胞為主的惡性腫瘤,是頭頸部腫瘤中惡性程度最高且危害最大的腫瘤[1,2]。腫瘤的侵襲和轉移是引起患者病情惡化的重要因素,因此尋找抑制腫瘤侵襲轉移的方法十分重要[3]。p21活化激酶2(p21 activated kinase 2,PAK2)屬于進化保守的絲氨酸/蘇氨酸蛋白激酶,是小G蛋白Rho家族中GTP的重要效應物[4]。研究表明PAK2活性升高與人類腫瘤發生發展相關,如PAK2/PIX通路活化能誘導乳腺癌雌激素抵抗[5]。PAK2活化與晚期胃癌的進展及預后不良相關[6]。口腔鱗狀細胞癌相關研究發現,相比于正常口腔黏膜組織,PAK2在口腔鱗癌中表達顯著增強[7]。miR-411經研究證實在腎細胞癌、乳腺癌、大腸癌等多種腫瘤中均發揮抑癌因子作用[8-10]。但其在口腔鱗癌中的作用尚未闡明。Wnt通路經研究證實在包括口腔癌在內的頭頸部腫瘤中均存在異常活化現象。本研究旨在探討miR-411-3p靶向PAK2在口腔鱗狀細胞癌中的作用及機制。
1 材料與方法
1.1材料
1.1.1試劑與儀器 基因組DNA提取試劑盒、Lipofectamine 3000試劑盒、Trizol試劑盒、TransScriptⅡGreen One-Step qRT-PCR SuperMix試劑盒、CCK8試劑盒購自賽默飛世爾;人舌鱗癌細胞株HSC-4、Tca8113、TcaSll3及人頰鱗癌細胞株BcaCD885購自拜力生物;miR-411-3p agomir、miR-411-3p antagomir購自上海吉瑪制藥技術有限公司;DAB染液、蘇木素染液、伊紅染液購自北京索萊寶;所有抗體購自ABCAM;Transwell小室購自北京明陽科華生物科技有限公司;Anexin-V-FITC染液、PI染液購自上海碧云天;流式細胞儀購自德國貝克曼;倒置顯微鏡購自奧林巴斯;實時熒光定量PCR儀購自賽默飛世爾;PCR引物序列由華大基因合成。
1.1.2組織來源 收集我院2017年5月至2018年10月通過外科手術切除的口腔鱗癌組織52例,術前均未進行放化療及免疫治療,其中男性38例,女性14例,年齡22~72歲,平均年齡 (42.2±7.3) 歲。其中高分化鱗癌28例,中分化鱗癌13例,低分化鱗癌11例。淋巴結轉移36例,無淋巴結轉移16例。以52例正常的口腔黏膜上皮組織作為對照,其中男性31例,女性21例,年齡24~68歲,平均年齡(40.3±6.9)歲。本研究經我院倫理委員會審批且所有患者知情同意。
1.2方法
1.2.1免疫組化檢測 將癌組織及正常黏膜上皮組織以石蠟包埋后切片。60℃溫箱烤干,二甲苯脫蠟,梯度酒精脫水,雙氧水和蒸餾水洗滌,微波抗原修復。切片冷卻后PBS沖洗,5% BSA室溫封閉,加入一抗兔抗小鼠PAK2孵育1 h,加入二抗山羊抗兔IgG孵育20 min,PBS沖洗,DAB顯色,蘇木素復染,自來水沖洗。梯度酒精脫水,中性樹膠封固。倒置顯微鏡觀察組織染色情況。Image J軟件統計癌組織及正常黏膜組織的PAK2陽性表達率。
1.2.2PAK2沉默重組質粒構建 UCSC獲取人PAK2編碼區序列(NM_002577),BLOCK-iTTMRNAi Designer網站在線設計PAK2的shRNA序列(5′-CACCGTCTGATAACGGAGAACTGGACGAATCCAGTT-CTCCGTTATCAGAC-3′)。在shRNA序列兩端加上EcoRⅠ 和BamHⅠ 酶切位點。T4DNA連接酶將酶切后的pcDNA3.1(+)質粒線性化載體與目的基因片段連接并過夜,轉化至DH5α大腸桿菌克隆。酶切電泳鑒定后提取大腸桿菌中重組載體,-80℃保存備用。
1.2.3細胞分組及轉染 人舌鱗癌細胞株HSC-4、Tca8113、TcaSll3及人頰鱗癌細胞株BcaCD885培養于含10%FBS及1%P/S的MEM培養基中,Western blot篩選PAK2蛋白表達最高的細胞系用于后續實驗并分為:陰性對照組(轉染含有無關序列的重組質粒)、miR-411-3p agomir組(轉染miR-411-3p agomir)、miR-411-3p antagomir組(轉染miR-411-3p antagomir)、基因沉默組(轉染含有PAK2 shRNA的重組質粒)及聯合組(miR-411-3p agomir聯合PAK2沉默處理細胞)。
傳代后取對數期細胞,待細胞生長至70%~90%融合度進行轉染,Opti-MEM培養基調整細胞密度至3×105個/ml并接種于24孔板。將50 μl Opti-MEM分別與1.5 μl Lipofectamine 3000及1 μg PAK2 shRNA重組質粒(濃度為2 μg/μl)混勻,以1∶1 充分混勻并于室溫孵育5 min。將DNA-脂質體復合物加至含有口腔鱗癌細胞的24孔板,輕柔搖晃,培養24~48 h后更換培養基。miR-411 agomir、miR-411 antagomir及陰性對照的轉染方式同上。
1.2.4qRT-PCR檢測 按Trizol試劑說明書提取口腔鱗癌細胞系總RNA。DEPC處理的超純水溶解RNA,TransScriptⅡGreen One-Step qRT-PCR Super Mix試劑盒一步完成RT-PCR合成及PCR。反應體系和反應條件均依據試劑盒說明書操作。實時熒光定量PCR儀進行擴增,miR-411-3p以U6為內參,其他檢測因子以GAPDH為內參,引物序列見表1。2-ΔΔCt法計算相對表達量。

表1 qRT-PCR引物
1.2.5Western blot檢測蛋白表達 棄細胞培養液,PBS洗滌,RIPA裂解液裂解細胞,勻漿,離心后去上清,去離子水調整蛋白濃度,行SDS-PAGE凝膠電泳并將細胞轉至PVDF膜。加入含5% BSA的TBST,室溫封閉1 h。加入一抗兔抗鼠Wnt1、GSK3β、β-catenin、E-cadherin、N-cadherin抗體,4℃過夜。加入二抗山羊抗兔IgG,4℃孵育,取化學發光試劑A液與B液按1∶1混勻后,均勻滴加至NC膜,顯影液顯影。分析條帶光密度,蛋白質相對表達量為目標條帶與內參條帶的灰度值比值。
1.2.6CCK8測定細胞活力 將細胞懸液(約1×105個)加入96孔板,設置陰性對照,37℃、5%CO2培養過夜。加入CCK8溶液,檢測0、24、48 h吸光度(450 nm)。
1.2.7細胞劃痕實驗 實驗前用marker筆對12孔板做背面標記,0.25%胰酶消化細胞,將細胞接種于12孔板。待細胞鋪滿板底后,1 ml槍頭垂直于孔板劃痕。去除細胞培養液,PBS沖洗,加入無血清MEM培養基,放入培養箱,48 h后拍照并統計細胞遷移率。
1.2.8Transwell細胞侵襲實驗 按1∶10比例采用MEM培養基稀釋Matrigel膠,后將100 μl Matrigel膠加入上室。DMEM培養基重懸細胞,調整至3×105個/ml,取100 μl細胞加入上室,下室加入600 μl 含10%血清的DMEM培養基,依據Transwell說明書進行結晶紫染色。染色結束后于光鏡下選取3個視野對跨膜細胞進行計數,計算侵襲細胞數目。
1.2.9Annexin V-FITC/PI雙染檢測口腔鱗癌細胞凋亡 取轉染后細胞,PBS沖洗,離心后棄上清,調整細胞濃度為4×105個/ml,加入500 μl結合緩沖液,加入5 μl Anexin-V-FITC及5 μl PI染液混勻,避光孵育10 min。流式細胞儀檢測凋亡情況,激發波長488 nm,530 nm處檢測FITC,575 nm檢測PI,統計細胞凋亡情況。

2 結果
2.1miR-411-3p與PAK2存在靶向結合關系 與NC組相比,PAK2野生型3′UTR熒光素酶活性被miR-411-3p顯著抑制,而突變型3′UTR熒光素酶活性未被抑制。說明miR-411-3p可靶向抑制PAK2基因表達(圖1)。

圖1 miR-411-3p與PAK2靶向調控關系驗證
2.2正常組織口腔鱗癌組織中miR-411-3p、PAK2表達 PAK2蛋白在胞漿和核內表達存在差異(圖2)。與癌旁組織[(15.34±1.71)%]相比,癌組織中PAK2細胞陽性率[(73.12±6.29)%]上調。與正常口腔黏膜上皮組織相比,癌組織miR-411-3p表達顯著下降,PAK2表達顯著上升(P<0.05)。
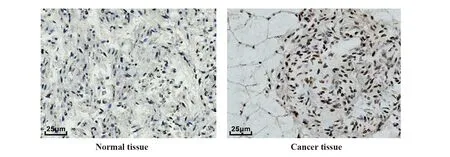
圖2 各組miR-411-3p及PAK2表達情況
2.3過表達miR-411-3p或沉默PAK2對上皮間質轉化的影響 qRT-PCR及Western blot檢測結果顯示,與陰性對照組相比,miR-411-3p過表達或沉默PAK2可抑制Wnt信號通路相關因子(Wnt1,β-catenin)及N-cadherin表達,促進E-cadherin及GSK3β表達,且聯合組效果更為顯著(P<0.05),抑制miR-411-3p表達則效果相反,見圖3。

圖3 過表達miR-411-3p或沉默PAK2對上皮間質轉化的影響
2.4各組細胞活力檢測結果 CCK8檢測各組細胞生長活力情況顯示,與陰性對照組相比,上調miR-411-3p表達或抑制PAK2表達可抑制口腔鱗狀細胞癌細胞的生長活力且聯合處理效果更為顯著(P<0.05)。抑制miR-411-3p表達可顯著提高口腔鱗狀細胞癌細胞活力(P<0.05),見圖4。
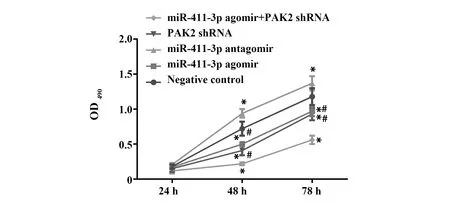
圖4 各組細胞活力檢測結果
2.5各組細胞劃痕愈合情況檢測 與陰性對照組相比,miR-411-3p agomir組及PAK2 shRNA組劃痕愈合率顯著下降,且聯合組效果更為明顯(P<0.05),miR-411-3p antagomir組細胞劃痕愈合率顯著上升(P<0.05),見圖5。
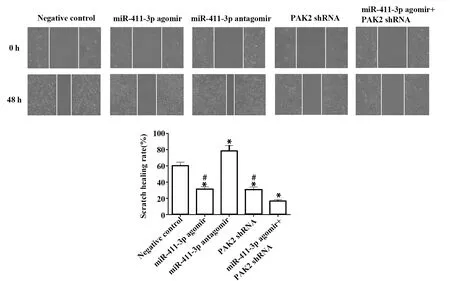
圖5 各組細胞劃痕檢測結果
2.6各組細胞侵襲情況檢測結果 與陰性對照組相比,miR-411-3p agomir組及PAK2 shRNA組細胞侵襲明顯減少,且聯合組效果更顯著(P<0.05),miR-411-3p antagomir組細胞侵襲為顯著增加(P<0.05),見圖6。
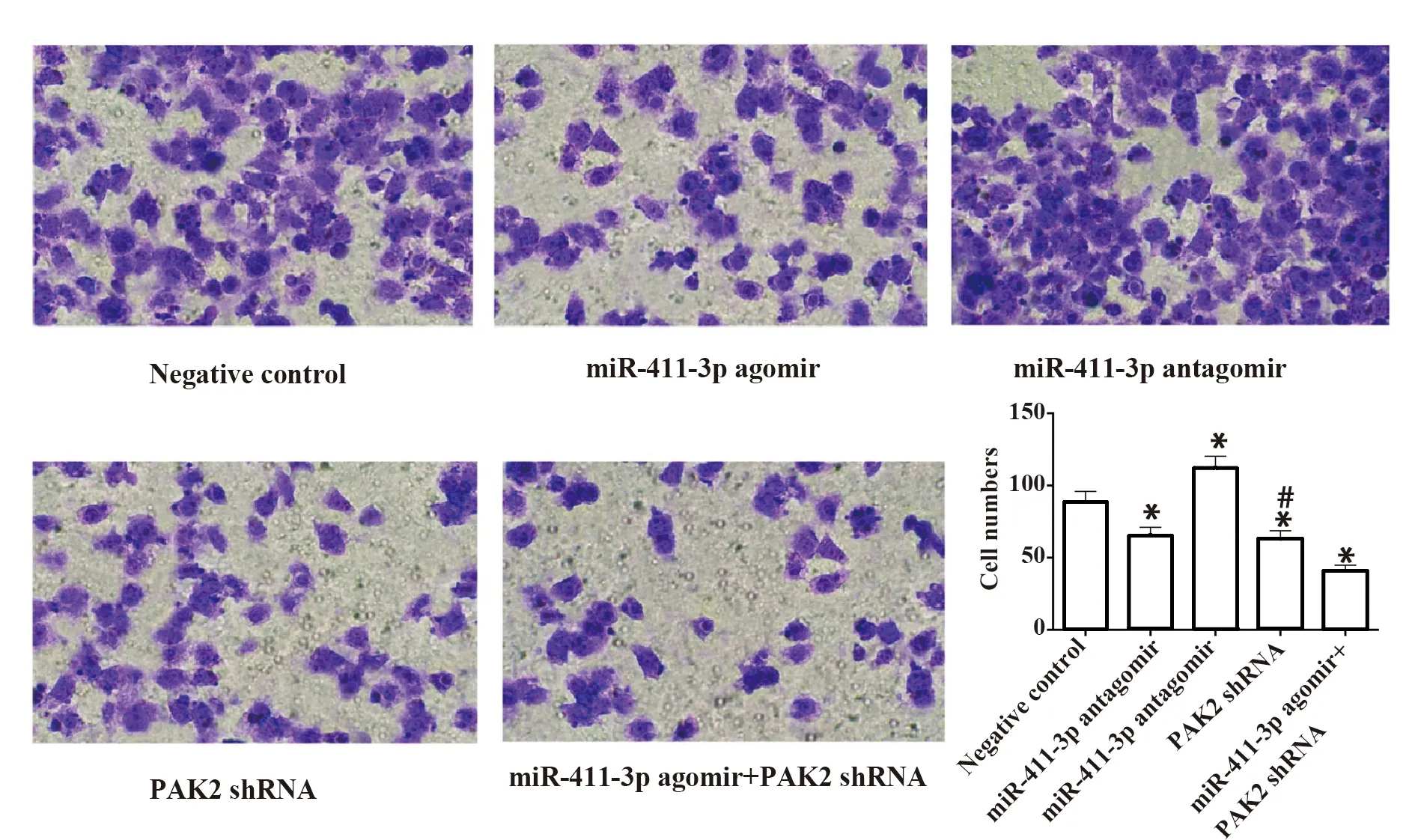
圖6 各組細胞Transwell檢測結果
2.7各組細胞凋亡情況檢測結果 與陰性對照組相比,miR-411-3p agomir組及PAK2 shRNA組細胞凋亡明顯著增加,且聯合組效果更為明顯(P<0.05),miR-411-3p antagomir組細胞凋亡顯著減少(P<0.05),見圖7。
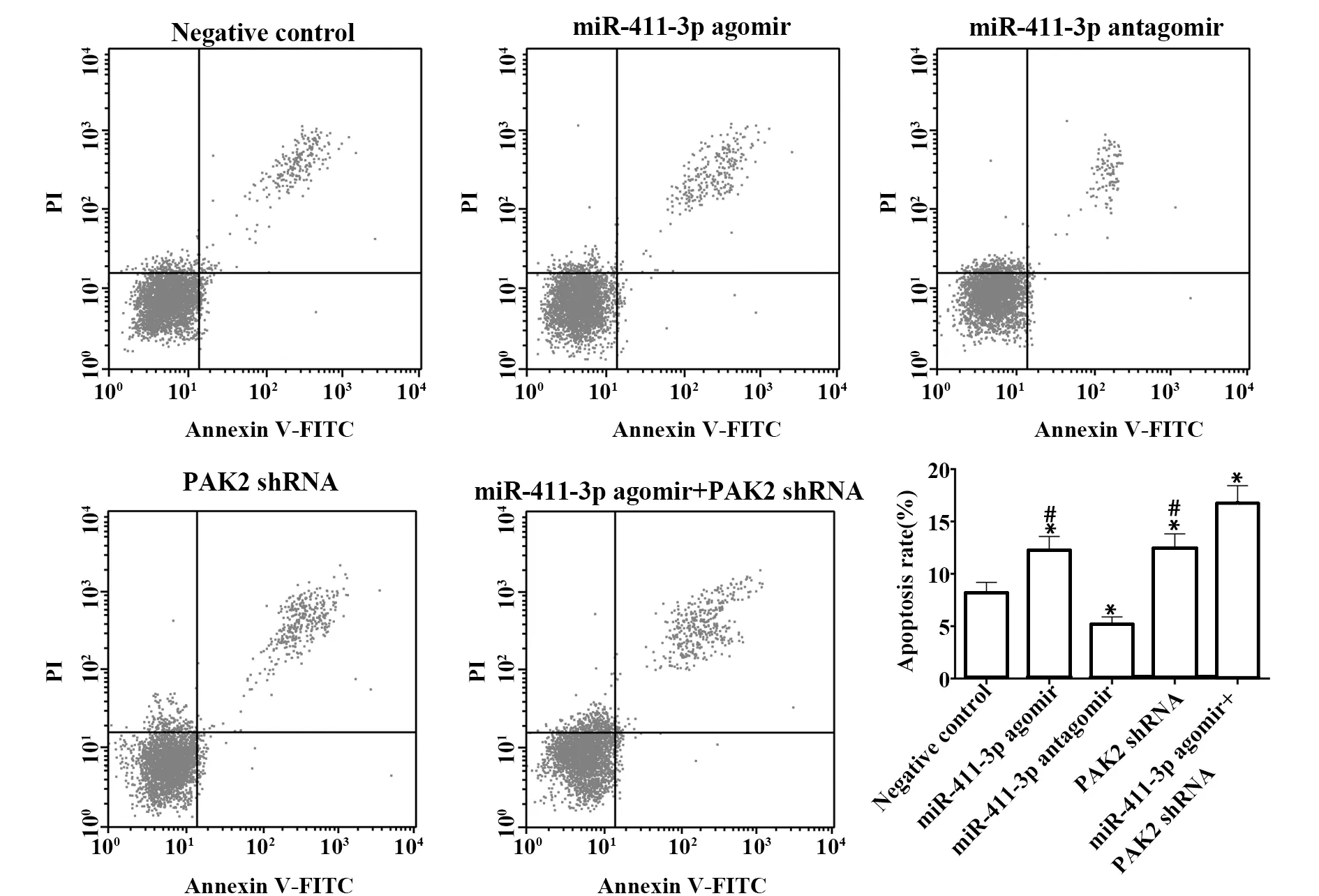
圖7 各組細胞凋亡情況
3 討論
口腔鱗狀細胞癌是指不同程度鱗狀分化、合并上皮侵襲性的腫瘤,也是口腔惡性腫瘤中最為常見的類型[11]。盡管近年來針對該病的治療取得了一定進展,但患者的5年生存率仍然較低,尤其是晚期合并遠處轉移的患者,常規手術、放化療等治療方式效果均不理想[12]。本研究從基因靶向治療的角度出發,探討miR-411-3p對口腔鱗癌細胞侵襲轉移的影響及其作用機制,發現miR-411-3p可靶向PAK2基因介導Wnt信號通路進而調控口腔鱗癌細胞的生物學特性。
研究證實PAK2活性在多種腫瘤細胞中顯著升高,且PAK2高表達與腫瘤的預后不良有關。Zhang等[5]預后研究發現PAK2高表達與藥物治療管腔性乳腺癌不良相關。抑制PAK2表達可抑制皮膚黑色素瘤細胞增殖[13]。下調PAK2表達可抑制卵巢癌細胞系遷移和侵襲能力[14]。關于口腔鱗癌的研究也證實PAK2在口腔鱗癌組織中表達顯著上升且與腫瘤分級相關[7]。本研究通過免疫組化、qRT-PCR及Western blot檢測發現,相對于正常口腔黏膜組織,癌組織中PAK2表達顯著上升,與既往研究結論一致。本研究證實miR-411-3p是PAK2的靶向miRNA,在口腔鱗癌中表達顯著下降。既往研究證實miR-411在多種癌癥中均發揮抑癌因子作用。Bai等[15]在關于胃癌的研究中發現,miR-411能夠抑制胃癌細胞增殖和遷移。miR-411能夠延緩膀胱癌進展[16,17]。miR-411在卵巢癌和宮頸癌中可抑制腫瘤細胞增殖,延緩癌癥進展[18,19]。
本研究在前人研究的基礎上進一步發現miR-411-3p在口腔鱗癌細胞中同樣發揮抑癌因子作用,通過抑制PAK2基因及激活Wnt信號通路發揮作用。Wnt信號通路的異常激活是腫瘤發生的重要因素,β-catenin大量積聚是引發Wnt通路激活及腫瘤發生的關鍵原因[20]。糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)在Wnt通路中起調控開關作用,能夠促進β-catenin磷酸化及轉錄過程調控[21]。研究證實口腔鱗癌中GSK-3β失活,在口腔鱗癌、鼻咽癌等惡性腫瘤中均發揮抑癌因子作用[22]。本研究發現,相對于陰性對照組,激活miR-411-3p或沉默PAK2表達可促進GSK3β表達,抑制Wnt通路激活,延緩口腔鱗癌進展。上皮間質轉化在惡性腫瘤浸潤轉移中的作用備受關注。上皮間質轉化主要表現為間質表型神經性鈣黏蛋白N-cadherin表達上升及上皮表型鈣黏蛋白E-cadherin丟失,在包括口腔癌在內的多種惡性腫瘤中均發現E-cadherin表達降低、N-cadherin表達增高[23]。本研究發現激活miR-411-3p或沉默PAK2后E-cadherin表達上調,N-cadherin表達降低,表明過表達miR-411-3p或沉默PAK2可減少口腔鱗癌上皮間質轉化。進一步通過MTT、劃痕愈合實驗、Transwell實驗等對各組細胞的增殖活性、遷移和侵襲能力進行檢測發現,抑制miR-411-3p能夠顯著增強細胞活力及遷移和侵襲能力,而激活miR-411-3p或沉默PAK2表達則能夠顯著抑制細胞活力,減少癌細胞遷移和侵襲。流式細胞術進一步證實過表達miR-411-3p及沉默PAK2在促進癌細胞凋亡中的重要價值。
綜上所述,本研究發現miR-411-3p能夠靶向抑制PAK2表達,通過影響Wnt信號通路的活性調控口腔鱗狀細胞癌的生物學特性進行調控。過表達miR-411-3p能夠顯著抑制口腔鱗癌細胞增殖、侵襲和轉移,促進癌細胞凋亡,miR-411-3p有望成為口腔鱗狀細胞癌靶向治療的重要分子靶點。