碳酸鈣晶型的二十二酸調控研究
白春華,王倩倩,李光輝,侯歡健,王觀
(1.內蒙古科技大學 礦業研究院,內蒙古 包頭 014010;2.內蒙古科技大學 礦物加工工程系,內蒙古 包頭 014010)
碳酸鈣是自然界中最豐富的無機礦物之一,具有方解石、球霰石、文石三種晶型[1],碳酸鈣成本低廉,環境友好,具有良好的生物相容性能,被廣泛應用到紙張、油漆、塑料、橡膠[2]、藥物載體[3]等方面。由于碳酸鈣礦物表面具有豐富的 —OH,表現為親水疏油,在有機基質中難以分散。碳酸礦物表面能高,表面原子活潑,在制備和使用中容易團聚。所以要對碳酸酸鈣進行表面改性,使它應用到各個領域[4-10]。
在碳酸鈣晶型的肉豆蔻酸調控研究中,加入碳鏈長度為十四的肉豆蔻酸對碳酸鈣的晶型和表面性質產生了影響。本文通過復分解法,以CaCl2和Na2CO3為原料,二十二酸為表面改性劑,對碳酸鈣的晶型和表面性質進行調控,制備疏水性接近100%的球霰石型碳酸鈣粉體,并研究了其表面特性和改性機理。
1 實驗部分
1.1 試劑與儀器
氯化鈣、碳酸鈉、二十二酸、四氫呋喃均為分析純;蒸餾水。
D/max 2500 PC X射線衍射儀(XRD);Vector22 型傅里葉紅外光譜儀(FTIR);XL30型掃描電子顯微鏡(SEM);BT-9300H激光粒度分析儀。
1.2 實驗方法
1.2.1 空白組(碳酸鈣) 分別稱取氯化鈣 5.549 5 g 與碳酸鈉5.299 5 g(摩爾比為1∶1),加入到2個燒杯中,每個燒杯中各加入蒸餾水 100 mL,將氯化鈣溶液倒入500 mL單口燒瓶中,在室溫攪拌(攪拌速率500 r/min)。將碳酸鈉溶液以1~2滴/min的速率滴加至氯化鈣溶液中,碳酸鈉滴加完畢后,攪拌12 h。抽濾,用蒸餾水洗滌(50 mL×2),110 ℃常壓干燥48 h,樣品裝袋密封保存。
1.2.2 二十二酸調控碳酸鈣 分別稱取氯化鈣5.549 5 g與碳酸鈉5.299 5 g(摩爾比為1∶1),加入到2個燒杯中,每個燒杯中加入蒸餾水100 mL。將0.510 87 g二十二酸放在另一個燒杯中,加入四氫呋喃20 mL(四氫呋喃對碳酸鈣的晶型和表面性質沒有影響),使用超聲清洗器超聲溶解。將氯化鈣溶液倒入500 mL單口燒瓶中,在室溫攪拌(攪拌速率500 r/min),緩慢加入二十二酸溶液,加入后繼續攪拌混勻。以1~2滴/min的速率滴加碳酸鈉溶液,滴加完畢后,攪拌12 h。抽濾,用蒸餾水洗滌(50 mL×2),110 ℃常壓干燥48 h,樣品裝袋密封保存。
2 結果與討論
2.1 粒度表征
空白組和調控組的粒度分析見表1。

表1 空白組與對照組粒度分析Table 1 Particle size analysis of blank group and control group
由表1可知,空白碳酸鈣的粒度D3、D10、D50分別為0.473,0.916,6.955 μm,加入二十二酸碳酸鈣的粒度在D3、D10、D50分別為 0.492,1.125,10.900 μm,可知添加二十二酸對碳酸鈣粒度影響不大。
2.2 SEM
空白組(a)、(b)和調控組(c)、(d)的SEM分析見圖1。

圖1 空白組與調控組SEM圖Fig.1 SEM images of blank group and control group
由圖1a、1b可知,空白組碳酸鈣為不規則的長方形,團聚現象比較嚴重,顆粒不規則,可以判斷為方解石碳酸鈣。由圖1c、1d可知,加入二十二酸之后,形狀由長方形變成球形,團聚現象有所減輕,結構比較穩定,可以判斷為球霰型碳酸鈣。表明二十二酸的參與可以改變碳酸鈣的形貌,由方解石變為球霰石。
將空白碳酸鈣和調控組分別放入蒸餾水中,靜置1 h后,碳酸鈣表面的活化程度見圖2。

圖2 空白組(a)與調控組(b)的活化度Fig.2 Activation grade of blank group and control group
由圖2可知,碳酸鈣的活化度為0,幾乎全部沉入水底,表明空白碳酸鈣表面有很強的親水性;添加二十二酸碳酸鈣活化度為89.53%,幾乎全部漂浮在水面,表明加入二十二酸碳酸鈣表面有很好的疏水性,而這個疏水性來自于吸附在碳酸鈣表面的烷基鏈,而且是二十二酸中的羧基與碳酸鈣表面的羥基結合,烷基鏈朝向碳酸鈣表面外側,因而碳酸鈣表面由親水變為疏水。同時,加入二十二酸碳酸鈣在水面的穩定漂浮間接地表明它的穩定性好,暗示了二十二酸化學吸附在碳酸鈣表面。
2.3 TG
空白組和調控組的熱失重分析見圖3。
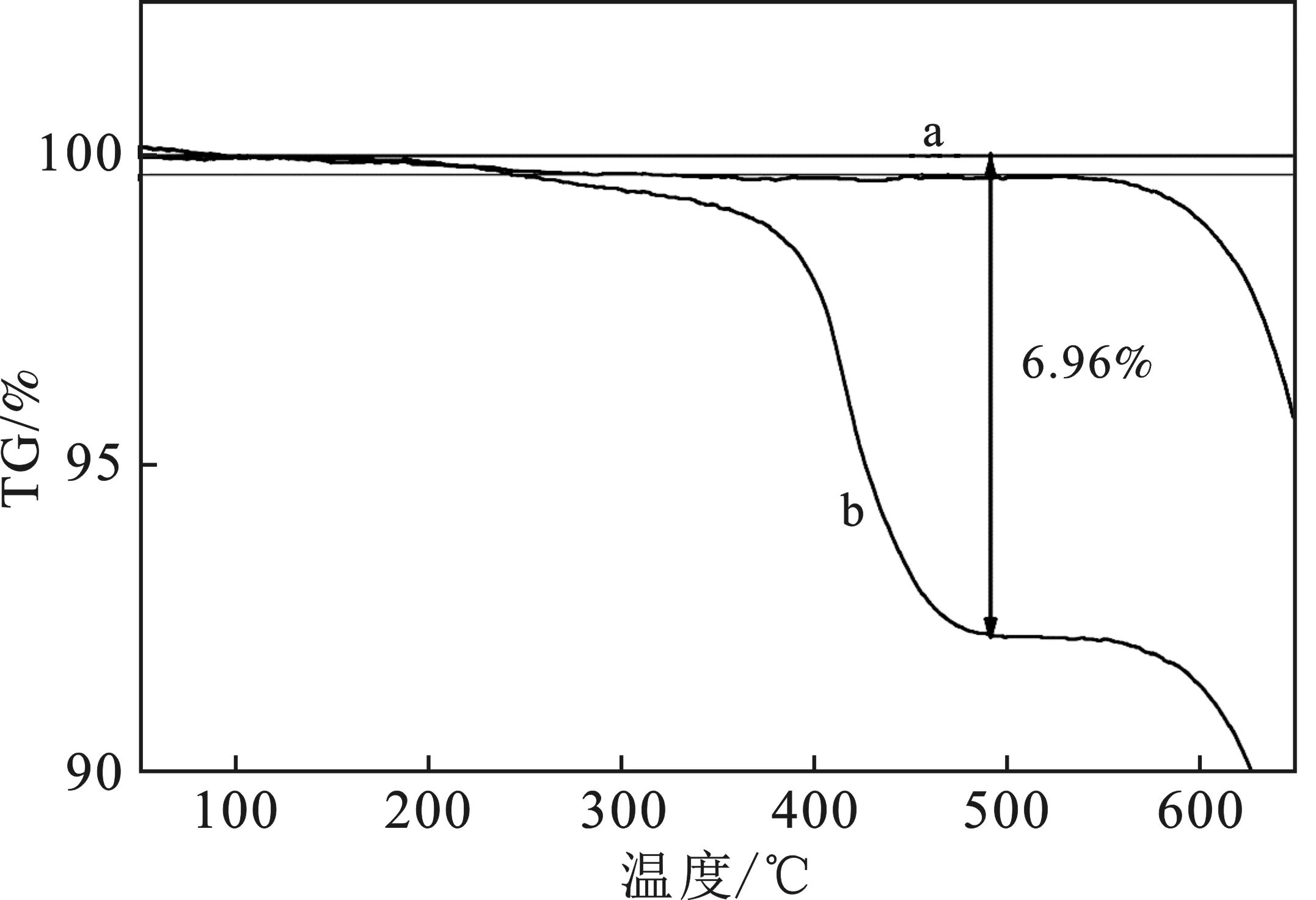
圖3 空白組(a)與調控組(b)TG圖Fig.3 TG chart of blank group and control group
由圖3可知,調控組在25~250 ℃的重量與空白組的重量基本保持一致,但從250~550 ℃重量開始失重,失重率為6.96%,表明碳酸鈣表面有二十二酸,發生了吸附反應,當溫度>550 ℃以后,空白組和調控組重量呈明顯下降趨勢,表明碳酸鈣開始分解。綜上所述,二十二酸成功吸附在碳酸鈣表面。
2.4 XRD表征
空白組和調控組的X射線衍射分析見圖4。
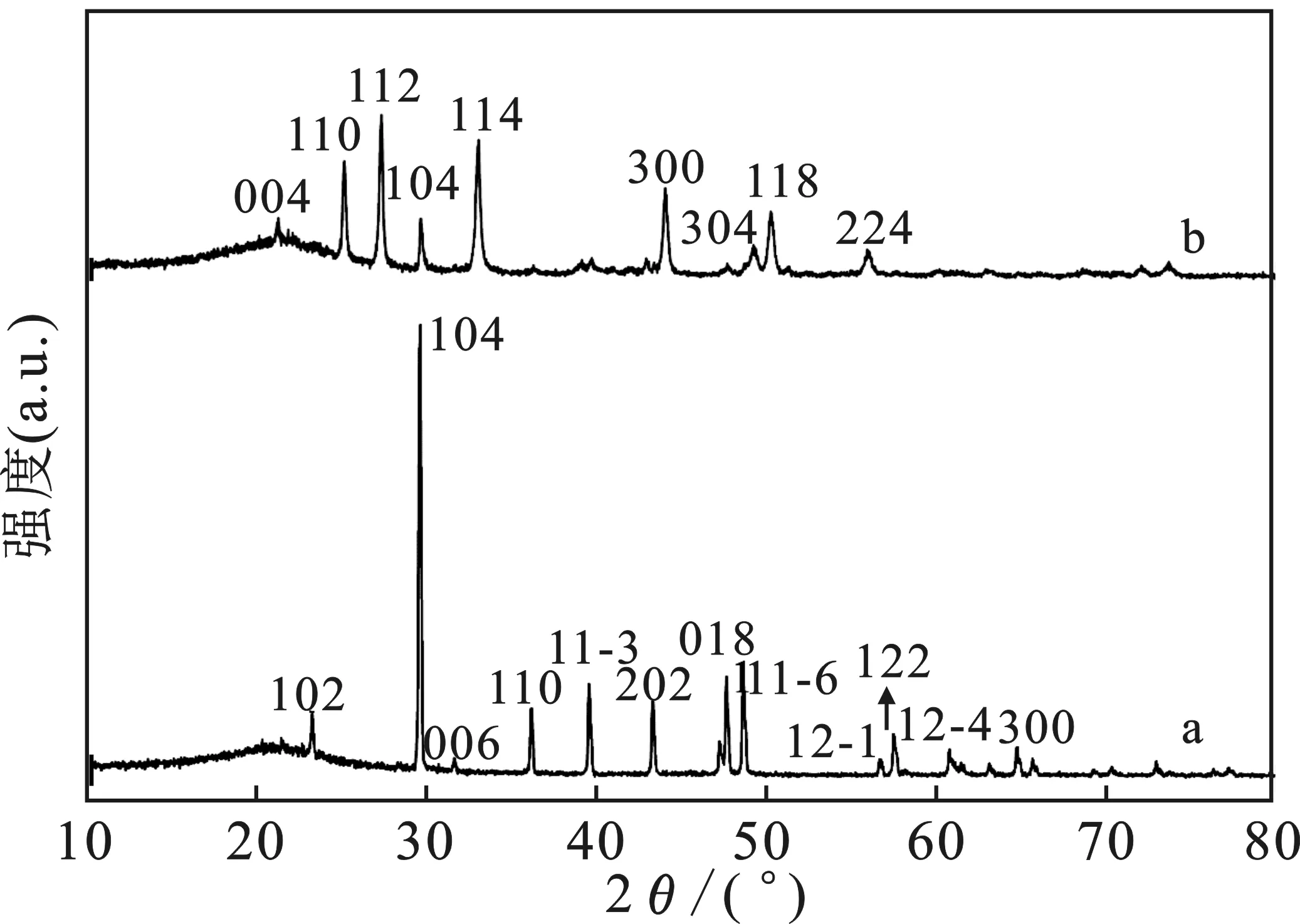
圖4 空白組(a)與調控組(b)XRD圖Fig.4 XRD pattern of blank group and control group
由圖4可知,空白組在(102)、(104)、(006)、(110)、(11-3)、(202)、(018)、(11-6)、(12-1)、(122)、(124)、(300)為方解石的晶面,并且在(104)晶面強度最強;調控組在(004)、(110)、(112)、(114)、(300)、(304)、(118)、(224)為球霰石晶面,(104)為方解石晶面,但強度明顯減弱,表明二十二酸的加入改變了碳酸鈣的晶型,由原來的方解石型晶面變成球霰石型晶面。
2.5 FTIR表征
空白組和調控組FTIR分析見圖5。
由圖5可知,空白組在713,875 cm-1屬于方解石型CaCO3粒子的特征吸收峰;調控組713 cm-1處的吸收峰明顯減弱,875 cm-1處的吸收峰由窄變寬,并且出現744 cm-1屬于球霰石型CaCO3粒子的特征吸收峰,表明添加二十二酸對碳酸鈣的晶型有調控作用,由方解石型碳酸鈣變成球霰石型碳酸鈣;在 2 921,2 851 cm-1處出現了亞甲基的對稱吸收峰和不對稱吸收峰,說明碳酸鈣的表面羥基與二十二酸當中的 —COOH發生了反應,形成了烷基羧酸鈣的絡合物。總之,添加二十二酸對碳酸鈣的晶型具有調控作用,由原來方解石型碳酸鈣變成球霰石型碳酸鈣,并且二十二酸與碳酸鈣發生了化學吸附。
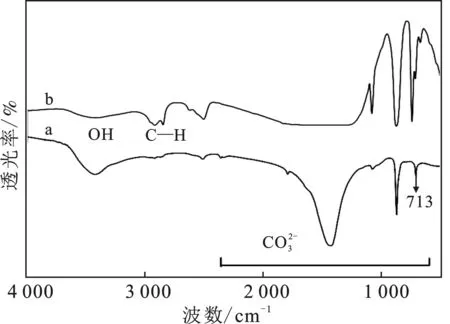
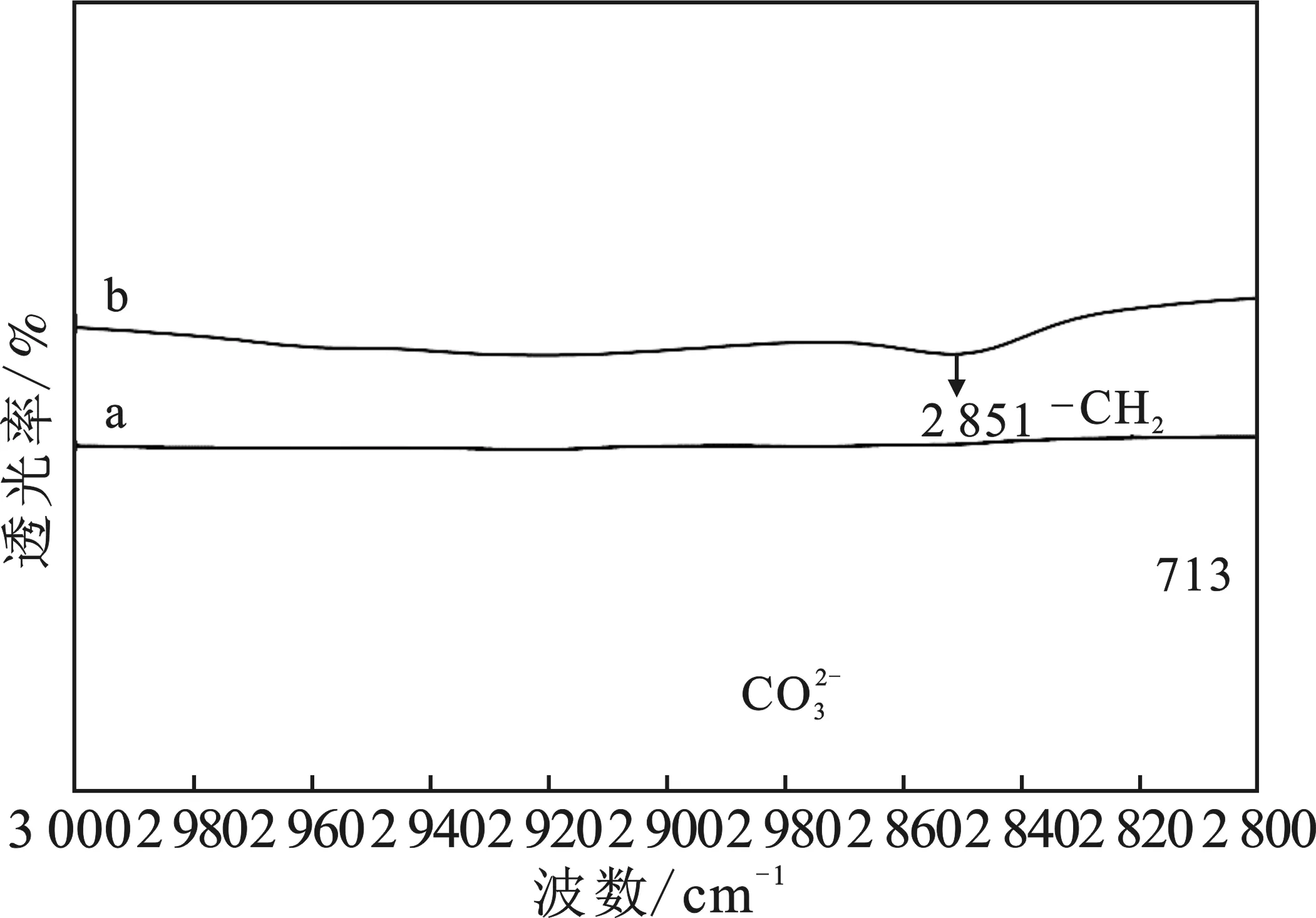
圖5 空白組(a)與調控組(b)FTIR圖Fig.5 FTIR chart of blank group and control group
2.6 表面改性機理分析
加入二十二酸碳酸鈣表面改性機理分析見圖6。
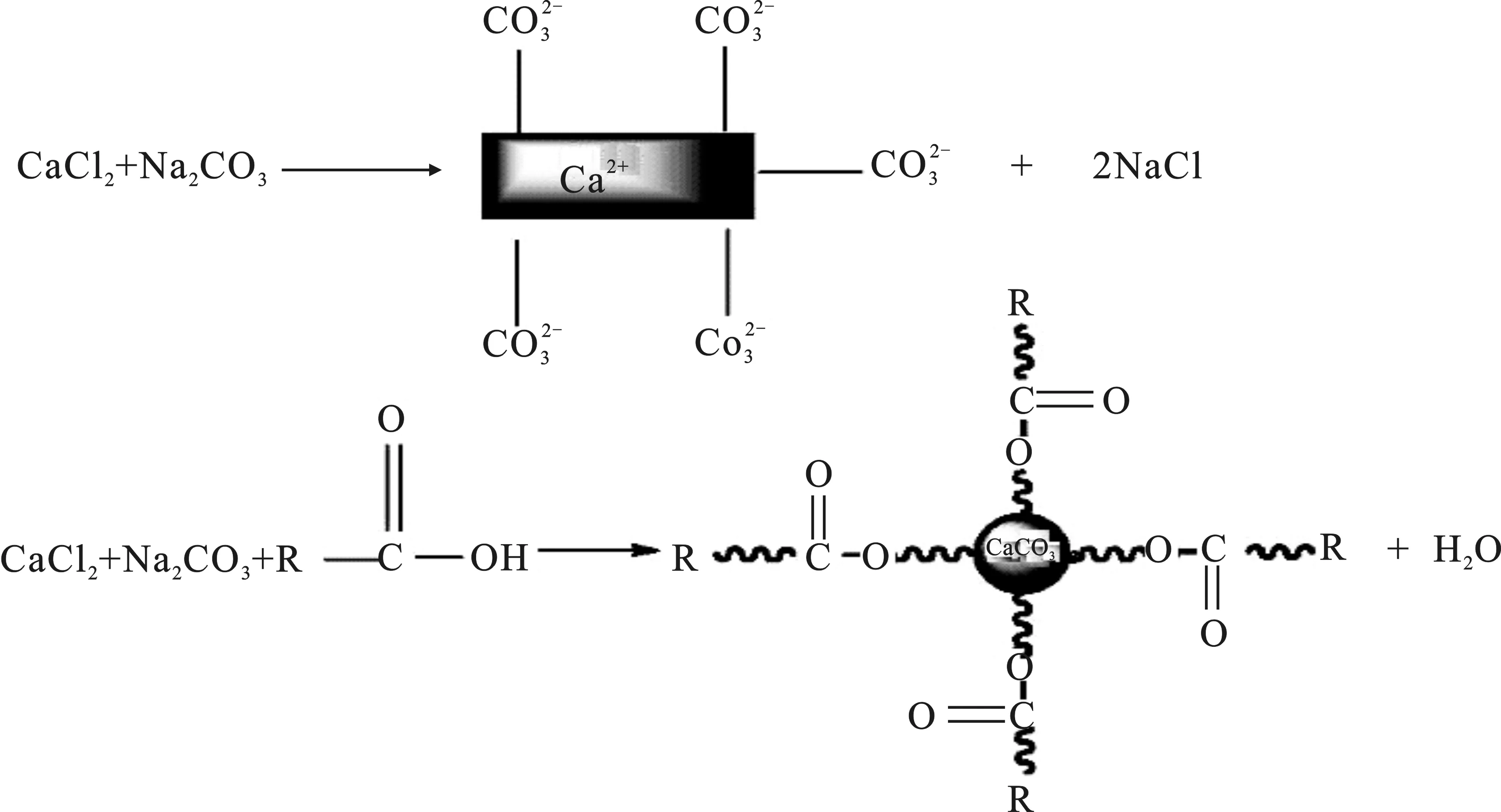
圖6 二十二酸對碳酸鈣表面特性的調控示意圖Fig.6 Schematic diagram of the regulation of behenic acid on the surface characteristics of calcium carbonate
由圖6可知,空白碳酸鈣的晶體結構為方解石型,加入二十二酸之后變成球霰石型,這表明:①在制備沉淀碳酸鈣的過程中,加入二十二酸,同時調控了沉淀碳酸鈣的晶體結構,由原來的方解石型碳酸鈣變成球霰石型碳酸鈣,晶體的形貌也發生了變化,由長方形變成不規則球形;②二十二酸的羧基和碳酸鈣表面的Ca2+發生了化學結合反應,穩定地吸附在碳酸鈣的表面,使富羥基的碳酸鈣表面由親水變為疏水,從而大大削弱碳酸鈣顆粒的團聚。
3 結論
由氯化鈣和碳酸鈉的復分解反應制備碳酸鈣,通過加入二十二酸對碳酸鈣的晶體結構和表面性質進行調控,加入二十二的碳酸鈣晶體由方解石型碳酸鈣變成球霰石型碳酸鈣,表面形貌由長方形變成不規則的球形,碳酸鈣由親水變為疏水,表面團聚現象減輕,結構也變得越來越穩固。

