例談化學題中各類信息的挖掘與利用
東國花
(青海省海東市互助縣第一中學 810599)
一、根據題干文字和表格信息發掘隱蔽條件
例1 已知常溫下濃度為0.1mol·L-1的下列溶液的pH見下表:

溶質NaFNaClONaHCO3Na2CO3pH7.59.78.211.6
下列有關說法不正確的是( ).
B.加熱0.1mol·L-1NaClO溶液測其pH大于9.7
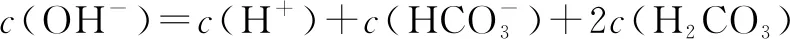
D.pH=2的HF溶液與pH=12的NaOH溶液以體積比1∶1混合,則有:c(Na+)>c(F-)>c(H+)>c(OH-)

點評本題通過題干所提供的信息,考查了學生對鹽類水解規律的運用和影響水解平衡的幾個因素,如,溫度、濃度等等.同時,又考查離子濃度大小比較規律和溶液中三個守恒的運用,這也是教學重點、難點之一.
二、依據實驗裝置圖及現象描述發掘隱蔽條件
例2 驗證犧牲陽極的陰極保護法,實驗如下(燒杯內均為經過酸化的3% NaCl溶液).
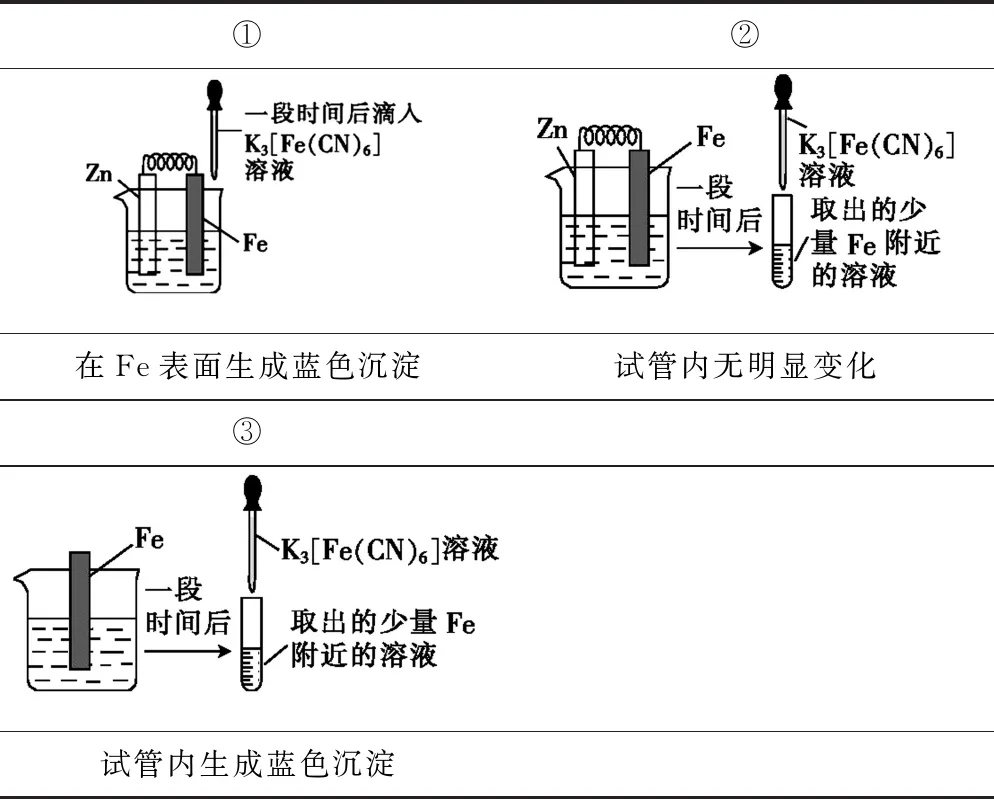
①②在Fe表面生成藍色沉淀試管內無明顯變化③試管內生成藍色沉淀
下列說法不正確的是( ).
A.對比②③,可以判定Zn保護了Fe
B.對比①②,K3[Fe(CN)6]可能將Fe氧化
C.驗證Zn保護Fe時不能用①的方法
D.將Zn換成Cu,用①的方法可判斷Fe比Cu活潑
解析從題干信息和結合實驗裝置及現象進行對比分析:對比①②得出K3[Fe(CN)6]可能將Fe氧化為Fe2+;對比②③,Zn、Fe為電極的原電池中Fe為正極,受到了保護,故A、B、C項均正確;D中將Zn換成Cu,因K3[Fe(CN)6]可能將Fe直接氧化成Fe2+,也有藍色沉淀生成,故不能用①的方法證明Fe比Cu活潑,D項錯誤.
點評本題考察了學生對原電池形成的條件和金屬的防護等方面的知識,雖說該題難度不太大,但學生對實驗現象理解不夠深入,對隱含化學反應原理認識不清楚、不到位,會導致判斷失誤的.
三、解讀表格中相關信息發掘隱蔽條件

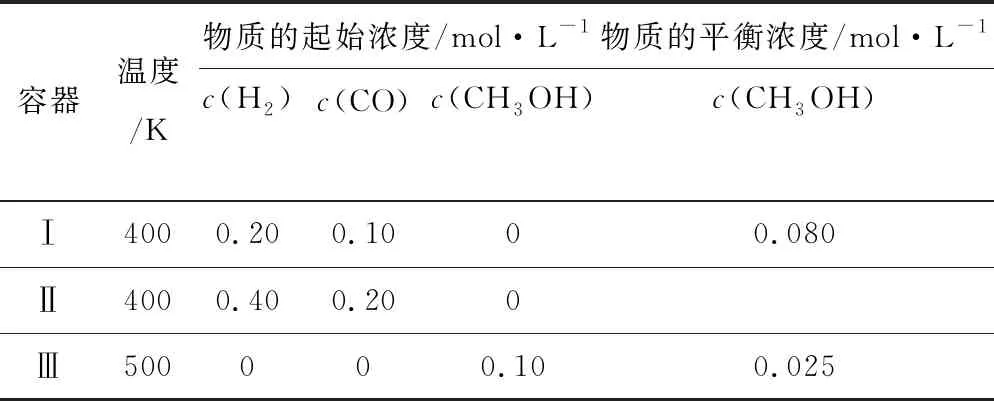
容器溫度/K物質的起始濃度/mol·L-1物質的平衡濃度/mol·L-1c(H2)c(CO)c(CH3OH)c(CH3OH)Ⅰ4000.200.1000.080Ⅱ4000.400.200Ⅲ500000.100.025
①該反應的正反應放熱
②達到平衡時,容器Ⅰ中反應物轉化率比容器Ⅱ中的大
③達到平衡時,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的兩倍
④達到平衡時,容器Ⅲ中的反應速率比容器Ⅰ中的大
A.①② B.②③ C.③④ D.①④
解析本題中關鍵信息隱藏在題干和表格中,需進行挖掘,分析:Ⅰ、Ⅲ中加料比相同,為等效平衡,若不考慮溫度的影響,達到平衡時的c(CH3OH)應相等,但實際上Ⅲ中CH3OH平衡濃度低于Ⅰ中,說明升高溫度,平衡逆移,正反應放熱,①正確;Ⅱ中的投料比是Ⅰ中的2倍,則Ⅱ中壓強比Ⅰ中大,此反應正向為氣體體積減小的反應,故平衡正移,致使達到平衡后,容器Ⅱ中反應物轉化率比容器Ⅰ中的大,②錯誤;由表中數據可知,達平衡時,求得Ⅰ中c(H2)=0.04mol·L-1,由于Ⅱ中壓強大于Ⅰ,故Ⅱ中c(H2)<0.08mol·L-1,計算出Ⅲ中c(H2)=0.15mol·L-1,③錯誤;容器Ⅰ、Ⅲ中物質的濃度等效,但Ⅲ中的溫度高,故Ⅲ中無論是正反應速率還是逆反應速率均比①中大,④正確.因此D項正確.
點評本題通過一組數據,考查學生靈活運用已學的知識來判斷影響化學平衡移動因素,形式新穎靈活,充分考查了學生分析問題與解決問題的能力,本題關鍵在于分析題干和表格的數據信息,挖掘本質問題,得出正確結論.
四、剖析概念、定義發掘隱蔽條件

A.X2為0.2 mol·L-1B.Y2為0.1 mol·L-1
C.Z2為0.4 mol·L-1D.Y2為0.6 mol·L-1
解析由于該反應為可逆反應,則反應物或生產物的濃度不可能是0,A選項中,若X2為0.2 mol/L,則需要消耗0.2 mol/L的Z2,此時生成物Z2的濃度為0,不可能,故A選項錯誤;B選項中,Y2為0.1 mol/L,反應消耗1/3×0.2 mol/L的X2,由于X2為0.1 mol/L,有可能,故B選項正確;C選項中,Z2為0.4 mol/L,需要消耗0.1 mol/L的X2、0.3 mol/L的Y2,此時反應物濃度都為0,是不可能的,故C選項錯誤;D選項中,Y2為0.6 mol/L,需要消耗0.2 mol/L的Z2,此時生成物Z2的濃度為0,不可能,故D選項錯誤.
點評本題通過剖析概念,訓練學生的思維,提高思維的含金量,讓學生深刻理解可逆反應具有一定的限度,無論反應向哪個方向進行都不會進行到底的這一特點.

