miR-186 通過負調控Smad6 對膠質瘤細胞遷移和上皮間質轉化的影響
劉 艷,許 路,邵阿末,曾金艷,楊國青
(1.無錫衛生高等職業技術學校,江蘇 無錫 214028; 2.西安市中心醫院病理科,西安 710003)
膠質瘤起源于腦神經膠質細胞,約占顱腦腫瘤的40% ~50%,該腫瘤彌漫浸潤生長、侵襲性強。 臨床上采取手術、放化療結合的方法治療,雖然取得一些進展,但預后整體不理想,復發率高、生存期短。 微小RNA( microRNA,miRNA) 是一種小分子單鏈RNA,不具有編碼功能,長為20~25 個堿基, 序列高度保守。 研究表明miRNA的表達改變與多種腫瘤的進程密切有關,它們可能具有腫瘤激活和腫瘤抑制的功能[1-2]。 miR-186 在膠質瘤中表達降低,功能實驗表明其具有抑癌作用[3]課題組前期研究表明miR-186 通過靶向調節Smad6 對腦膠質瘤細胞增殖有一定作用[4],但是否會影響到遷移和上皮間質轉化尚不清楚,本研究對此進行探討。
1 材料和方法
1.1 實驗細胞
人腦膠質瘤細胞U251 細胞株購自中國科學院北京細胞庫。
1.2 主要試劑與儀器
培養基、青霉素、鏈霉素購自HyClone 公司;轉染 試 劑 LipofectamineTM2000、 TRIzol 購 自 美 國Invitrogen 公司;DNA 聚合酶、MMLV 逆轉錄酶和緩沖體系購自Promaga 公司;dNTP 及相關引物均由北京生工生物工程有限公司合成;凝膠配置相關產品購自北京碧云天生物技術研究所; 血清購自Biological Industries 公司; E-cadherin、 Vimentin、 βactin 等抗體購自美國Abcam 公司;PDTC 為Sigma公司產品;PVDF 膜、化學發光底物ECL 來自美國Millipore 公司;HF160W 型水套式二氧化碳培養箱購自上海力申科學儀器有限公司; BioPhotometer plus 核酸蛋白測定儀購自Eppendorf 公司;電泳設備購自美國BIO-RAD 公司; FR-200A 凝膠分析系統購自上海普諾森生物科技有限公司; Lighter Cycler2.0 實時熒光定量PCR 擴增儀購自Roche 公司;PE9600PCR 擴增儀購自PE 公司。
1.3 實驗方法
1.3.1 細胞培養
人腦膠質瘤細胞系U251 用含10%胎牛血清、青-鏈霉素混合液的DMEM 培養基進行培養,放于5% CO2、37℃的培養箱內傳代培養,每天觀察細胞生長情況,及時進行換液。 選生長狀態良好的細胞作為實驗用細胞。
1.3.2 實驗分組和試劑轉染
細胞分組為對照組(U251)、模擬物組(miR-186 mimics)、質粒組( pc-Smad6) 和共轉染組( miR-186 mimics + pc-Smad6 )。 根據說明書制備miR-186 mimics 或pc-Smad6 和Lipofectamine TM2000 脂質體復合物。 實驗組加入miR-186 mimcs 和( 或) pc-Smad6 脂質體復合物。
1.3.3 基因檢測(RT-qPCR)
收集細胞,TRIzol 裂解、提取總RNA。 測定各組的總RNA 濃度,然后取適量總RNA 進行反轉錄,最后取cDNA 模板于反應體系中進行RT-qPCR。miRNA-186 上 游 引 物 5′-GCCGCCAAAGAATTCT CCTTT-3, 下 游 引 物5′-GTGCAGGGTCCGAGGT-3;Smad6 上游引物5′-CTGGAGTTGTTGAGCAGCC-3′,下游 引 物5′-GTGCGTCTTTCTTGTTTTGTCC-3′; βactin 上 游 引 物5′-CCCATGTTCGTCATGGGTGT-3′,下游引物5′-TGGTCATGAGTCCTTCCACGATA-3′擴增條件為94 ℃5 min,94 ℃30 s、56 ℃30 s、72 ℃40 s,共40 個循環。 重復3 次實驗,收集數據,計算基因的相對表達量。
1.3.4 Western blot 檢測各組細胞的蛋白
胰酶消化并收集四組細胞,PBS 清洗細胞數次,然后RIPA 裂解液裂解細胞,取上清液,BCA 法測各組蛋白濃度,每組取10 μg 蛋白進行SDS-PAGE 電泳,然后并將其轉移至PVDF 膜,用含有脫脂奶粉的TBST 封閉液封閉1 h,加入兔抗人多克隆抗體,4℃孵育過夜, TBST 洗膜3 遍,每次5 min,加入辣根過氧化物酶體HRP 標記的二抗24℃孵育2 h,TBST避光洗膜3 遍,每次15 min。 最后加發光夜于儀器中曝光拍照,計算蛋白的相對表達量。
1.3.5 劃痕實驗
將接種至6 孔板中,待細胞匯合至85%左右時,有20 μL 槍頭劃痕,PBS 洗去脫落的細胞,顯微鏡觀察并拍照,24 h 后繼續觀察顯微鏡觀察細胞的遷移情況并拍照。 計算細胞遷移率以判斷細胞的遷移能力。 實驗均重復3 次。
1.4 統計學方法
使用SPSS 20.0 軟件進行統計學處理,數據采用平均數±標準差(ˉx±s)表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,P<0.05 為差異有統計學意義。
2 結果
2.1 miR-186 和Smad6 在正常星形膠質細胞和膠質瘤細胞U251 中的表達
如圖1 所示,RT-qPCR 和Western blot 實驗結果表明,與正常星形膠質細胞相比,miR-186 在膠質瘤細胞U251 中表達明顯降低,而Smad6 的基因和蛋白表達水平均顯著增高,兩者呈反相關系。 該結果提示在膠質瘤細胞U251 中miR-186 可能發揮抑癌作用,而Smad6 則發揮的是促癌作用。
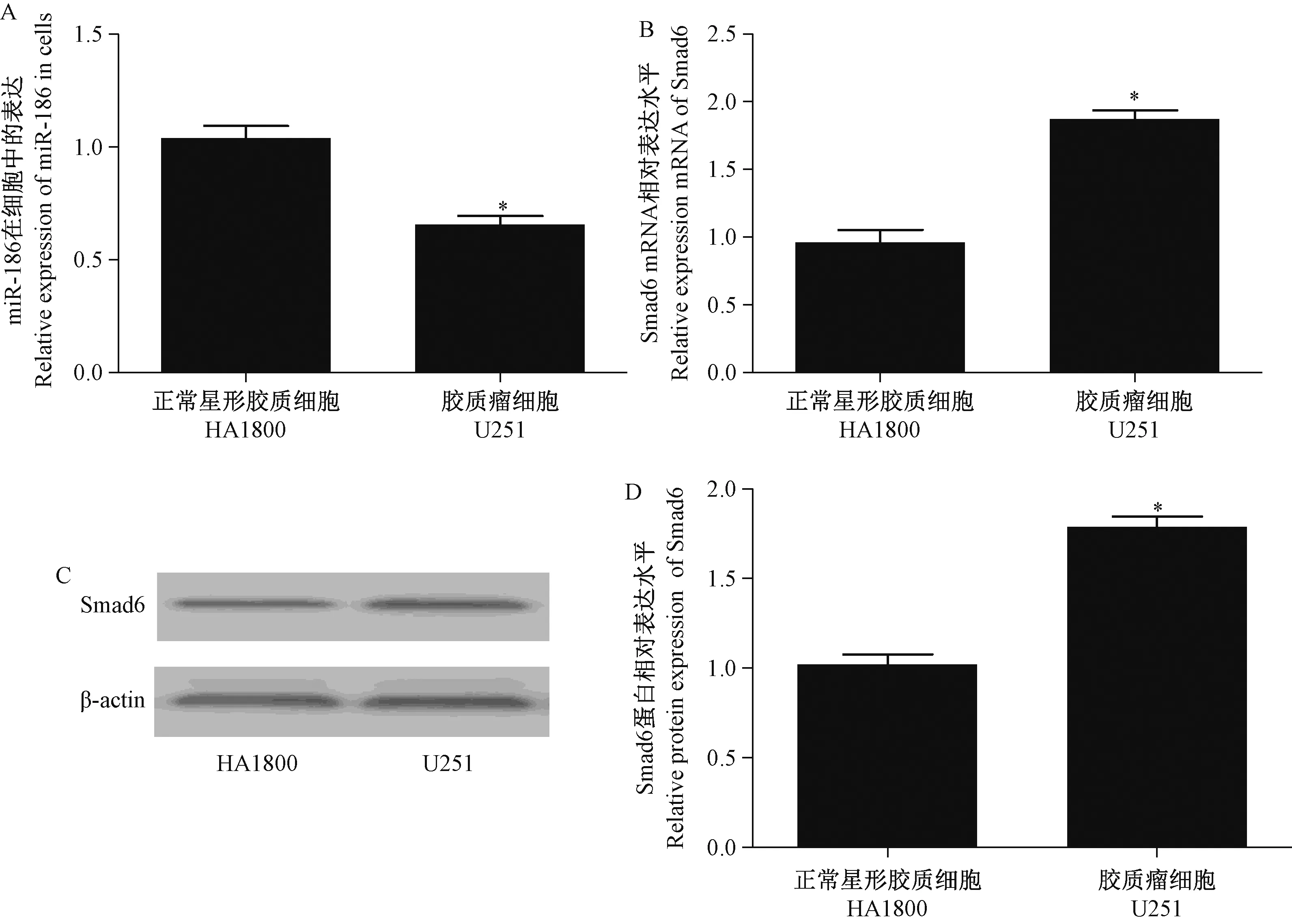
圖1 RT-qPCR 和Western blot 檢測細胞中miR-186 和Smad6 的表達Note.A/ B, Statistical analysis of gene expression.C, Protein bands.D, Statistical analysis of protein expression.Compared with normal glial cells, ?P<0.05.Figure 1 RT-qPCR and Western blot detection of miR-186 and Smad6 expression in cells
2.2 轉染miR-186 mimics 和(或)pc-Smad6 后,各組U251 細胞中Smad6 的表達變化
如圖2 所示,本實驗的RT-qPCR 和Western blot結果表明,將miR-186 mimics 轉染入膠質瘤細胞U251 后,Smad6 的表達顯著降低,而轉染Smad6 質粒后,其表達水平明顯升高。 與Smad6 質粒組相比,共轉染miR-186 mimics 和Smad6 質粒組Smad6的表達顯著降低。 該結果說明miR-186 可負向調控Smad6 的表達。
2.3 miR-186 調控Smad6 對膠質瘤細胞遷移的影響
圖3 遷移實驗顯示, 與空白組相比, miR-186 mimics 組U251 細胞的遷移率明顯降低, 而pc-Smad6 組的遷移率則顯著升高(P<0.05);與Smad6質粒組相比,共轉染miR-186 mimics 和Smad6 質粒組細胞遷移率顯著升高(P<0.05)。 上述結果表明,miR-186 能抑制U251 細胞遷移的作用,這種作用可被Smad6 過表達所逆轉。
2.4 miR-186 調控Smad6 對膠質瘤細胞EMT 的影響
由圖4 可知,與對照組相比,miR-186 mimics 組上皮細胞黏附分子E-cadherin 的表達顯著升高,而間質細胞黏附分子Vimentin 的表達水平顯著降低(P<0.05)。 在pc-Smad6 組中兩種分子的表達情況相反(P< 0.05 )。 與pc-Smad6 組相比, miR-186 mimics + pc-Smad6 組Vimentin 的表達水平明顯降低,而E-cadherin 的表達水平顯著升高。 由此可見,miR-186 過表達可通過作用于Smad6 改變細胞上皮間質轉化相關蛋白E-cadherin 和Vimentin 的表達情況。
3 討論
膠質瘤是起源于神經外胚層的腫瘤,浸潤性生長、失控性增殖,惡性程度高,治療難度大、易復發,其機制尚不明確[5-6]。 故從分子水平尋求治療靶點是目前膠質瘤研究的重要方向之一。 miRNA 可通過調控某些重要基因的表達而影響腫瘤的發生、發展過程[7]。
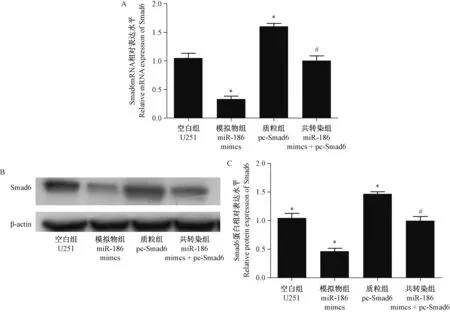
圖2 RT-qPCR 和Western blot 檢測各組細胞中Smad6 的表達Note.A, Statistical analysis of gene expression.B, Protein bands.C, Statistical analysis of protein expression.Compared with the U251 group, ?P<0.05.Compared with the pc-Smad6 group,#P<0.05.Figure 2 RT-qPCR and Western blot detection of Smad6 expression in each group cells
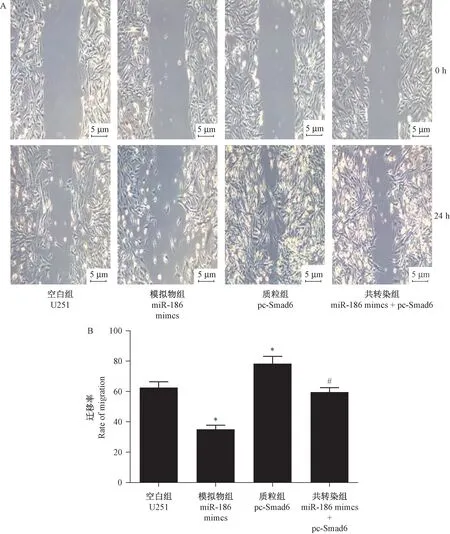
圖3 劃痕實驗檢測各組細胞的遷移情況Note.A, The migration figure.B, Migration rate statistics.Compared with the U251 group, ?P < 0.05.Compared with the pc-Smad6 group.#P<0.05.Figure 3 Wound healing assay anylasis of cell migration
研究發現miR-186 在多種腫瘤中表達異常,某些報道表明該基因在個別腫瘤中高表達,發揮促癌基因的功能[8-9]。 但更多的研究報道顯示miR-186在較多腫瘤中發揮的為抑癌基因的作用,其中miR-186 在胃癌中低表達, 與該腫瘤的進展與轉移有關[10]。 miR-186 在膽管癌和乳腺癌中低表達,可通過靶向調節Twist1 的表達影響癌細胞的增殖、遷移、侵襲及上皮間質轉化[11-12]。 Niinuma 等[13]的研究表明miR-186 的表達下調與胃腸道間質瘤的轉移復發有關。 Ruan 等[14]研究表明miR-186 在肺癌中發揮抑癌作用,通過靶向SIRT6 抑制肺癌進展。 另有研究表明該基因在膠質瘤中也是低表達,發揮抑癌功能,但是具體的機制并不明確[15]。
Smad6 基因位于15q21-22,屬于抑制性Smad蛋白,可調控TGF-β(Transformation growth factor-β)信號通路。 TGF-β 具有促進血管生成、抑制免疫、和刺激細胞外基質形成等作用,故有利于腫瘤生長、擴散和轉移[16]。 研究發現Smad6 在小細胞肺癌、肝癌中均存在表達增加的現象[17]。 本課題組前期研究表明Smad6 在膠質瘤細胞中亦高表達。 其表達增加受miRNA-186 直接調控,并影響了腫瘤細胞的增殖[4]。 但是否會影響膠質瘤細胞的遷移和上皮間質轉化尚不明確,本研究對此進行證實。
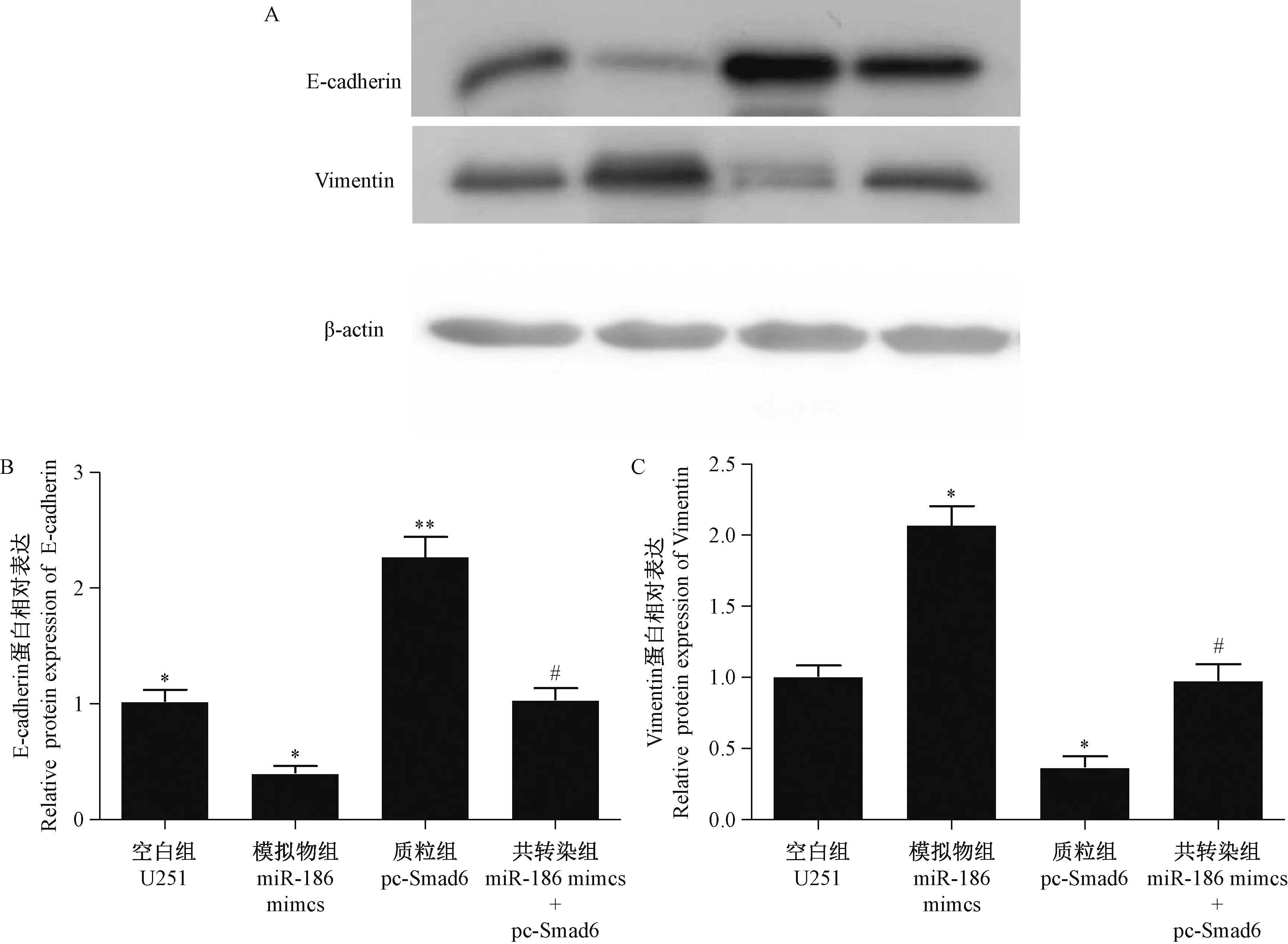
圖4 Western blot 檢測各組細胞中Smad6 的表達Note.A, Protein bands.B / C, Statistical analysis of protein expression.Compared with the U251 group, ?P<0.05.Compared with the pc-Smad6 group, #P<0.05.Figure 4 Western blot detection of Smad6 expression in each group cells
上皮間質轉化是指上皮細胞向間質細胞轉變,該變化可引起腫瘤細胞遷移和侵襲能力明顯增加[18-19],從而促進了惡性腫瘤的浸潤生長和遠處轉移,降低了患者的生存質量甚至危及生命。 在上皮間質發生過程中,上皮細胞標志分子E-cadherin 等表達下降, 而間質細胞標志分子Vimentin、 Ncadherin 等的表達明顯增加。 研究表明miRNA 可通過調控某些基因而影響惡性腫瘤的遷移和侵襲。如王小明等[20]研究表明miR-206 通過調節VEGFA對人肝癌細胞的侵襲和遷移具有抑制作用。 亦有研究表明miR-186 可調節靶基因而影響惡性腫瘤的侵襲轉移及上皮間質轉化的發生[11-12]。
本研究結果再次證實了在膠質瘤細胞U251中,miR-186 低表達,而Smad6 高表達,兩者呈反向關系。 通過實驗進一步驗證了miR-186 過表達后,膠質瘤細胞的遷移能力降低,E-cadherin 表達降低,Vimentin 的表達升高, Smad6 的表達降低; 轉染Smad6 質粒后, 膠質瘤細胞的遷移能力增強, Ecadherin 表達升高,而Vimentin 的表達降低;與轉染質粒Smad6 組比,共轉染miR-186 模擬物和質粒Smad6 組膠質瘤細胞的遷移能力降低,E-cadherin表達降低,Vimentin 的表達升高,Smad6 的表達亦降低。 故該結果表明miR-186 可通過調節Smad6 抑制細胞遷移,減弱上皮間質轉化相關蛋白Vimentin 表達,增加E-cadherin 蛋白表達。 但miR-186 是否會結合其他靶基因共同調控膠質瘤的遷移與上皮間質轉化目前尚不清楚,需要我們進一步的研究。

