霉變培養對果蠅眼色突變的影響*
歐陽雪艷 華樹海
(廣東省湛江市第二中學 廣東湛江 524022)
霉菌污染給人類的生產和生活帶來很多危害,食物霉變會導致外觀潰爛變形、產生腐敗氣味和黏液污穢物等,不僅降低食品的營養價值,而且還可能產生各種有毒有害物質,引起食用者急性中毒或慢性毒害。食物發霉后,二級胺、亞硝酸鹽等含量會提高,為亞硝胺的合成提供了物質條件。有研究表明,大鼠食用霉變食物后,在胃內合成了亞硝胺,且在胃內停留時間越長,合成的亞硝胺就越多。同時不排除有其他致癌物(例如霉菌毒素)的形成。霉變產生的毒素可能導致動物生長受阻、繁殖機能下降、組織壞死、免疫抑制、致癌及基因突變等[1]。本文通過研究霉變培養對果蠅眼色的影響,以探索霉變對動物生長發育的毒性。
1 實驗原理
1)通過每一代果蠅雌雄間交配,并重復多代以減少個體間的基因差異,得到同性別個體基因較一致的種系果蠅。
2)果蠅眼睛顏色的表現是由于大約80 多個基因在不同發育階段的表達和相互作用,這些基因的作用包括參與眼色素前體物的運輸、色素顆粒的合成、色素顆粒轉運和色素顆粒的沉積[2]。
3)霉變毒素影響果蠅眼色的表現過程。
2 實驗過程
2.1 實驗材料和用具
實驗材料:野生型黑腹果蠅。
實驗器具和藥品:數碼顯微鏡、保溫箱、電磁爐、高壓滅菌鍋、電子天平、培養瓶(錐形瓶)、量筒、白紙若干、紗布、小塑料條、藥棉、酵母粉、記號筆、膠圈、棉線、玉米粉、瓊脂、白糖、丙酸等。
2.2 實驗方法和步驟
2.2.1 培養基配方 玉米粉10 g、瓊脂粉1.5 g、酵母粉0.7 g、丙酸0.5 mL、水76 mL、白糖13.5 g。
2.2.2 培養基的配制
1)果蠅正常培養基的配制。在38 mL 水中加入瓊脂粉和白糖,煮沸使其充分溶解(期間不斷攪拌,防止糊底)。另取38 mL 水加入玉米粉攪勻,緩慢倒入上述瓊脂溶液中,繼續攪拌成糊狀煮沸。待培養基冷卻至70℃后加入0.5 mL 丙酸攪拌均勻,趁熱將培養基裝入培養瓶中約2 cm 厚,加蓋紗布棉塞后冷卻待用。培養瓶與紗布棉塞等應提前高壓滅菌[3]。接種果蠅前,再加入酵母粉和已消毒的小塑料條。
注意事項:①培養基分裝時需要注意的問題比較多,否則容易受到污染。最好在無菌室或超凈工作臺上分裝培養基,倒培養基時應注意不要沾到瓶口及瓶壁。②分裝好培養基的培養瓶及時蓋上紗布棉塞,冷卻放置1~2 d,待培養瓶上的水汽蒸發干。③不能過早將酵母粉加入培養基中,否則容易失活影響果蠅食用。
2)果蠅霉變培養基的配制。按上述配方配制培養基,不添加丙酸,不需要無菌操作。冷卻后用單層紗布封口,在室內分別放置6 d、12 d、24 d、30 d,使培養基發生不同程度的霉變。
2.2.3 對野生型果蠅的培養至第5 代 將野生型果蠅轉移至果蠅正常培養基中,斜放3 cm×10 cm的粗糙面的塑料條,在適宜溫度(約25℃)下進行培養。每星期更換一次培養基,對每一代的果蠅子代與親代進行分離,直至第5 代幼蟲。
2.2.4 霉變培養基中培養第6 代果蠅 將第5代果蠅幼蟲均分為2 個重復組,每個重復組隨機均分為4 組,分別轉移至不同發霉程度的培養基中進行培養,定期觀察果蠅生活狀態和生活力。待其交配并產生第6 代果蠅幼蟲后,將第5 代果蠅成蟲轉移出培養基,并繼續在各霉變培養基中培養第6 代果蠅至成蟲。
2.2.5 第6 代果蠅成蟲的麻醉 在麻醉瓶的棉塞上滴加少量乙醚,然后迅速拔去裝有果蠅培養瓶的棉塞。使培養瓶和麻醉瓶口相對,并拍打培養瓶使果蠅全都進入麻醉瓶,然后迅速將麻醉瓶塞上棉塞。麻醉后將果蠅倒在白磁板上。當果蠅翅膀上翹45°時,表示已死亡,不可再用[4]。
2.2.6 觀察果蠅第6 代的性狀 使用數碼顯微鏡,調至側面光源,將昏迷的果蠅置于載玻片上,不加蓋玻片,即可清晰觀察到果蠅各結構特征。甚至能觀察到昏迷果蠅的腹部運動,還可拍攝完整、清晰的圖片,便于結果的記錄、對比和分析。
3 實驗結果
3.1 果蠅主要性狀觀察 觀察經乙醚麻醉后果蠅的外部形態,包括口器、觸角、眼色、體色、翅形和剛毛等(圖1~圖3)。并從體形大小、腹背部條紋數、尾部圓銳和復雜程度、性梳的有無等特征鑒別果蠅的性別。性梳是一種梳狀的黑色鬃毛狀結構,位于雄果蠅前足第一附節前端的指狀突起處。雌果蠅無性梳,這是果蠅雌、雄鑒別的重要依據[5]。

圖1 果蠅前足剛毛
圖2 果蠅口器
圖3 果蠅腹部條紋
3.2 霉變培養對果蠅眼色的影響
3.2.1 圖片比較(圖4~圖6)
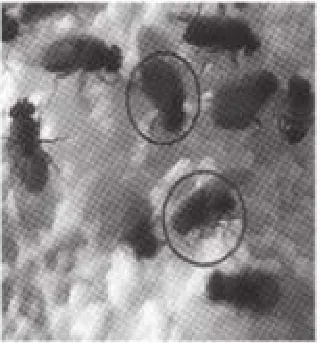
圖4 野生型和亮紅眼果蠅(圓圈標注)

圖5 紅眼(野生型)
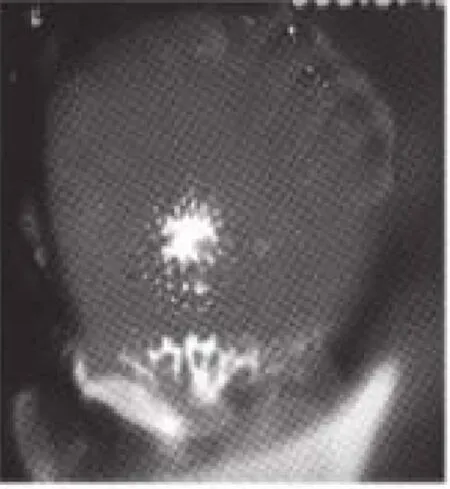
圖6 亮紅眼(突變型)
3.2.2 數據記錄(表1、表2)

表1 不同程度發霉培養基中第6 代果蠅野生型和突變體的數量統計(重復組1)
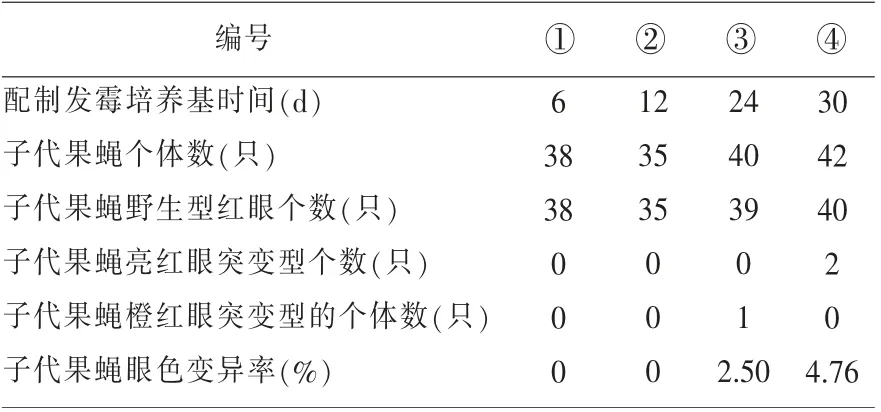
表2 不同程度發霉培養基中第6 代果蠅野生型和突變體的數量統計(重復組2)
4 實驗結果分析
結果表明,霉變培養的2 個重復組中均有果蠅個體突變,且隨著霉變程度的增大,果蠅眼色變異率有增大趨勢。
5 實驗過程中所遇到的問題及解決方案
5.1 實驗溫度不適宜 果蠅培養的適宜溫度為23~25℃。培養溫度高于30℃時,會導致果蠅不育甚至死亡。培養溫度過低,果蠅生活周期會延長,生育力和生活力會下降。因此,可根據實際情況,將果蠅培養瓶置于適宜溫度的保溫箱中,定時觀察果蠅生活力及狀態。
5.2 培養基過濕或過干 實驗過程中會出現培養基過濕或過干的現象。過早地將酵母粉加入培養基,容易使培養基提前發酵,導致培養基濕度過大,粘住果蠅翅膀致其死亡,影響果蠅接種。培養基因失水而干結成塊,與瓶壁分離,不僅不利于果蠅產卵,且容易造成果蠅掉入縫隙致死。因此,培養過程中要視培養基情況及時轉接果蠅,酵母粉的選擇與添加時間也影響培養基的干濕,要謹慎挑選酵母粉并在轉移果蠅前加入培養基;為防止果蠅溺水可在培養瓶中斜放已消毒的3 cm×10 cm粗糙面塑料條(改變使用紙條的做法,紙條易吸水皺縮和發霉),為果蠅提供活動場所。
5.3 果蠅子代的轉移 果蠅產卵一段時間后,卵將進入幼蟲階段,幼蟲身體呈乳白色,較柔軟,此時需要對幼蟲進行轉移,以防培養基較長時間不更換而發霉,影響果蠅幼蟲的生長和發育。一旦果蠅幼蟲結繭便會粘附在培養瓶壁上,強行取下進行轉移會造成部分果蠅繭破裂而死亡,降低了果蠅子代的成活率。綜上,必須在果蠅幼蟲發育成繭之前對果蠅幼蟲進行培養基的轉移。由于果蠅幼蟲較柔軟,可使用棉簽刮下培養瓶壁上的果蠅幼蟲,注意動作要輕緩,以免對果蠅幼蟲造成傷害。
5.4 更換培養基時果蠅成蟲的轉移 更換培養基時果蠅成蟲的轉移較困難,既要防止果蠅飛出造成不同組混雜,又要避免對果蠅成蟲造成傷害,降低成活率。可使用已消毒的白紙,卷成漏斗狀,上部與原培養瓶口緊密相連,下部留出足夠果蠅進入的小孔并與新培養瓶口相連。既可保證進入培養基的果蠅是活動力較強的果蠅,又可防止其他污染物進入培養基。培養瓶下墊海綿,轉移過程中將培養瓶不停地敲打墊有海綿的桌面,使果蠅通過漏斗型的紙筒小孔掉入培養基中。
6 研究創新點
6.1 材料創新 為了研究霉變對動物生長發育的影響,本實驗使用生長周期短、繁殖速度快、相對性狀明顯的果蠅作為實驗材料。果蠅作為模式生物在初、高中實驗中卻較少被使用,本實驗為初、高中生物學教學中圍繞果蠅開展實驗提供了可行途徑。
6.2 方法創新
1)改變傳統使用體視鏡觀察果蠅的方法,采用數碼顯微鏡觀察,使用側面光源,清晰地觀察到放大倍數較高的果蠅結構特征,并可拍攝觀察與分析。
2)在轉移果蠅成蟲時,使用自制紙漏斗對其進行轉移。培養瓶下墊些海綿,轉移過程中將培養瓶不停地敲打墊有海綿的桌面,使果蠅通過紙漏斗的小孔掉入培養基中。
3)為防止果蠅溺亡可在培養基中斜放已消毒過的3 cm×10 cm 的粗糙面的小塑料條,為果蠅提供活動場所。
6.3 目的創新 經查證,已有的研究主要集中在酒精、甲醛等物質對果蠅生長發育和繁殖力各方面的影響,很多實驗在培養果蠅過程中避免培養基霉變,但少有實驗課題在霉變是否影響果蠅的生長發育方面做研究。本實驗從果蠅生長環境中最常見的霉變出發,通過將基因型基本相同的果蠅放置于不同發霉程度的培養基中,觀察霉變的培養基是否對果蠅眼色變異有影響,開創了新的實驗思路和方向。
果蠅眼色的控制因生化機制包括許多環節而存在多基因一效現象。研究表明,亮紅眼果蠅眼黃素含量極顯著低于野生型果蠅,而其果蠅喋呤含量無顯著差異。scarlet基因的產物負責果蠅眼黃素的跨膜運輸,研究者在scarlet基因中檢測到了7.5 kb的逆轉座子412 元件的插入,他們認為果蠅亮紅眼是scarlet基因突變導致轉錄提前終止,其編碼蛋白部分缺失或完全喪失功能,從而引起果蠅眼睛中眼黃素合成水平的降低,使得其呈現亮紅色[2]。逆轉座子在果蠅的生命周期中具有活性,同時還受到一系列環境和生理因子的調節,例如,幽醇類激素、脅迫、cAMP 水平、DNA 損傷因子等。霉菌毒素具有致畸、致癌、致變態等作用,對于DNA 穩定性有較大影響[6]。霉變培養中的霉菌毒素作為果蠅生活的脅迫條件,可能影響果蠅DNA 內部逆轉座子的活性,進而引起果蠅亮紅眼突變的發生。

