響應面法優化海藻酸鈉固定幾丁質脫乙酰酶的研究
杭加豪,任思雨,張春光,武波飛,蘇永成,劉姝,焦豫良,盧靜,房耀維,*
(1.江蘇海洋大學海洋生命與水產學院,江蘇連云港222005;2.江蘇海洋大學食品科學與工程,江蘇連云港222005)
幾丁質(chitin)是由N-乙酰氨基葡萄糖通過β-(1,4)鍵連接的線性多糖[1],也是地球上含量僅次于纖維素的天然多糖生物大分子[2],但因其不溶于水和一般有機溶劑,難以開發利用其商業價值[3]。殼聚糖(chitosan)是幾丁質脫乙酰度大于55%的產物[4],也是目前已知唯一的堿性多糖[5]。殼聚糖分子鏈上存在的游離氨基使其溶解性能優于幾丁質[6]。此外,殼聚糖還具有良好的降解性和生物相容性,對人體無害,并且具有抑菌、降血壓、降膽固醇和抗癌等作用,廣泛應用于食品、醫藥、農業、化工、化妝品和環境治理等領域[7-10]。
目前,殼聚糖的制備方法有化學熱堿法和生物酶法[11]。熱堿法是工業上最常用的方法,即向40%的氫氧化鈉或氫氧化鉀中加入幾丁質后70℃加熱制備殼聚糖[12]。該方法雖操作簡單,但存在反應時間長、產品脫乙酰度不穩定和排放物污染環境等缺點[13]。生物酶法利用幾丁質脫乙酰酶(chitin deacetylase,CDA)催化幾丁質脫乙酰制備殼聚糖[14],其反應條件溫和,產品的脫乙酰度穩定、可控,最為關鍵的是生產過程綠色環保[15]。CDA在碳水化合物活性酶數據庫(www.cazy.org)中屬于碳水化合物脂酶家族4(carbohydrate esterase family 4,CE4)[16]。來自海洋節桿菌 Arthrobacter sp.AW19M34-1的CDA(ArCE4)是目前已知唯一可以催化不溶性幾丁質脫去乙酰基的細菌CDA,易于在大腸桿菌中可溶性表達[17]。但是,重組ArCE4穩定性和活性容易受溫度、pH值和其它外界因素的影響,增加了殼聚糖生產成本。
固定化酶技術為提高CDA穩定性提供了有效的解決途徑。固定化酶技術將游離酶制作成具有催化活性但不溶于水的固相酶,提高了生物酶的穩定性[18]。游離酶經過固定后還易于從產物中分離,可以循環使用,降低了生產成本[19]。海藻酸鈉包埋法是最常用和最有效的酶固定方法之一[20],該法不會對酶的構象產生影響,并且酶活回收率高,但包埋條件對酶活影響較大[21]。基于此,本研究設計單因素試驗與響應面試驗對海藻酸鈉包埋固定ArCE4的工藝進行優化,并研究固定化酶的酶學性質和操作穩定性。
1 材料與方法
1.1 材料與試劑
重組Arthrobacter sp.CDA:江蘇海洋大學海洋生物酶工程實驗室制備保存;海藻酸鈉、氯化鈣(calcium chloride,CaCl2):國藥集團化學試劑有限公司;戊二醛(glutaric dialdehyde,GA):阿拉丁試劑有限公司;對硝基-N-乙酰苯胺:上海博微生物科技有限公司。所用試劑皆為分析純。
1.2 儀器與設備
電熱恒溫水浴鍋(HW·SY):海源儀器廠;高速冷凍離心機(日立CR 22G):日本HITACHI公司;新世紀紫外可見分光光度計(T6):北京普析通用儀器有限責任公司。
1.3 方法
1.3.1 固定化酶的制備
參考王靜等[22]以海藻酸鈉為載體、戊二醛為交聯劑對L-阿拉伯糖異構酶固定的方法,對CDA進行固定。將海藻酸鈉溶液與酶液按2∶1(體積比)混合,攪拌均勻。用5 mL注射器將上述混合溶液以緩慢速度滴入CaCl2溶液中,形成尺寸相似的固定化酶凝膠顆粒。4℃靜置硬化一段時間,用磷酸緩沖鹽溶液(phosphate buffered saline,PBS)與超純水洗滌凝膠顆粒。干燥后加入一定濃度的GA溶液,25℃振蕩交聯數十分鐘后,用PBS與超純水洗滌凝膠顆粒,4℃保存在PBS中用于后續試驗。
1.3.2 單因素試驗優化固定條件
以30.0 g/L的海藻酸鈉,30.0 g/L的CaCl2,靜置硬化4 h,0.05%的GA溶液,振蕩交聯30 min為基本條件,分別對海藻酸鈉濃度、CaCl2濃度、靜置硬化時間、GA濃度和振蕩交聯時間進行單因素優化。
1.3.3 響應面法優化固定條件
基于單因素試驗結果,選取對固定化CDA酶活影響較大的海藻酸鈉濃度、CaCl2濃度和靜置硬化時間為考察因素,以CDA的酶活為考察指標,根據Box-Behnken原理設計三因素三水平響應面試驗,試驗設計見表1。使用Design-Expert.V8.0.6.1軟件對結果進行響應面回歸分析。
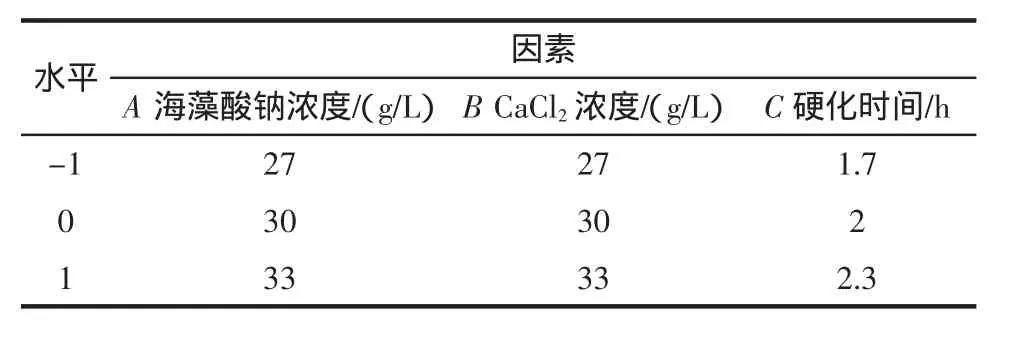
表1 響應面法分析因素及水平Table 1 Factors and levels of response surface experiment
1.3.4 最優條件驗證試驗
分析響應面法試驗數據得到最優的CDA固定條件,用該條件進行5次重復驗證,測定固定化CDA的相對酶活,取其平均值與預測值比較。
1.3.5 固定化CDA酶學性質的測定
1.3.5.1 熱穩定性
將固定化酶和游離酶分別置于 20、30、40、50、60℃水浴鍋中保溫2 h后,于30℃進行酶促反應,測定酶活性以研究固定化酶的熱穩定性。
1.3.5.2 pH值穩定性
將固定化酶和游離酶分別置于pH 3~9的緩沖液中保存20 h后,于30℃進行酶促反應,測定酶活性以研究固定化酶的pH值穩定性。
1.3.5.3 操作穩定性
將固定化酶在相同條件下連續操作10次,測定相對酶活。
1.3.6 CDA酶活性的測定
參考來蔣麗等[23]測定CDA酶活性的方法并稍作修改。試管中加入3 mL 0.05 mol/L pH 7.0的PBS和1 mL 200 mg/L的對硝基-N-乙酰苯胺溶液,30℃預處理15min后加入1mL酶液,酶促反應30min,沸水浴終止酶促反應,5000r/min離心15min,取上清液在400nm處測定上清液吸光值。空白對照組添加1 mL滅活酶液,其余不變。
固定化酶活性的測定是以0.5 g固定化酶代替1 mL游離酶,酶促反應30 min后取出固定化酶顆粒終止反應。以添加0.5 g用滅活酶液制作的固定化酶顆粒為空白對照。
1.3.7 數據處理與分析
每組試驗設置3組平行試驗,用平均值±標準方差的形式表示試驗結果,并用SPSS Statistics 25.0軟件對結果進行統計學分析。
2 結果與分析
2.1 單因素試驗結果
2.1.1 海藻酸鈉濃度對固定化酶活性的影響
海藻酸鈉濃度對固定化酶活性的影響見圖1。
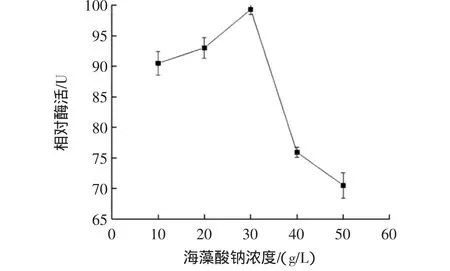
圖1 海藻酸鈉濃度對固定化酶活性的影響Fig.1 Effect of sodium alginate concentration on the immobilized enzyme
如圖1所示,固定化酶活性隨著海藻酸鈉濃度的增加而升高,當濃度達到30.0 g/L時酶活性最高;隨著海藻酸鈉濃度繼續升高,酶活性顯著降低。這可能因為當海藻酸鈉濃度過低時,與CaCl2反應形成的凝膠顆粒孔徑大,CDA包埋不緊密,易流失,所以酶活性低;當濃度過高時,溶液黏度大,與CDA溶液混合時酶液分散不均勻,并且制成的凝膠顆粒形狀不規則,有拖尾,影響CDA與底物結合,所以酶活性降低。
2.1.2 CaCl2濃度對固定化酶活性的影響
CaCl2濃度對固定化酶活性的影響見圖2。
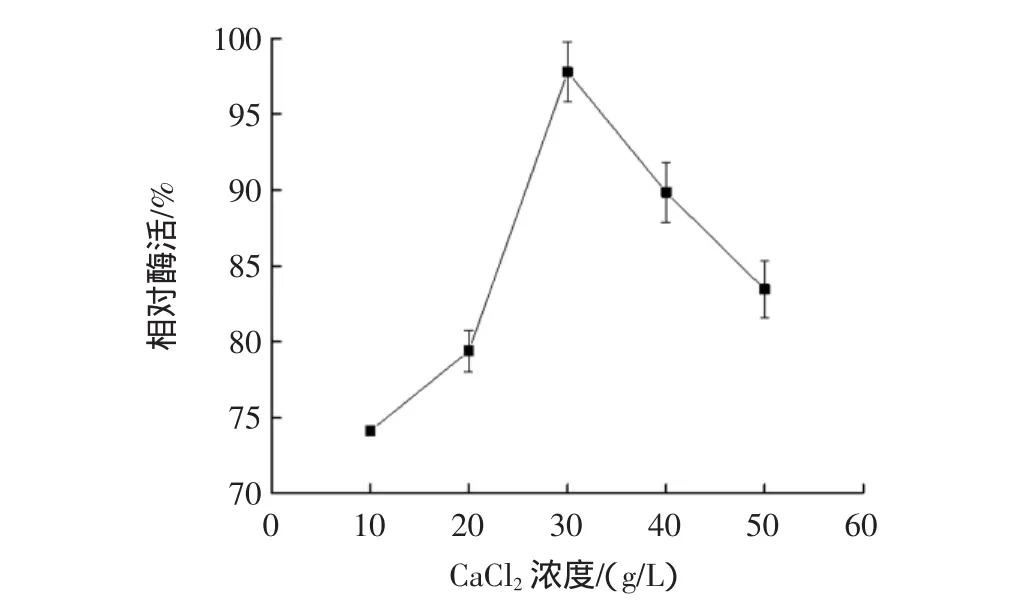
圖2 CaCl2濃度對固定化酶活性的影響Fig.2 Effect of CaCl2concentration on the immobilized enzyme
如圖2所示,當CaCl2濃度為30.0 g/L時,固定化酶活性最高。推測原因為Ca2+濃度過低時,凝膠交聯度低,顆粒不易形成,酶包埋不緊密,流失過多,所以酶活性低;Ca2+濃度過高時,凝膠過度交聯,顆粒表面布滿Ca2+,網狀結構孔徑小,阻礙酶與底物結合,所以酶活性低。
2.1.3 硬化時間對固定化酶活性的影響
硬化時間對固定化酶活性的影響見圖3。
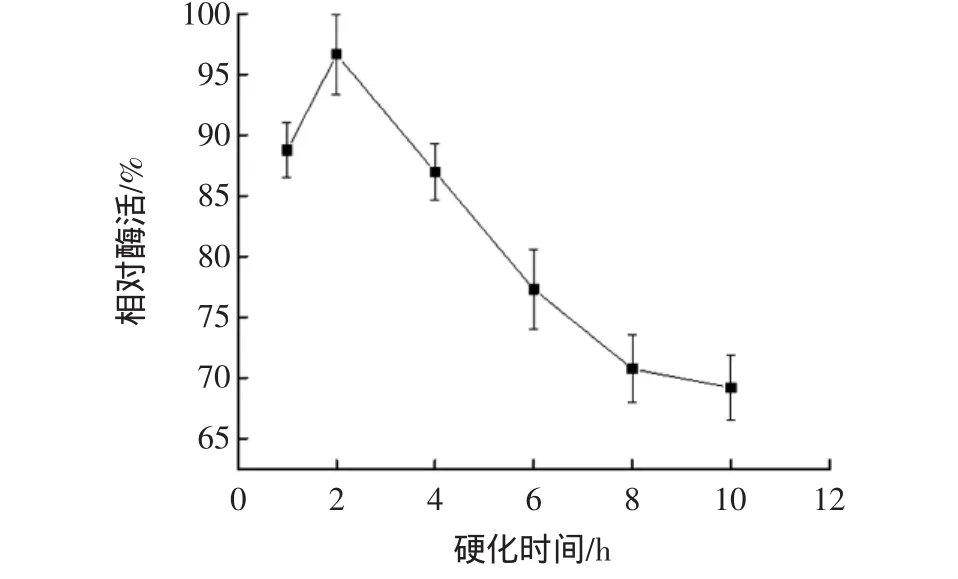
圖3 硬化時間對固定化酶活性的影響Fig.3 Effect of solidifying time on the immobilized enzyme
如圖3所示,硬化2 h時,固定化酶活性最高;繼續硬化,酶活性降低。說明硬化時間過長會導致交聯過度,凝膠顆粒表面網狀結構孔徑小,CDA包埋過于緊密,底物難以與其結合。
2.1.4 GA濃度對固定化酶活性的影響
GA濃度對固定化酶活性的影響見圖4。
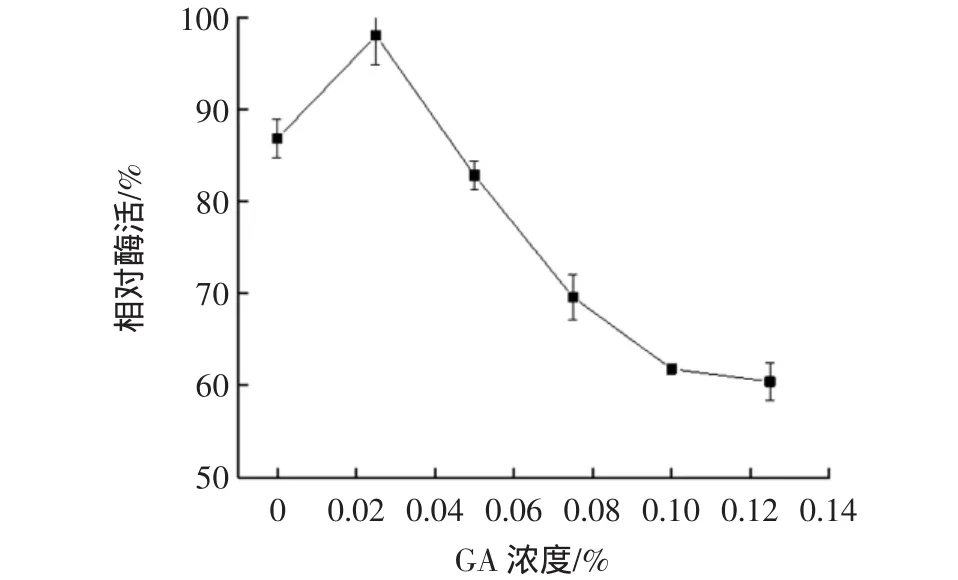
圖4 GA濃度對固定化酶活性的影響Fig.4 Effect of glutaric dialdehyde concentration on the immobilized enzyme
如圖4所示,當GA濃度為0.025%時,固定化酶活性最高;當GA濃度增加時,酶活性顯著降低。這可能因為適當濃度的GA可以強化海藻酸鈉分子與CDA的交聯,增加固定化CDA的穩定性,而高濃度的GA溶液會使蛋白質變性,從而導致喪失酶活性。
2.1.5 交聯時間對固定化酶活性的影響
交聯時間對固定化酶活性的影響見圖5。
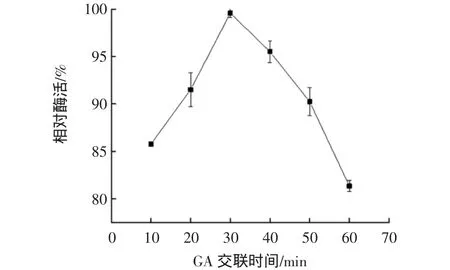
圖5 交聯時間對固定化酶活性的影響Fig.5 Effect of cross-linking time on the immobilized enzyme
如圖5所示,固定化酶活性隨著交聯時間的增加而提高,當交聯時間為30 min時,酶活性最高;繼續延長交聯時間,酶活性降低。這是因為在GA的作用下,CDA與海藻酸鈉凝膠活性位點進行結合,當結合位點達到飽和時,GA開始影響CDA的酶活,導致酶活性降低。
2.2 響應面試驗結果
2.2.1 響應面數據分析
試驗設計與結果見表2。
對結果進行響應面分析,得到固定化酶活性(U)對海藻酸鈉濃度(A)、CaCl2濃度(B)和靜置硬化時間(C)的三元二次回歸方程為:
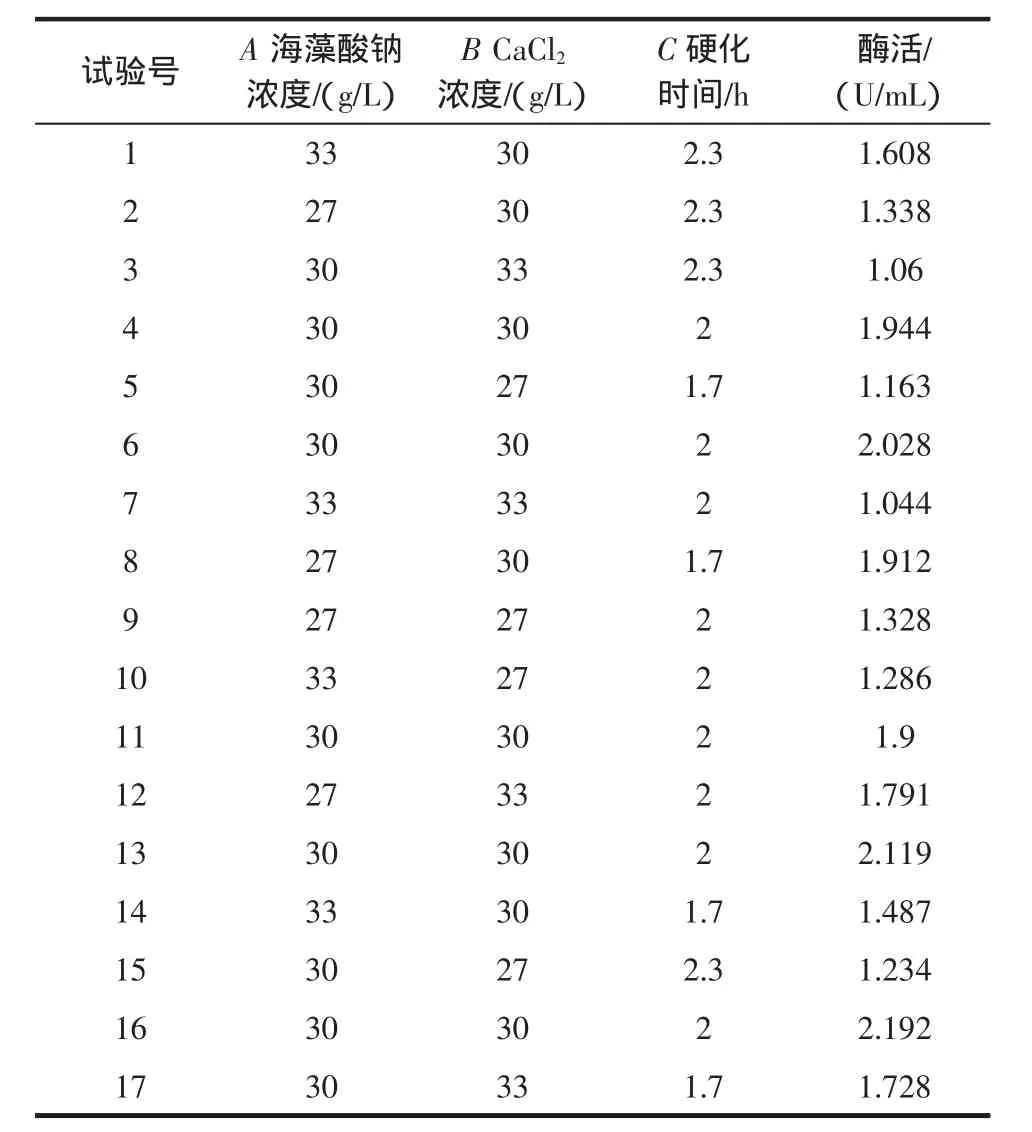
表2 響應面法試驗設計與結果Table 2 Design and results of response surface experiment
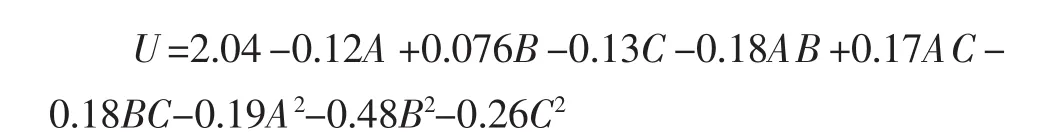
回歸方程的方差分析見表3。
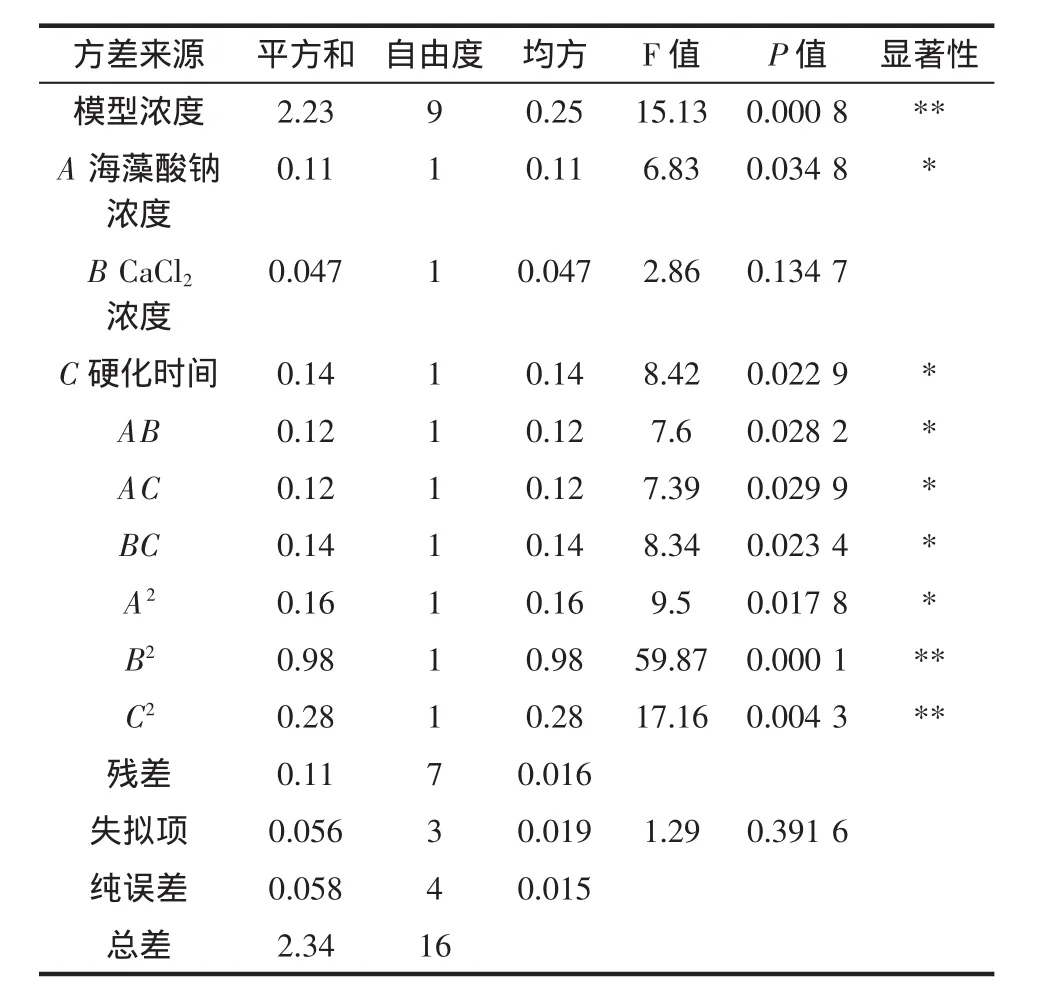
表3 回歸模型方差分析Table 3 Analysis of variance in regression model
對測得的固定化酶活性進行方差分析,模型的P值=0.000 8<0.01,差異極顯著,失擬項的P值=0.391 6>0.05,差異不顯著。表明該模型與試驗數據擬合合理,回歸方程有較高可信度,誤差小,能夠用來對固定化酶的酶活性進行預測。模型中一次項A和C、二次項A2與交互項AB、AC和BC對固定化酶活性影響顯著,二次項B2和C2對固定化酶活性影響極顯著。說明各固定條件對固定化酶活性影響并非線性關系。
2.2.2 響應面優化結果與分析
響應面3D圖可以直接反映各固定條件間的交互作用對固定化CDA酶活的影響。等高線圖可以體現出各因素交互作用的強弱,橢圓形的等高線表示相互作用顯著;越接近正圓,交互作用越不顯著。各因素對固定化酶活性的影響見圖6。
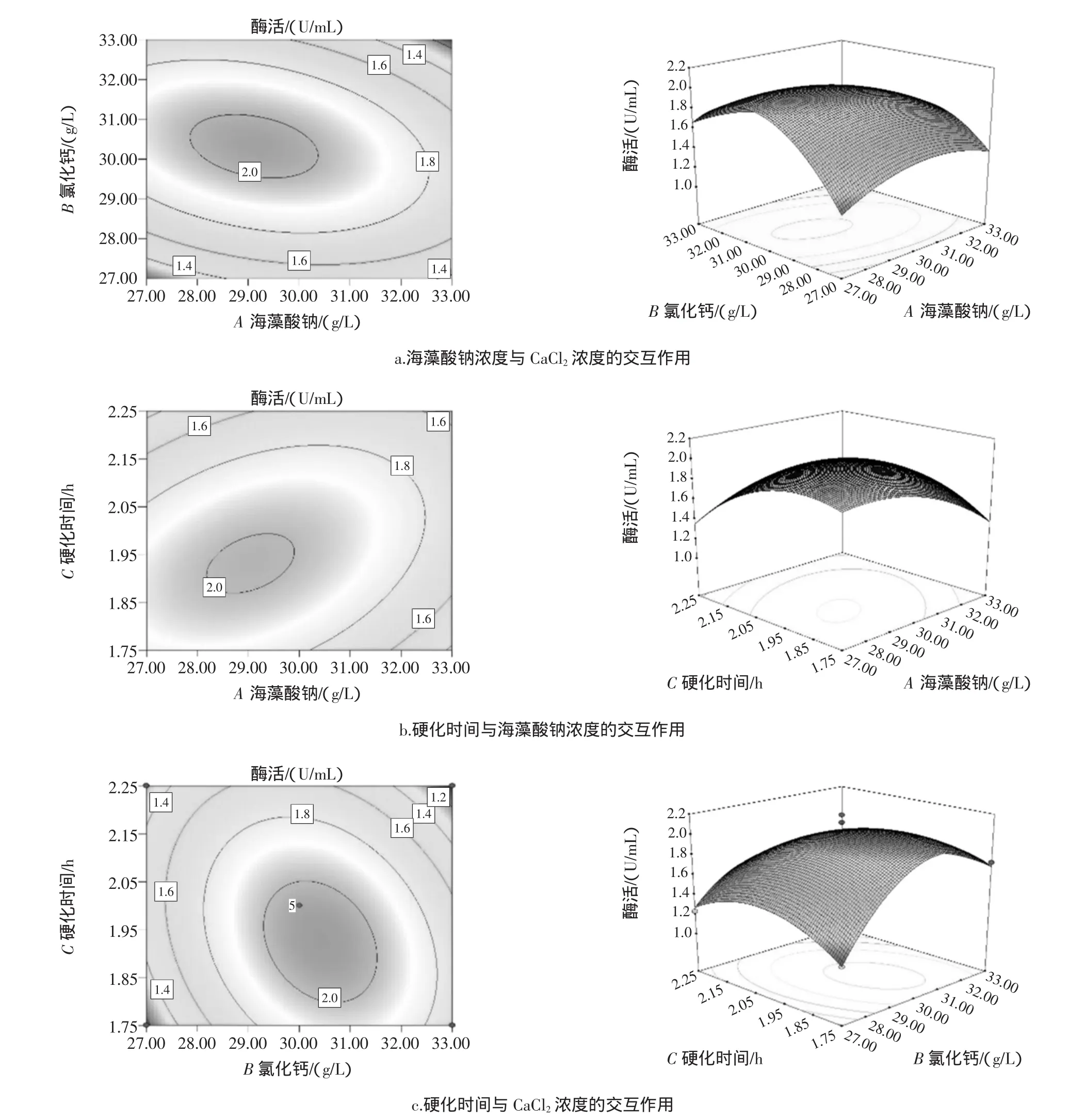
圖6 各因素對固定化酶活性的影響Fig.6 Interaction effect on activity of immobilized enzyme
如圖6所示,海藻酸鈉濃度和CaCl2濃度之間以及海藻酸鈉和硬化時間之間交互作用較強,而CaCl2濃度和硬化時間之間交互作用較弱。結合各因素交互作用對CDA相對酶活性影響的響應面圖和回歸模型,優化海藻酸鈉包埋法固定CDA的條件,結果為海藻酸鈉濃度27.8 g/L、CaCl2濃度31.0 g/L、靜置硬化1.84 h。各因素取最優值后預測固定化酶活性可達2.13 U/mL。
2.3 最優固定條件驗證結果
5 次重復試驗的結果為 1.98、2.07、2.27、2.01、2.19 U/mL,平均值為2.10 U/mL,與預測值2.13 U/mL相比偏差極小,表明模型可信度高。
2.4 固定化酶的酶學性質
2.4.1 熱穩定性
固定化酶與游離酶的熱穩定性見圖7。
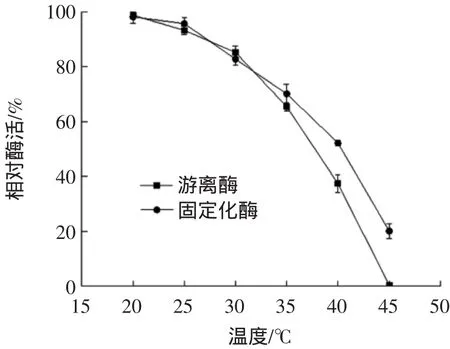
圖7 固定化酶與游離酶的熱穩定性Fig.7 Thermal stability of immobilized enzyme and free enzyme
由圖7可知,CDA適合儲存在低溫環境中,隨著儲存溫度的升高,損失的酶活性越多。當儲存溫度為45℃時,游離酶幾乎沒有酶活性,固定化酶還保留最高酶活20.05%的酶活性。該結果表明CDA的固定化可以提高其溫度穩定性。
2.4.2 pH值穩定性
固定化酶與游離酶的pH值穩定性見圖8。
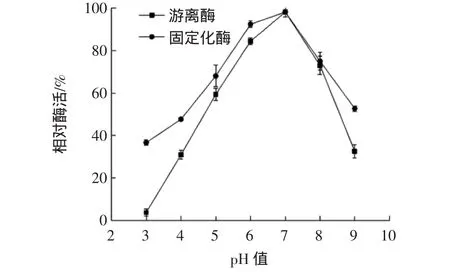
圖8 固定化酶與游離酶的pH值穩定性Fig.8 pH stability of immobilized enzyme and free enzyme
由圖8可知,CDA儲存在pH 7的緩沖液中效果最佳。pH 3條件下放置20 h后,游離酶幾乎沒有酶活性,固定化酶還保留最高酶活36.70%的活性;pH 9時,游離酶還保留最高酶活32.60%的活性,而固定化酶還保留最高酶活52.70%的活性。該結果表明經過固定后的CDA,pH值穩定性有所提高。
2.4.3 操作穩定性
固定化CDA的操作穩定性見圖9。
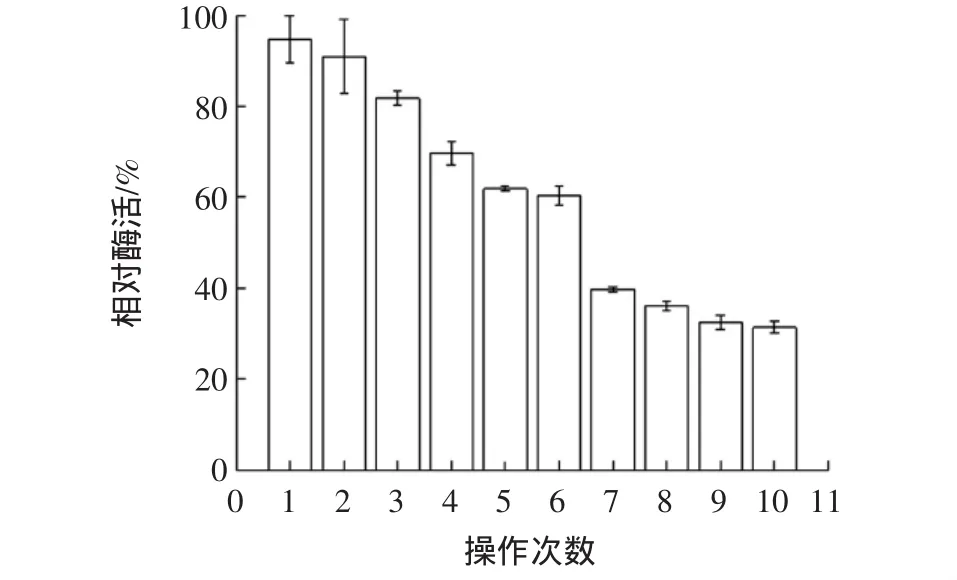
圖9 固定化CDA的操作穩定性Fig.9 The operation stability of immobilized CDA
如圖9所示,固定化酶活性隨循環操作次數的增加而降低。這是因為連續操作使凝膠強度降低,酶漏失過多,導致酶活性降低。固定化酶在連續操作6次后,酶活性依然保持最高酶活性的60.39%。
3 結論
本試驗使用海藻酸鈉包埋法對CDA進行固定,通過設計單因素試驗和響應面試驗對固定條件進行優化,得到最優條件:海藻酸鈉濃度為27.8 g/L,CaCl2濃度為31.0 g/L,硬化1.84 h,GA濃度為0.025%,交聯30 min。重復試驗驗證了優化結果,與預測值偏差較小。通過對比固定化酶和游離酶的酶學性質,發現固定化酶的熱穩定性和pH值穩定性相較于游離酶有明顯提升。固定化酶的操作穩定性研究表明,在連續操作6次后,固定化酶活性依然保持最高酶活的60.39%。CDA是催化幾丁質脫乙酰制備殼聚糖的酶,提高幾丁質脫乙酰的穩定性可以降低成本,提高殼聚糖制備效率。本研究為固定化CDA催化制備殼聚糖的工業應用奠定了試驗基礎。

