NLRP3炎癥小體在小鼠甲型流感病毒感染繼發MRSA肺炎中的表達變化*
石云鋒, 師小函, 朱 軍, 羅進梅, 巴俊慧, 陳健寧, 吳本權△
(1中山大學附屬第三醫院MICU,呼吸與危重癥醫學科,廣東廣州510630;2浙江大學醫學院附屬第四醫院呼吸與危重癥醫學科,浙江義烏322000;3中山大學附屬第三醫院病理科,廣東廣州510630)
甲型流感病毒(甲流病毒)引起的流感傳播范圍廣、肺炎發病率高,給人類健康及公共衛生帶來極大的威脅與負擔。甲流病毒感染1周時易繼發細菌性肺炎,其中繼發耐甲氧西林金黃色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)肺炎是最常見并最嚴重的并發癥,死亡率高達60%[1-2]。核苷酸結合寡聚化結構域樣受體蛋白3(nucleotidebinding oligomerization domain-like receptor protein 3,NLRP3)炎癥小體是肺泡巨噬細胞(alveolar macrophages,AMs)抗甲流病毒免疫的主要機制,并在抗MRSA免疫中起作用[3]。由于MRSA對抗菌藥物的廣泛耐藥性,積極研究甲流病毒感染繼發MRSA肺炎的免疫治療有重要臨床意義。對甲流病毒感染繼發細菌性肺炎的研究多數關注的是金黃色葡萄球菌,對其機制的研究則集中于細菌黏附性增加、局部免疫屏障損害、免疫細胞吞噬能力及數量下降等[4-8]。Robinson等[9]研究發現甲流病毒感染通過抑制白細胞介素1β(interleukin 1β,IL-1β)的產生加劇了繼發性金黃色葡萄球菌肺炎。但NLRP3炎癥小體在甲流病毒感染繼發MRSA肺炎中的表達如何變化,國內外未見進一步研究。本研究以MRSA滴鼻感染經甲流病毒H1N1預感染6 d的小鼠建立甲流病毒感染繼發MRSA肺炎模型,研究NLRP3炎癥小體在其中的表達變化。
材料和方法
1 實驗用病毒、細菌及動物
甲流病毒H1N1/FM1株(H1N1)為鼠肺適應株,獲贈于暨南大學醫學院微生物學與免疫學教研室,前期研究及他人已發表研究證實了該病毒株引起小鼠病毒性肺炎的致病力[10-11]。MRSA菌株為中山大學附屬第三醫院呼吸與危重癥醫學科實驗室分離鑒定的臨床菌株。C57BL/6雄性小鼠15只,鼠齡30~35 d,購于廣東省實驗動物中心,許可證號:SCXK(粵)2013-0002。實驗方案遵循《赫爾辛基宣言》原則及動物倫理要求。
2 主要試劑
MLV第1鏈合成試劑盒與SYBR?select master mix購于 Life Technologies;RT-qPCR引物由 Life Technologies設計并合成;兔抗NLRP3單克隆抗體購于Cell Signaling Technology;兔抗caspase-1單克隆抗體購于Novus Biologicals;兔抗GAPDH抗體、辣根過氧化物酶標記的羊抗兔Ⅱ抗和全蛋白提取試劑盒及蛋白濃度檢測試劑盒購于廣州杰特偉科技有限公司;IL-1β ELISA檢測試劑盒購于R&D。
3 主要方法
3.1 甲流病毒H1N1復蘇及毒力的測定 復蘇液氮罐中凍存的甲流病毒H1N1/FM1株,于9日齡雞胚尿囊腔連續傳代2次擴增后,以雞紅細胞血凝試驗測定擴增的病毒效價為1∶640。確定半數致死量(median lethal dose,LD50)為 2-2.83/50 μL[10]。
3.2 細菌培養及菌落形成單位的測定 解凍-80℃凍存的MRSA菌株,接種于血瓊脂培養基并于37℃溫箱中培養24 h。挑取長勢良好的菌落溶于無菌PBS中,測定其在600 nm處吸光度A值。A600=0.6時,MRSA菌落濃度為1×1012CFU/L。預實驗確定MRSA的LD50為該濃度之菌液50μL。
3.3 小鼠分組、肺炎模型建立及標本取材 小鼠在SPF級環境下飼養1周后開始實驗,隨機分成空白對照(control)組、MRSA組和H1N1+MRSA組,每組5只。實驗開始時(d0),空白對照組及MRSA組每只小鼠以50μL PBS液滴鼻,H1N1+MRSA組每只小鼠以50μL LD50濃度的甲流病毒H1N1滴鼻。6 d后(d6),空白對照組每只小鼠以50μL PBS液滴鼻,MRSA組及H1N1+MRSA組每只小鼠以50μLA600=0.6的MRSA菌液滴鼻。24 h后,眼眶取血并以頸椎脫臼法處死小鼠摘取肺臟。滴鼻操作在腹腔注射水合氯醛(10%,80μL)麻醉小鼠后執行。眼眶取血以及頸椎脫臼法處死小鼠在腹腔注射水合氯醛(10%,80μL)聯合肌肉注射鹽酸氯胺酮(30 mg/kg)麻醉并鎮痛后執行。分離血清,-80℃保存,用于IL-1β濃度檢測。左肺上葉及下葉置于液氮中保存,分別用于提取蛋白和RNA。右肺以多聚甲醛溶液固定,常規石蠟包埋,HE染色,光鏡下觀察肺組織病理。實驗過程中觀察并記錄小鼠的生存率、一般情況和體重變化等。體重變化率(%)=(實驗結束時體重-實驗開始時體重)/實驗開始時體重×100%,MRSA感染24 h體重下降率(%)=(MRSA感染24 h體重-MRSA滴鼻感染時體重)/MRSA滴鼻感染時體重×100%。
3.4 RT-qPCR檢測小鼠肺組織NLRP3、caspase-1和IL-1β的mRNA水平 研磨小鼠左肺下葉制成懸液,以Trizol法提取組織總RNA,檢測RNA濃度及A260/A280值。應用ABI7500系統行實時熒光定量PCR檢測。反應條件為:50℃ 2 min,95℃ 2 min;95℃ 15 s,60℃ 1 min,40個循環;95℃ 15 s,60℃ 1 min,95℃30 s,60℃15 s。以β-actin為內參照。檢查RT-qPCR的擴增曲線及熔解曲線,記錄目的基因與內參基因的Ct值。ΔCt=Ct目的基因-Ct內參照基因,ΔΔCt=ΔCt實驗組-ΔCt空白對照組,以2-ΔΔCt法計算各實驗組目的基因mRNA的相對表達量。每個標本RT-qPCR重復3次并取均值。NLRP3、caspase-1和IL-1β的RT-qPCR反應引物見表1。
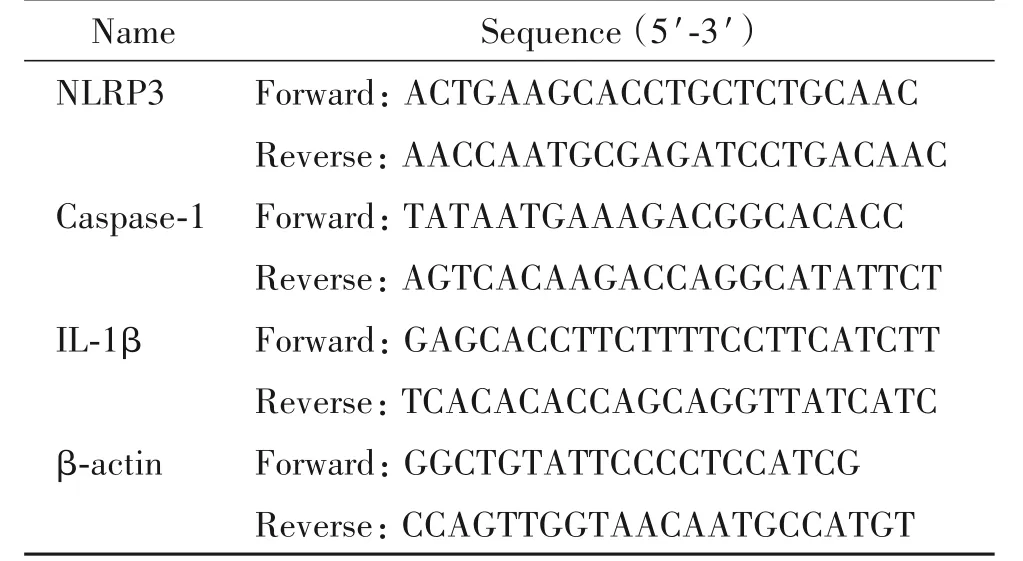
表1 NLRP3、caspase-1和IL-1β的RT-qPCR引物序列Table 1.Primer sequences of NLRP3,caspase-1 and IL-1β for RT-qPCR
3.5 Western blot檢測小鼠肺組織NLRP3和caspase-1蛋白的表達水平 裂解小鼠左肺上葉后,提取總蛋白,以BCA蛋白含量檢測試劑盒測定蛋白濃度。Western blot實驗按每孔30μg蛋白上樣,行SDSPAGE分離,轉至PVDF膜上,含5%牛血清白蛋白室溫封閉1 h,予相應的Ⅰ抗4℃孵育過夜,Ⅱ抗室溫孵育1 h,加入ECL發光液,在Chemi Scope化學發光成像系統顯影。以GAPDH為內參照。用ImageJ軟件分析目的蛋白與內參照蛋白的灰度值,以目的蛋白灰度值與GAPDH灰度值的比值作為各目的蛋白的相對表達量。
3.6 ELISA檢測小鼠血清IL-1β的濃度 根據ELISA檢測試劑盒的操作流程,設復孔數為3,取450 nm處吸光度測量值的平均值。制作標準曲線,依據標準曲線計算各組小鼠血清IL-1β的濃度。
4 統計學處理
采用SPSS Statistics 20.0軟件統計分析。數據均符合正態分布,以均數±標準差(mean±SD)表示。兩組間比較選擇t檢驗。多組比較選用單因素方差分析,各組均數間的兩兩比較采用Bonferroni校正的t檢驗。體重下降率與血清IL-1β濃度相關性分析選擇Pearson積矩相關系數分析。以P<0.05為差異有統計學意義。
結 果
1 小鼠肺組織NLRP3和caspase-1的mRNA及蛋白相對表達量
NLRP3和caspase-1的mRNA表達水平在MRSA組和空白對照組未見明顯差異(P>0.05),而在H1N1+MRSA組表達明顯升高,與空白對照組和MRSA組比較差異均有統計學意義(P<0.01),見圖1。NLRP3和caspase-1的蛋白表達水平在MRSA組與空白對照組未見統計學差異(P>0.05),而在H1N1+MRSA組表達明顯升高,與空白對照組和MRSA組比較差異均有統計學意義(P<0.01),見圖2。NLRP3及caspase-1的蛋白表達變化與其mRNA變化趨勢相一致。
2 小鼠肺組織IL-1β的mRNA相對表達量及血清IL-1β濃度的比較
IL-1β的mRNA表達水平在MRSA組及H1N1+MRSA組均明顯高于空白對照組,但在H1N1+MRSA組的水平卻低于MRSA組,兩兩比較的差異均有統計學意義(P<0.01)。血清IL-1β濃度在MRSA組及H1N1+MRSA組均明顯高于空白對照組,但在H1N1+MRSA組的濃度卻低于MRSA組,兩兩比較的差異均有統計學意義(P<0.01)。IL-1β的血清濃度變化與其mRNA變化趨勢相一致,見圖3。
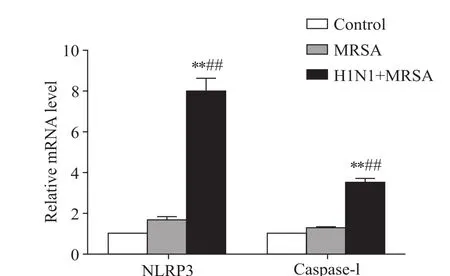
Figure 1. Relative mRNA levels of NLRP3 and caspase-1 in the lung tissues of mice were assessed by RT-qPCR.Mean±SD.n=5.**P<0.01 vs control group;##P<0.01 vs MRSA group.圖1 小鼠肺組織NLRP3和caspase-1的mRNA相對表達量比較
3 小鼠肺組織的病理觀察結果
空白對照組小鼠肺組織病理示正常肺組織結構:支氣管壁、血管及肺泡完整,肺泡內及組織間隙無明顯的腫脹及炎癥細胞浸潤。MRSA組小鼠肺組織見彌漫性支氣管炎和肺炎,肺泡間隔增厚,見較多的炎癥細胞浸潤及充血。H1N1+MRSA組小鼠肺組織病理可見更嚴重的炎癥損害,肺泡結構破壞,肺泡間隔增厚,大量炎癥細胞浸潤,局部支氣管阻塞及肺泡實變,血管充血甚至出血,見圖4。

Figure 2.Relative protein levels of NLRP3 and caspase-1 in the lung tissues of mice were measured by Western blot.Mean±SD.n=5.**P<0.01 vs control group;##P<0.01 vs MRSA group.圖2 小鼠肺組織NLRP3與caspase-1蛋白相對表達量的比較
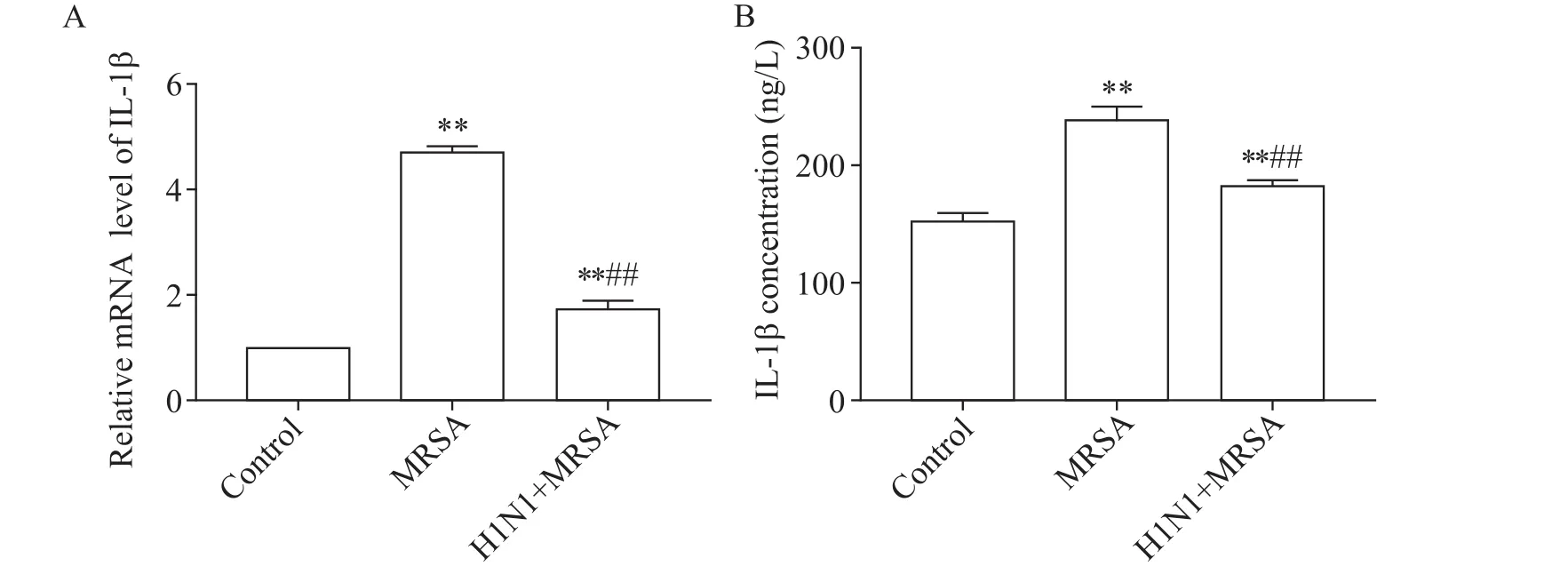
Figure 3.Relative mRNA level of IL-1β in the lung tissues and the serum concentration of IL-1β in the mice.A:the mRNA level of IL-1β in the lung of mice;B:the serum concentration of IL-1β in the mice.Mean±SD.n=5.**P<0.01 vs control group;##P<0.01 vs MRSA group.圖3 小鼠肺組織IL-1β的mRNA相對表達量和血清IL-1β濃度的比較
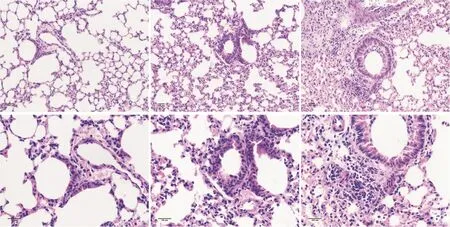
Figure 4.The pathological changes of the lung in mice(HE staining,scale bar=100μm).圖4 小鼠肺組織病理改變
4 小鼠體重變化情況以及與血清IL-1β的相關性
各組小鼠在實驗過程中均全部存活,以體重變化率作為評估病情嚴重程度及預后的指標。空白對照組小鼠進食、活動如常,實驗結束時體重平均增加(12.16±2.78)%。MRSA組小鼠在MRSA感染前進食、活動如常,在MRSA感染后出現攝食量下降、活動減少,感染 24 h體重平均下降(5.61±1.47)%。H1N1+MRSA組小鼠在甲流病毒感染后毛色無光澤、攝食量下降、活動減少,在MRSA繼發感染后攝食量下降及活動減少明顯加重,實驗過程體重平均下降(26.29±2.22)%。H1N1+MRSA組小鼠在MRSA繼發感染24 h后體重平均下降(9.00±5.45)%,高于MRSA組的感染24 h后的體重下降率,但差異沒有統計學顯著性(P>0.05)。MRSA組與H1N1+MRSA組小鼠總體重下降率均與血清IL-1β呈負相關(r分別為-0.951與-0.953,P <0.05),見圖5。
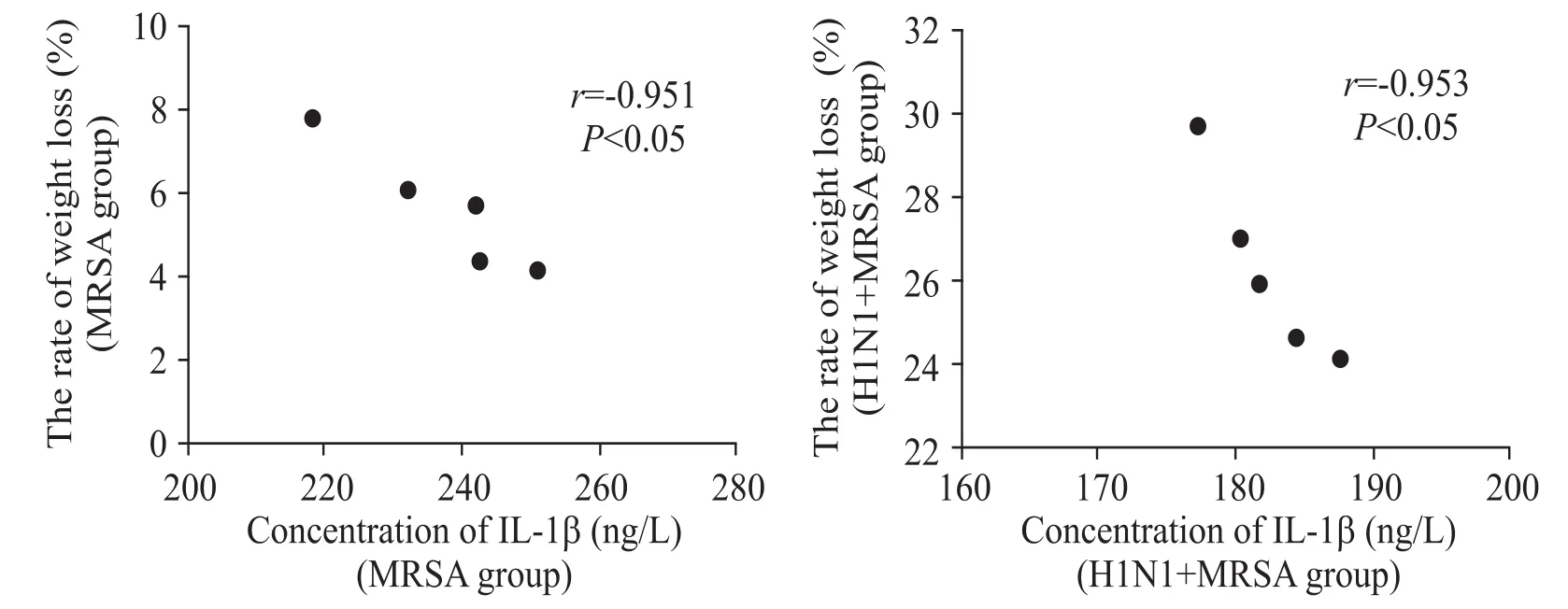
Figure 5.Scatter plots of correlation between the rate of weight loss and the serum concentration of IL-1β.n=5.圖5 小鼠體重下降率與血清IL-1β濃度相關性的散點圖
討 論
甲流病毒和MRSA均是常見的致病菌,可分別感染或聯合感染機體引起支氣管炎和肺炎等呼吸系統疾病。臨床觀察發現,甲流病毒感染1周時易繼發金黃色葡萄球菌肺炎,其中繼發MRSA肺炎的病例死亡率可高達60%,是甲流病毒感染導致臨床死亡的主要原因[1,12-13]。預防或早期阻斷繼發性MRSA肺炎對減輕甲流病毒感染的病情及降低病死率有重要意義。
模式識別受體中的Toll樣受體(Toll like recep-tor,TLRs)、NOD樣受體(NOD like receptor,NLRs)獨立或相互協同地介導抗甲流病毒及抗MRSA免疫作用。NLRP3炎癥小體是由NLRP3、凋亡相關斑點樣蛋白與半胱天冬酶1組成的三聚體,在感染及非感染引起的炎癥反應中均起重要作用[14-15]。NLRP3炎癥小體在抗感染免疫中通過兩種信號通路起作用。信號通路1為TLR-NF-κB信號途徑,轉錄、翻譯生成NLRP3、caspase-1以及白細胞介素1β前體(pro-IL-1β)。信號通路2為NLRP3炎癥小體三聚體形成并生成cleaved-caspase-1,后者剪切pro-IL-1β為IL-1β。IL-1β介導下游的炎癥反應及病原體清除,在抗感染免疫中起重要保護作用[16]。
國內外關于NLRP3炎癥小體與MRSA感染關系的研究較少。Muller等[17]研究發現從MRSA提純的肽聚糖可激活NLRP3炎癥小體。本研究發現MRSA感染引起IL-1β的mRNA表達及血清濃度升高,組織病理見到肺炎改變,小鼠體重下降。已知IL-1β是促進炎癥反應的重要細胞因子,我們推斷IL-1β參與了MRSA肺炎的致病機制。但MRSA組NLRP3、caspase-1的mRNA及其蛋白表達量均沒有增加,表明MRSA感染引起的IL-1β的轉錄及分泌并不依賴NLRP3炎癥小體途徑。已有研究證實IL-1β的產生除了經典的TLR-NF-κB-NLRP3炎癥小體信號途徑,其他一些絲氨酸蛋白酶信號途徑也能激活產生IL-1β[18-19]。Kremserova等[20]研究發現 MRSA 感染中性粒細胞引起的IL-1β釋放經由RIPK3途徑,不依賴NLRP3及caspase-1的活化。Richa等[21]發現金黃色葡萄球菌感染中樞神經系統由凋亡相關斑點樣蛋白而不是由NLRP3介導炎癥反應及保護作用。上述研究支持并部分解釋了本研究結果,但IL-1β在MRSA肺炎中的作用及機制還需要進一步的研究。
早期大量研究證實甲流病毒感染可激活NLRP3炎癥小體并引起IL-1β的產生和分泌[3]。甲流病毒預感染繼發MRSA肺炎小鼠NLRP3和caspase-1的表達比空白對照組升高考慮是由甲流病毒感染引起的。進一步分析實驗結果,H1N1+MRSA組與MRSA組相比,雖然NLRP3和caspase-1的mRNA及其蛋白表達量均增強,但IL-1β的mRNA表達及血清濃度均降低。該結果表明甲流病毒預感染雖然激活了NLRP3與caspase-1,但總體上降低了MRSA感染引起的IL-1β的表達,提示甲流病毒預感染抑制了機體抗MRSA感染免疫的IL-1β的上游信號通路。如可能的機制為甲流病毒預感染激活NLRP3炎癥小體信號通路1的TLR17,競爭性抑制了巨噬細胞抗MRSA免疫的TLR2和TLR4信號通路,總體上降低了巨噬細胞對MRSA的免疫反應。針對NLRP3、caspase-1與IL-1β在甲流病毒預感染后聯合感染金黃色葡萄球菌中表達分離的現象,Robinson等[9]研究NLRP3炎癥小體上游信號途徑發現,其是由甲流病毒預感染抑制了NF-κB并引起pro-IL-1β的產生降低引起的,該結果與本實驗結果相符。
IL-1β是病原體清除所必要的炎癥細胞因子,在甲流病毒感染繼發MRSA肺炎的抗感染中起保護作用[9,22]。Shirey等[23]研究發現甲流病毒感染1周可抑制機體產生干擾素β及其下游的炎癥細胞因子,從而抑制機體的免疫狀態并導致繼發性細菌感染。與之相似的,本研究發現H1N1+MRSA組小鼠血清IL-1β濃度較MRSA組低,但肺組織病理的炎癥反應更加嚴重,聯合感染時間內體重下降更明顯。分析H1N1+MRSA組及MRSA組體重下降率與IL-1β血清濃度相關性發現,體重下降率與IL-1β血清濃度成負相關。在H1N1+MRSA組小鼠在MRSA感染24 h的體重平均下降率與MRSA組小鼠的體重平均下降率比較中,前者高于后者,但差異沒有統計學意義,考慮是由H1N1+MRSA組數據離散(標準差大)引起的,判斷增加小鼠的樣本量將發現統計學差異,兩組間體重下降率仍反映肺炎嚴重程度的差異。歸納上述分析,甲流病毒預感染抑制了機體抗MRSA感染的IL-1β的表達及分泌,導致了嚴重的MRSA肺炎及不良預后,該效應可能是繼發于甲流病毒感染的MRSA肺炎更為嚴重的機制之一。
綜上所述,本研究關注甲流病毒感染繼發MRSA肺炎,發現MRSA感染引起IL-1β的產生和釋放不依賴NLRP3炎癥小體途徑,而甲流病毒預感染雖然上調NLRP3炎癥小體的表達,但總體降低了機體抗MRSA免疫的IL-1β的表達及分泌,該效應可能是甲流病毒感染易繼發MRSA肺炎并引起重癥感染的機制之一。本研究為以NLRP3炎癥小體作為靶點防治甲流病毒感染繼發MRSA肺炎的免疫治療增加了理論依據。

