異食癖對哺乳期犢牛腸道黏膜通透性及免疫因子表達的影響
陳林,楊靖,崔巧榮,徐曉鋒
(寧夏大學農學院,銀川750021)
0 引 言
由于生活環境和營養物質的變化,新生犢牛的機體容易發生許多應激反應。異食癖可導致新生牛犢的代謝紊亂,味覺異常。異食癖犢牛容易咀嚼或食入非營養性物質,舔食牛毛、沙子等異物。異物進入消化道,導致消化系統紊亂,影響腸黏膜屏障,導致腸道通透性增加,增加犢牛腹瀉率。根據研究報告,腸道是機體應激反應的中樞器官之一[1]。然而,隨著分子生物學研究的發展,腸道不僅是營養物質消化吸收的主要場所,也是體內重要的免疫屏障。腸黏膜在維持腸道穩定中具有重要的作用,其結構和功能形成腸粘膜免疫系統,保護機體健康。腸黏膜屏障由腸黏膜機械屏障、化學屏障、生物屏障和免疫屏障組成[2];并且腸上皮細胞和腸緊密連接蛋白在腸黏膜屏障中起重要作用[3-5]。腸緊密連接蛋白與三種主要連接蛋白連接在一起,即腸道緊密連接蛋白-1(ZO-1)、咬合蛋白(Occludin)、閉合蛋白(Claudin)[6-9]。它們之間的緊密聯系可以防止內毒素和其他有害細菌入侵腸道,維持腸道環境,保護機體健康。如果內毒素和有害細菌進入腸道,就會引起腸道細菌紊亂,使腸道黏膜屏障受損,腸道通透性增加。研究表明腸道通透性增加可能會影響氨基酸、蛋白質、脂類、碳水化合物和其他營養素的吸收和代謝,容易引發腹瀉等疾病[10]。ZO-1與維持和調節上皮柵欄和屏障功能有關,還參與調節細胞物質轉運,維持上皮極性等重要過程。Occludin功能涉及細胞間黏附、移動及通透性,一旦發生變異、減少和缺失可引起腸上皮細胞間隙通透性增加,故Occludin和ZO-1常被用來作為觀察各種組織緊密連接屏障功能和通透性功能的指標[11]。研究顯示,緊密連接蛋白的異常表達,直接影響腸黏膜屏障功能[12]。本試驗通過Real-time PCR,探討了異食癖對哺乳期犢牛腸道緊密連接蛋白表達的影響,為研究犢牛腸黏膜屏障的作用提供理論依據。
1 材料與方法
1.1 試驗設計與動物
采用完全隨機區組方差分析的試驗方法,選擇出生3天,體重相近的犢牛(54.7±5.83 kg)作為研究對象,根據犢牛舔食牛毛、沙子等癥狀,犢牛表現為被毛粗亂、消瘦,不做任何干預治療,在犢牛出生后21 d選擇持續具有異食癖的12頭犢牛做為試驗組(異食癖組),健康,無食牛毛、沙子等癥狀的12頭犢牛作為對照組,整個試驗周期持續到斷奶(56 d)。
1.2 試驗日糧及飼養管理
在犢牛出生后及時消除口腔和鼻孔內的黏液,用消毒的剪刀剪斷臍帶并進行藥浴處理,擦干被毛,飼喂初乳。出生后1 h內飼喂1.5~2.0 kg的初乳,以后隨著食欲的增加而逐漸提高飼喂量,于每日07:00和18:00飼喂混合牛奶,自由飲水和采食開食料,在犢牛能夠站立時,將其移入犢牛島(1.5 m×3.0 m)進行飼養,試驗階段對犢牛島進行定期消毒處理。其中開食料組成及營養水平見表1。
1.3 犢牛樣品采集
整個試驗周期持續到斷奶(56 d),試驗結束后,每組隨機選取5頭進行屠宰,將犢牛的十二指腸組織取出,用冷卻后的生理鹽水沖洗腸段中的食糜,沖洗后將腸段剪成約2 cm的小段放入離心管內,液氮中過夜,-80℃保存備用。把保存的腸段組織樣品放在用液氮預冷的研缽中研磨成白色粉末,取0.1 g研磨好的組織樣品,加入0.9 mL的滅菌生理鹽水,充分搖勻后,3 000 r/min離心10 min,吸取上清液,-80℃保存。使用時避免反復凍融。
1.4 引物設計與合成
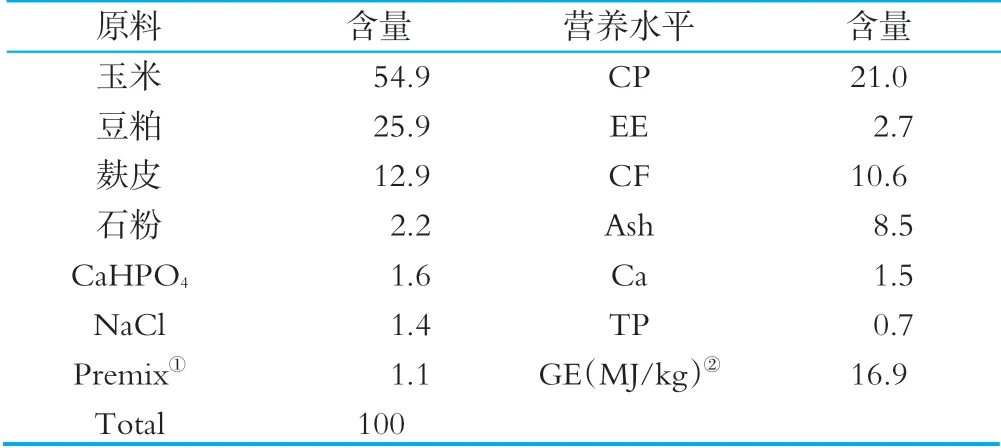
表1 開食料組成及營養水平(干物質基礎) %
采用引物5.0引物設計軟件對奶牛腸黏膜6個基因和β-內參基因序列進行引物設計,引物見表2。

表2 Real-time PCR所用引物
1.5 RNA提取
將采集的樣品移出-80℃,然后用Trizol法提取RNA,步驟如下:
(1)取適量細胞/取適量組織在液氮中充分研磨,加入1 mL Trizol,震蕩混勻室溫放置5 min;
(2)加入0.2 mL氯仿,劇烈震蕩15 s,靜置3 min;
(3)4℃12 000 rpm離心10 min,把上層水相轉移到新的管中;
(4)加入等體積異丙醇,混勻,靜置20 min;4℃12 000 rpm離心10 min,去上清;
(5)用1mL 75%DEPC酒精洗滌沉淀;
(6)4℃8 000 rpm離心5 min,棄去液體;
(7)室溫晾干后,加入30μL DEPC處理過的ddH2O水,溶解RNA,鑒定后于-80℃凍存備用;
(8)取樣液2 uL于2%的瓊脂糖凝膠中電泳。
1.6 cDNA合成的逆轉錄
以1μg總RNA為模板,按照Bestar qPCR RT Kit說明書配制逆轉錄反應體系,總體系為20μL,合成cDNA第一鏈。
1.7 Real-time PCR
用Agilent Stratagene熒光定量PCR儀Mx3000P進行熒光定量PCR試驗,Real-time PCR擴增的反應體系為20μL(表4),PCR反應條件:94℃2 min,94℃20 s,58℃20 s,72℃20 s,40循環。

表3 cDNA合成反應體系

表4 Real-time PCR擴增的反應體系
1.8 統計分析
利用LIVAK和SCHMITTGEN[13]建立的2-△△Ct方法計算腸黏膜屏障蛋白和細胞因子靶向基因的相對表達量,Ct值表示熒光實時定量PCR循環閾值,即擴增過程中每管熒光信號值達到設定閾值時所經歷的循環次數[14]。計算得到相對表達量=2-△△Ct,其中,△Ct=(目的基因Ct-內參Ct)的平均值±標準偏差;△△Ct=(待測樣品中目的基因△Ct-參照樣品中目的基因△Ct)的平均值±標準偏差(若無參照樣品則選擇Ct最大的樣品為參照進行計算);相對樣品初始模板量=(2-△△Ct)的平均值±標準偏差。腸道通透性指數統計分析采用EXCELL 2003和SAS 8.2完全隨機分組方差分析,采用SNK最小顯著性方法比較顯著性差異,以P<0.05為顯著性差異標準。
2 結 果
2.1 Real-time PCR的特異性
通過qRT-PCR擴增后,由圖1可知目的基因和偏好基因的引物可擴增出特異產物,通過離解曲線分析發現,由圖2可知腸黏膜屏障蛋白mRNA和β-肌動蛋白基因的熒光定量產物均為單峰,無其它雜峰,這表明幾乎所有收集到的熒光信號都是用SYBR-GREEN擴增的PCR產物,無其它干擾。
2.2 mRNA的表達水平
通過Real-time PCR方法檢測腸黏膜蛋白mRNA,計算其相對表達量,由表5可知異食癖組犢牛腸黏膜蛋白ZO-1相對表達量顯著低于對照組(P<0.05),Occludin和Claudin相對表達量低于對照組,但差異不顯著(P>0.05)。由表6可知異食癖組犢牛腸道免疫因子TLR 4相對表達量顯著低于對照組(P<0.05),TNF-α和IL-1β相對表達量極顯著高于對照組(P<0.01)。
3 討 論
3.1 異食癖對哺乳期犢牛腸道緊密連接蛋白表達的影響
在本試驗中異食癖組犢牛腸黏膜蛋白ZO-1相對表達量顯著低于對照組,Occludin和Claudin相對表達量低于對照組,但差異不顯著。而ZO-1、Occludin和Claudin是構成細胞間緊密連接的重要蛋白分子,在維持細胞極性和緊密連接屏障功能方面起著重要作用。腸道黏膜上皮屏障是抵抗腸道中病原微生物和有毒物質入侵的第一道防線[15]。緊密連接蛋白(tight junctions,TJ)是構成腸道黏膜屏障、決定腸壁通透性的重要蛋白質分子,對緊密連接的組成和功能發揮有很大影響[16]。
ZO-1,也稱為緊密連接蛋白-1,該基因的編碼位于細胞質膜表面的細胞緊密連接蛋白上。編碼的蛋白質可能參與細胞-細胞連接處的信號轉導。HK-2細胞中Claudin-2,Occludin和ZO-1的消耗對TER(Transepithelial electrical resistance)和大分子通量有不同的影響,證明了Claudin-2,Occludin和ZO-1的整合對于維持近端小管上皮的功能是必需的[17]。Zhang等[8]研究致病性大腸桿菌感染小鼠的模型,發現腸上皮細胞間TJ相關蛋白Occludin由胞膜區易位到胞質內,同時伴有腸上皮細胞旁路滲透性增加,推測Occludin的分布異常可能導致腸上皮屏障功能受損,進而參與腹瀉的發生、發展過程。缺乏緊密連接蛋白Claudin的鼠模型,升高了細胞旁路的溶質流通量,促發了腸道的炎癥發生[18],這些研究表明腸道緊密連接蛋白與腸道滲透性,腸道屏障功能關系密切。在本試驗中異食癖組犢牛腸黏膜蛋白ZO-1相對表達量顯著低于對照組,Occludin和Claudin相對表達量低于對照組,表明患有異食癖的哺乳期犢牛破壞了腸道的緊密連接蛋白的功能,造成了腸道黏膜屏障受損,進而使異食癖犢牛腸道通透性增加。
細胞外Ca2+濃度對TJ的影響與PKC信號通路有關。低鈣條件下培養MDCK(madindarbycaninekindy,MDCK)細胞出現TJ破壞現象,加入PKC激動劑可觀測到Occludin蛋白的磷酸化,并向TJ處移位,重建TJ。此作用可被PKC的抑制劑所抑制[19]。Kale等[20]發現Occludin的酪氨酸磷酸化降低了其結合ZO-1,ZO-2和ZO-3的能力,從而引起TJ的斷裂。與細胞外Ca2+相比,細胞內Ca2+主要改變ZO-1與肌動蛋白的結合,并改變Occludin在細胞內的位置。低氧條件下細胞內Ca2+的短暫升高,鈣調蛋白依賴的激酶等細胞外信號相關激酶的激活,引發級聯反應,從而使Occludin蛋白等TJ相關蛋白在mRNA水平及蛋白表達層面上產生改變,最終引起細胞屏障功能破壞[21]。周景明等[22]研究發現當常量礦物質元素如鈣、磷、鈉、鉀、硫以及微量元素如鋅、鈷、鐵等供給量不足,或各種礦物元素彼此之間的比例失衡時,奶牛就會舔食泥沙、墻壁、飼槽以及啃食金屬,長期喂給大量精料或酸性飼料過多,都可引起體內堿的消耗過多,而致鈣、磷比例失調,也會形成異食癖。眭丹等[23]研究發現銅、鋅、硒缺乏會引起舍飼灘羊異食癖的發生。目前關于動物異食癖的形成機理還不十分清楚,本研究發現異食癖犢牛腸黏膜蛋白ZO-1相對表達量顯著低于對照組犢牛,Occludin和Claudin相對表達量低于對照組,但差異不顯著,異食癖犢牛腸道通透性增加,對犢牛健康尤其腸道健康存在重要影響。
圖1 目標基因和偏好基因的擴增圖
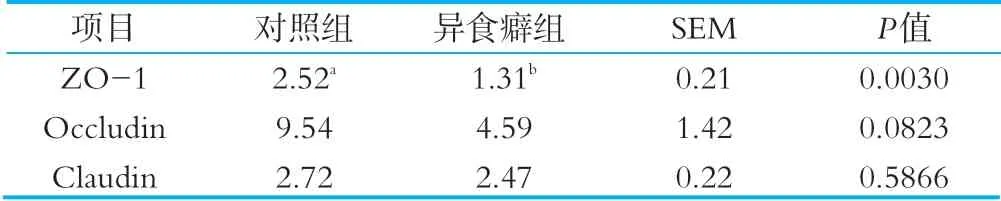
表5 腸道黏膜緊密連接蛋白mRNA相對表達量

表6 腸道免疫因子mRNA相對表達量
3.2 異食癖對哺乳期犢牛腸道免疫因子表達的影響

圖2 目標基因與偏好基因的解離曲線
在本試驗中異食癖組犢牛腸道免疫因子TLR 4相對表達量顯著低于對照組。在腸道中識別非特異的微生物抗原是通過類型識別受體如Toll樣受體家族實現的,Toll樣受體(Toll like receptor,TLR)是一類天然免疫受體,是先天免疫系統重要的組成部分[24],TLR 4是人類發現的第一個TLR相關蛋白,當TLR 4與相應配體結合后,信號轉導到TLR區域,然后進一步激活核因子κB(nuclear factor-κB,NF-κB)和絲裂原活化蛋白激酶信號通路,從而促進各種炎性細胞因子基因表達的激活。TLR 4也是介導內毒素/脂多糖(lipopolysaccharide,LPS)應答的主要受體[25]。Shi等[26]發現,游離脂肪酸可以激活脂肪細胞和巨噬細胞的TLR 4受體,TLR 4缺乏的細胞則游離脂肪酸的炎性作用被阻斷,TLR 4是營養脂類和炎癥之間的分子聯系,參與調節能量平衡和先天免疫系統,以應對營養環境的變化。有研究發現TLR 4缺陷破壞了腸道微生物群,降低了小鼠對肺炎鏈球菌耐藥性[27]。而異食癖組犢牛腸道免疫因子TLR 4相對表達量顯著低于對照組,表明患有異食癖的哺乳期犢牛腸道免疫機能下降。
本試驗中異食癖組犢牛腸道免疫因子TNF-α和IL-1β相對表達量極顯著高于對照組,異食癖犢牛發生腸黏膜炎癥損傷時,炎癥早期最先分泌的促炎細胞因子主要是IL-1β和TNF-α,這些細胞因子可以啟動其他細胞因子的釋放[28]。TNF-α是炎癥反應過程中出現最早、最重要的炎性介質。TNF-α可通過多種方式促進系膜細胞的增殖與分化,并促使系膜細胞分泌多種細胞因子。TNF-α是參與全身性炎癥的細胞信號傳導蛋白(細胞因子),并且是構成急性期反應的細胞因子之一。它主要由活化的巨噬細胞產生,TNF的主要作用是調節免疫細胞。研究表明TNF-α可能通過激活NF-κB,增加肌球蛋白輕鏈激酶(myosin light chain kinae,MLCK)的轉錄及表達,MLCK又激活MLC,引起肌動和肌球蛋白收縮,進而增加Occludin等跨膜蛋白的內吞作用[29],減少其在TJ上的定位,導致屏障功能失調[30]。本試驗中異食癖組犢牛腸道免疫因子TNF-α相對表達量極顯著高于對照組,說明患有異食癖的哺乳期犢牛腸道通透性增加,降低了機體免疫能力。這與胡丹丹等[31]研究一致。
TNF-α還會消耗細胞內的抗氧化劑谷胱甘肽(GSH)[32]。轉基因小鼠中TNF-α的過度表達通過消耗總細胞谷胱甘肽水平誘導氧化還原狀態和谷胱甘肽調節酶的差異變化[33]。體外研究還證明TNF-α消耗細胞GSH水平。用TNF-α處理人肺動脈內皮細胞降低了細胞的GSH水平[34],這種谷胱甘肽的消耗增強了內皮細胞對氧中毒的易感性[35]。胡丹丹等[31]研究表明患有異食癖的犢牛抗氧化能力較弱。本試驗中異食癖犢牛腸道免疫因子TNF-α相對表達量極顯著高于對照組,表明異食癖犢牛TNF-α消耗了細胞內的GSH,患有異食癖的哺乳期犢牛抗氧化能力較弱。
TNF-α可促進IL-1β的分泌與釋放,參與機體內的炎癥反應和發熱反應[36]。IL-1β是白介素1細胞因子家族的成員。該細胞因子由活化的巨噬細胞作為前蛋白產生,其通過半胱天冬酶1(CASP1/ICE)蛋白水解加工成其活性形式。該細胞因子是炎癥反應的重要介質,參與多種細胞活動,包括細胞增殖、分化和凋亡。IL-1β的產生增加引起許多不同的自身炎癥綜合征,最明顯的是由于炎性體受體NLRP3的突變引起IL-1β的加工而被稱為Cryopyrin相關的周期綜合征(CAPS)的單基因條件[37]。AlSadi等[19]發現IL-1β導致腸上皮TJ通透性增加,IL-1β可能通過降解I-κB,激活了NF-κB,進而抑制Occludin蛋白轉錄啟動子的活性,導致Occludin的mRNA表達量下降,破壞了TJ的功能。本試驗中異食癖組犢牛腸道免疫因子IL-1β相對表達量極顯著高于對照組,表明患有異食癖的哺乳期犢牛引起了腸道的炎癥反應,進而造成了機體免疫力下降。
4 結 論
患有異食癖的哺乳期犢牛腸黏膜蛋白ZO-1相對表達量顯著低于對照組,腸道通透性增加。患有異食癖的哺乳期犢牛腸道免疫因子TLR 4相對表達量顯著低于對照組,腸道免疫因子TNF-α和IL-1β相對表達量極顯著高于對照組,異食癖犢牛腸道免疫因子表達下調,腸道黏膜炎癥因子表達上調,腸道抗氧化能力減弱。

