骨肽原液促UMR106細(xì)胞增殖法的建立及驗(yàn)證
吳彥霖,張 媛,楊澤岸,胡文言,高 華
(1.中國(guó)食品藥品檢定研究院化學(xué)藥品檢定所藥理室, 北京 102629; 2.中國(guó)生化制藥工業(yè)協(xié)會(huì),北京 100068)
骨肽是從新鮮或冷凍的豬、鹿或胎牛骨提取,加工制成的具有活性的多組分生化藥[1-2],骨肽類藥物主要成分含有骨形成蛋白(bone morphogenetic protein,BMPs)等多種多肽類骨代謝活性因子,以及多種骨修復(fù)所需的無(wú)機(jī)元素、氨基酸及微量元素等[3]。骨肽類藥物臨床上主要用于骨質(zhì)疏松、骨質(zhì)增生、骨折及類風(fēng)濕性關(guān)節(jié)炎等疾病治療,具有刺激成骨細(xì)胞增殖,促進(jìn)新骨形成,調(diào)節(jié)鈣磷代謝,抗炎鎮(zhèn)痛等藥理作用[4-5]。骨肽原液是骨肽類藥物的原料,具有組分復(fù)雜,活性成分不明確的特點(diǎn),現(xiàn)行的骨肽類藥物質(zhì)量標(biāo)準(zhǔn)收載于國(guó)家標(biāo)準(zhǔn)地升部十六冊(cè),采用理化方法進(jìn)行質(zhì)量控制,不能有效反映其多組分、多靶點(diǎn)的臨床療效[6],因此建立關(guān)聯(lián)臨床功效的生物活性測(cè)定方法作為其質(zhì)量控制的方法更為合理。
大鼠骨肉瘤細(xì)胞UMR106在形態(tài)和性質(zhì)上保留有成骨細(xì)胞的特征,在研究中被用來(lái)代替成骨細(xì)胞,是一種國(guó)際公認(rèn)的成骨樣細(xì)胞,也是研究骨代謝調(diào)控較好的模式細(xì)胞[7-9]。建立骨肽原液生物活性測(cè)定方法-大鼠骨肉瘤UMR106細(xì)胞增殖實(shí)驗(yàn),確定骨肽原液的限值,依據(jù)正交實(shí)驗(yàn)確定方法的影響因素,并參照2015年版《中國(guó)藥典》9101 藥品質(zhì)量標(biāo)準(zhǔn)分析方法驗(yàn)證指導(dǎo)原則和9105中藥生物活性測(cè)定指導(dǎo)原則進(jìn)行方法學(xué)驗(yàn)證[10]。
基于上述目的,建立骨肽原液生物活性測(cè)定方法研究包括:1)建立UMR106細(xì)胞增殖實(shí)驗(yàn)方法;2)正交試驗(yàn)優(yōu)化實(shí)驗(yàn)條件,確定實(shí)驗(yàn)方案;3)對(duì)建立的骨肽原液促UMR106細(xì)胞增殖實(shí)驗(yàn)進(jìn)行方法學(xué)驗(yàn)證;4)對(duì)13個(gè)廠家共39批次的骨肽原液進(jìn)行實(shí)驗(yàn),依據(jù)實(shí)驗(yàn)結(jié)果制定相應(yīng)的限值和判斷標(biāo)準(zhǔn)。
1 材料與方法
1.1 細(xì)胞株大鼠骨肉瘤細(xì)胞株UMR106,購(gòu)于中國(guó)協(xié)和醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院細(xì)胞中心。
1.2 儀器CKX 41倒置顯微鏡(日本Olympus公司);1389 A2生物安全柜(美國(guó)Thermo Fisher公司);3141 CO2培養(yǎng)箱(美國(guó)Thermo Fisher公司);6R離心機(jī)(美國(guó)Beckman Coulter公司):Z2細(xì)胞計(jì)數(shù)儀(美國(guó)Beckman Coulter公司);SYNERGY HT酶標(biāo)儀(美國(guó)Biotek公司)。
1.3 試劑及樣品胎牛血清(fetal bovine serum,F(xiàn)BS)、含谷氨酰胺的DMEM高糖培養(yǎng)基(Glutamine+, Glu+)、不含谷氨酰胺的DMEM高糖培養(yǎng)基(Glutamine-, Glu-)、胰酶均購(gòu)自Gibco公司,批號(hào)分別為1989478、2044404、1998036、2053591;磷酸鹽緩沖液(phosphate buffered saline, PBS)購(gòu)自Hyclone公司,批號(hào)AD20616267;CCK-8購(gòu)自東仁化學(xué)科技(上海)有限公司,批號(hào)NN707。 骨肽原液生產(chǎn)廠家及批號(hào)見(jiàn)Tab 1。
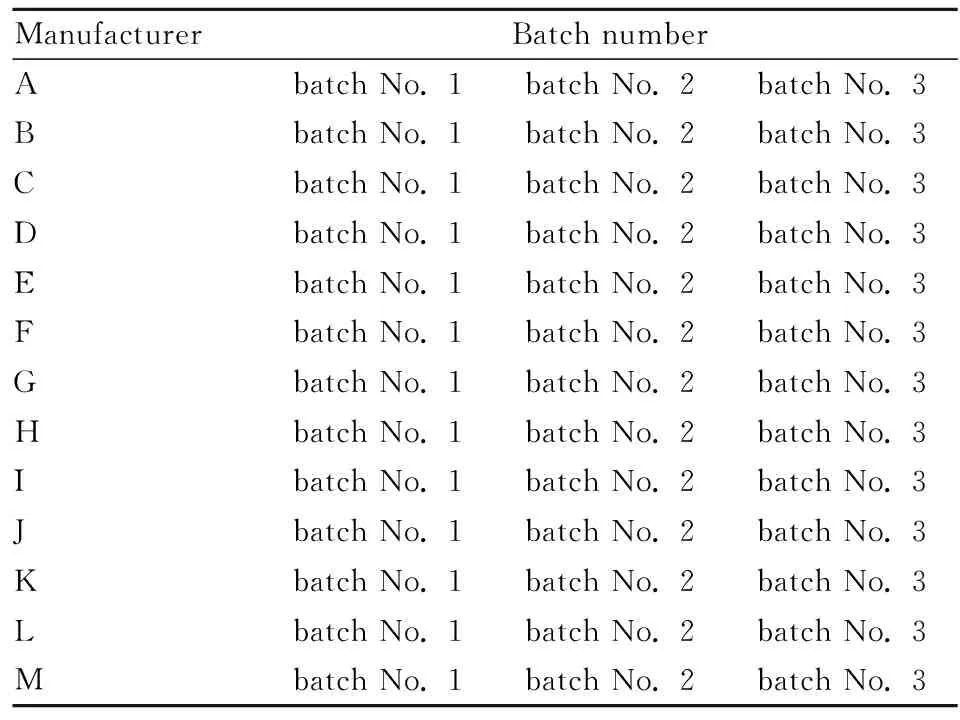
Tab 1 Manufacturer and batch number of bone peptide
1.4 溶液配制生長(zhǎng)培養(yǎng)基:用DMEM高糖培養(yǎng)基(Glu+)配制含10%FBS的溶液;工作培養(yǎng)基:用DMEM高糖培養(yǎng)基(Glu-)分別配制含1%、5%、10%的FBS溶液,上述溶液4 ℃保存?zhèn)溆谩?/p>
骨肽的樣品稀釋液:用工作培養(yǎng)基配將骨肽原液稀釋為0.06、0.125、0.25、0.5、1.0、2.0 g·L-1的溶液,臨用現(xiàn)配。
1.5 細(xì)胞傳代取對(duì)數(shù)生長(zhǎng)期UMR106細(xì)胞融合度達(dá)到90%進(jìn)行傳代,吸棄瓶中培養(yǎng)基,取10 mL PBS清洗1遍,加2 mL 0.25% Trypsin置CO2培養(yǎng)箱中消化30 s,加10 mL生長(zhǎng)培養(yǎng)基終止消化,吹落培養(yǎng)瓶上貼壁細(xì)胞,將細(xì)胞懸液移至15 mL離心管中,充分混勻,1 000 r·min-1離心5 min,離心后盡量除去上清液,加入1 mL生長(zhǎng)培養(yǎng)基,輕輕吹打混勻細(xì)胞沉淀。將細(xì)胞懸液按1 ∶5比例接種至T75培養(yǎng)瓶中,放入37 ℃、5% CO2培養(yǎng)箱中孵育。
1.6 骨肽原液致UMR106細(xì)胞增殖方法建立將2.2消化后的細(xì)胞用PBS洗2次,每次1 000 r·min-1離心5 min,用工作培養(yǎng)基稀釋細(xì)胞至所需濃度,每孔100 μL接種于96孔細(xì)胞培養(yǎng)板。37 ℃,5% CO2培養(yǎng)24 h。棄去孔內(nèi)完全培養(yǎng)基,每孔加入骨肽的樣品稀釋液,設(shè)不加細(xì)胞的孔為完全空白組,陰性對(duì)照組(等量PBS代替藥物體積)。繼續(xù)培養(yǎng)72 h后使用CCK-8法進(jìn)行測(cè)定細(xì)胞增殖率,實(shí)驗(yàn)操作參照試劑盒說(shuō)明書(shū)。
細(xì)胞增殖率/% =(供試品組A值-完全空白組A值)/(陰性對(duì)照組A值-完全空白組A值)×100%
1.6.1線性范圍和最低檢測(cè)限 取2.3細(xì)胞,調(diào)整細(xì)胞密度為2 000 個(gè)/孔,用1% FBS工作培養(yǎng)基將廠家B(batch No. 1)和C(batch No. 1)骨肽原液配制為2.1的濃度,每孔分別加入對(duì)應(yīng)的組別藥物100 μL,作用48 h、72 h后計(jì)算細(xì)胞增殖率[7-9],以細(xì)胞增殖率評(píng)價(jià)骨肽原液促UMR106細(xì)胞增殖活性,確定最低檢測(cè)限。
1.6.2正交實(shí)驗(yàn)確定影響因素 選用廠家B(batch No. 1)的骨肽原液樣品進(jìn)行正交實(shí)驗(yàn),正交設(shè)計(jì)方案:采用L9 (33)正交表,以3因素3水平正交實(shí)驗(yàn)為考察條件進(jìn)行實(shí)驗(yàn),具體見(jiàn)Tab 2和Tab 3。響應(yīng)值為細(xì)胞增殖百分率。 正交實(shí)驗(yàn)設(shè)計(jì)表如下表所示。

Tab 2 Factors and levels of orthogonal experiment
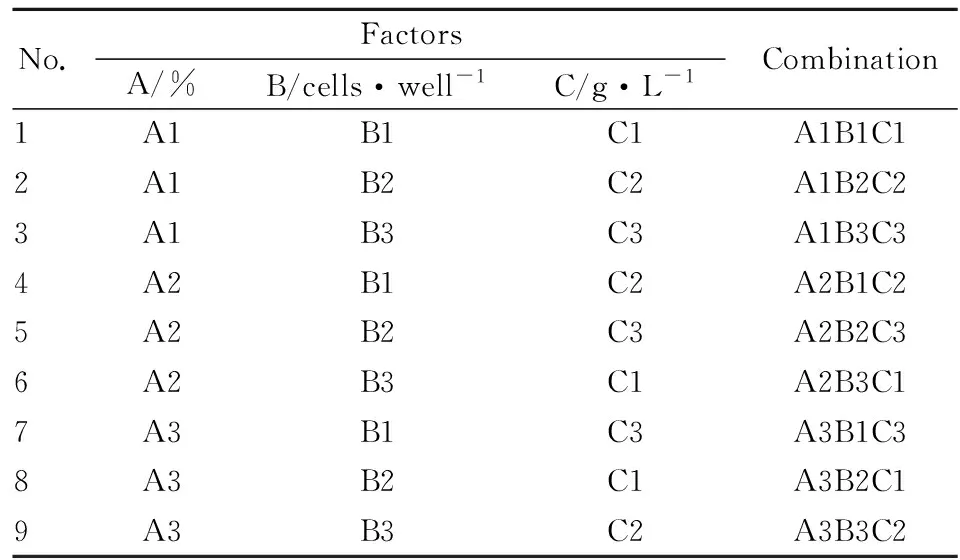
Tab 3 Arrangement of orthogonal experiment
1.7 方法學(xué)驗(yàn)證[10]
1.7.1重復(fù)性 參考2.3.2正交實(shí)驗(yàn)結(jié)果,選用廠家B(batch No. 1)的骨肽原液樣品進(jìn)行重復(fù)性檢驗(yàn),按實(shí)驗(yàn)方案:樣品濃度為1.0 g·L-1,培養(yǎng)基血清含量為2.5% FBS,鋪板細(xì)胞數(shù)量為5 000 個(gè)/孔。進(jìn)行3次獨(dú)立試驗(yàn),統(tǒng)計(jì)結(jié)果并進(jìn)行評(píng)價(jià)。
1.7.2中間精密度 選用廠家B(bath No. 1)的骨肽原液樣品進(jìn)行中間精密度檢驗(yàn),3名實(shí)驗(yàn)人員按實(shí)驗(yàn)方案:骨肽原液樣品濃度為1.0 g·L-1,培養(yǎng)基血清含量為2.5% FBS,鋪板細(xì)胞數(shù)量為5 000 個(gè)/孔。分別進(jìn)行獨(dú)立試驗(yàn),統(tǒng)計(jì)結(jié)果并進(jìn)行評(píng)價(jià)。
1.7.3耐用性 選用廠家B(bath No. 1)的骨肽原液樣品進(jìn)行中間精密度耐用性檢驗(yàn),分別考察實(shí)驗(yàn)中一些測(cè)定條件的微小變化,包括:不同細(xì)胞鋪板密度:4 500、5 000、5 500 個(gè)/孔;96孔細(xì)胞培養(yǎng)板上藥物作用于不同位置;藥物作用時(shí)間:68、72、76 h。測(cè)定結(jié)果不受影響,以確保方法的可靠性。
1.8 限值及判斷標(biāo)準(zhǔn)的制定取2.3細(xì)胞,將13個(gè)生產(chǎn)廠家共39批骨肽原液,每孔加入100 μL含1.0 g·L-1骨肽的樣品稀釋液,繼續(xù)培養(yǎng)72 h后測(cè)定細(xì)胞增殖率。以樣品合格率>60%作為界限,制定骨肽原液的判斷標(biāo)準(zhǔn)。
2 結(jié)果
2.1 建立骨肽原液致UMR106細(xì)胞增殖方法
2.1.1線性及最低檢測(cè)限 骨肽原液藥物濃度在0.06~2.0 g·L-1范圍內(nèi)對(duì)UMR106細(xì)胞的影響見(jiàn)Fig 1。廠家B(batch No. 1)和C(batch No. 1)的骨肽原液對(duì)UMR106細(xì)胞有促進(jìn)增殖作用,在48~72 h、0.06~1.0 g·L-1范圍內(nèi)對(duì)UMR106細(xì)胞增殖作用呈時(shí)間-劑量依賴性,但廠家C的骨肽原液在48 h的2.0 g·L-1濃度劑量增殖呈下降趨勢(shì),骨肽原液對(duì)UMR106細(xì)胞增殖的最低檢測(cè)限為0.06 g·L-1。
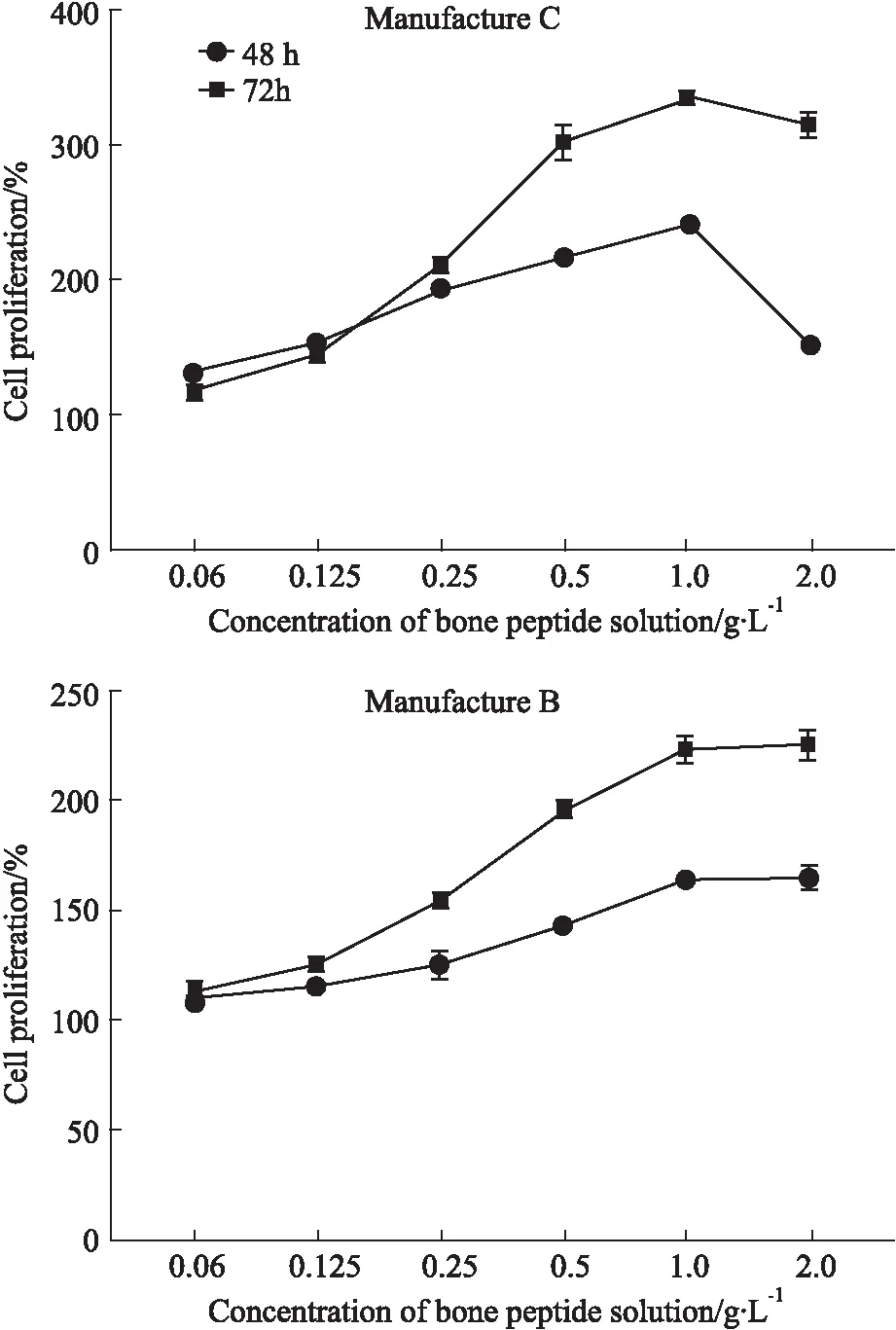
Fig 1 UMR106 cell proliferation of bone peptide solution, manufacturers B and C n=2)
2.1.2正交實(shí)驗(yàn)結(jié)果 根據(jù)2.3.2計(jì)算正交試驗(yàn)結(jié)果,在促UMR106細(xì)胞增殖實(shí)驗(yàn)的3個(gè)因素影響程度是:骨肽原液濃度>培養(yǎng)基血清含量>細(xì)胞數(shù)量。結(jié)合顯微鏡下細(xì)胞形態(tài)的分析結(jié)果,確定骨肽生物活性測(cè)定方法-UMR106細(xì)胞增殖實(shí)驗(yàn)方案為:骨肽原液濃度為1.0 g·L-1,工作培養(yǎng)基血清含量為2.5% FBS,鋪板細(xì)胞數(shù)量為5 000 個(gè)/孔。
2.2 方法驗(yàn)證結(jié)果
2.2.1重復(fù)性結(jié)果 1名檢驗(yàn)人員獨(dú)立對(duì)廠家B(bath No. 1)的骨肽原液樣品進(jìn)行3次實(shí)驗(yàn),UMR106細(xì)胞增殖率均值為247%,RSD=13%,表明此方法的重復(fù)性良好,結(jié)果見(jiàn)Tab 4。

Tab 4 Repeatability for UMR106 cell proliferation experiment (n=4,%)
2.2.2中間精密度結(jié)果 3名實(shí)驗(yàn)人員對(duì)廠家B(batch No. 1)的骨肽原液樣品進(jìn)行1次實(shí)驗(yàn),按確定方案測(cè)定UMR106細(xì)胞增殖率,增殖率均值為261%,RSD=16%,表明此方法的中間精密度良好,見(jiàn)Tab 5。

Tab 5 Intermediate precision for UMR106 cell proliferation experiment (n=3,%)
2.2.3耐用性結(jié)果 對(duì)廠家B(batch No. 1)的骨肽原液樣品,按確定方案測(cè)定UMR106細(xì)胞增殖率,結(jié)果表明:1)不同細(xì)胞鋪板密度條件下,增殖率均值為224%,RSD=2%;2)96孔細(xì)胞培養(yǎng)板上藥物作用于不同位置條件下,增殖率均值為214%,RSD=5%;3)藥物作用不同時(shí)間條件下,增殖率均值為208%,RSD=8%(Tab 6~8)。
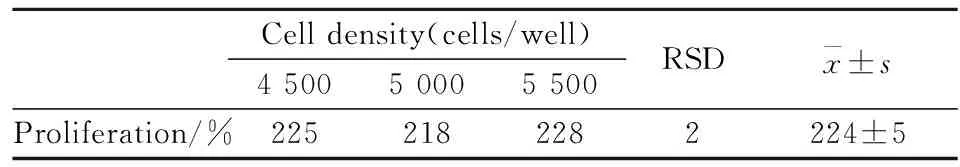
Tab 6 Durability for UMR106 cell proliferation experiment (different cell density) (%)

Tab 7 Durability for UMR106 cell proliferation experiment (cell plates in different positions of 96 well) (%)

Tab 8 Durability for UMR106 cell proliferation experiment (drug treated time)
2.3 限值及判定標(biāo)準(zhǔn)的確定13個(gè)生產(chǎn)廠家39批骨肽原液中,有8個(gè)廠家的骨肽原液促UMR106細(xì)胞增殖率≥150%,5個(gè)廠家的骨肽原液促UMR106細(xì)胞增殖率<150%(Tab 9)。
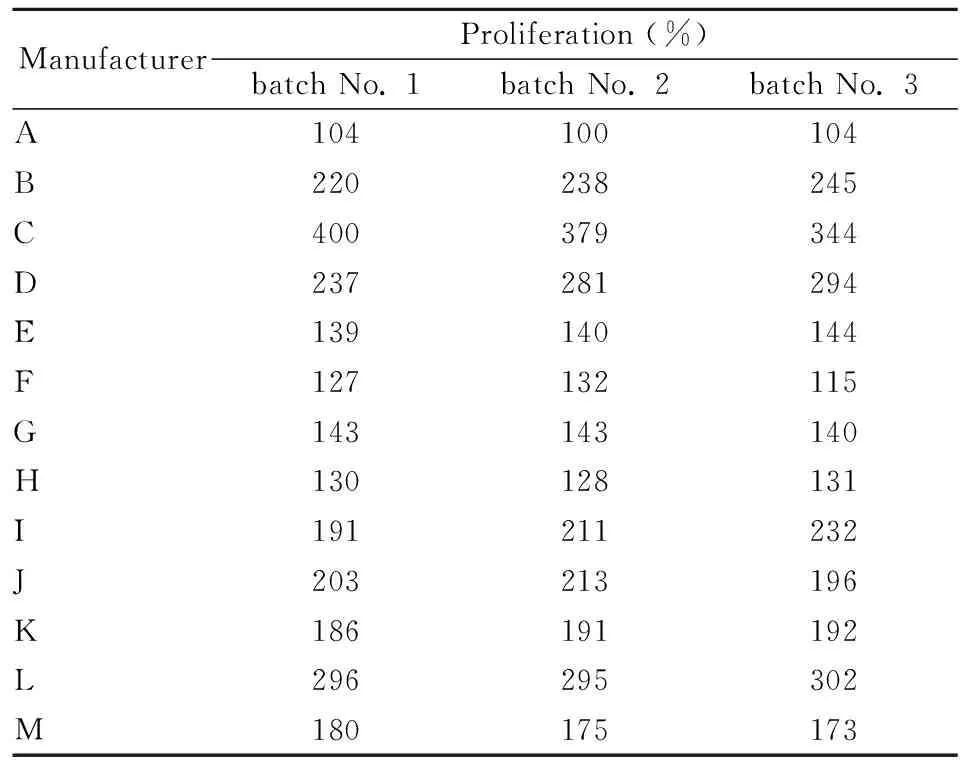
Tab 9 Proliferation of UMR106 cells by 13 manufacturers (n=6)
3 討論
3.1 質(zhì)量標(biāo)準(zhǔn)和限值建立骨肽原液致UMR106細(xì)胞增殖實(shí)驗(yàn)方法,并參照2015年版《中國(guó)藥典》9101 藥品質(zhì)量標(biāo)準(zhǔn)分析方法驗(yàn)證指導(dǎo)原則和9105中藥生物活性測(cè)定指導(dǎo)原則,進(jìn)行重復(fù)性、中間精密度、耐用性等方法學(xué)驗(yàn)證[10],結(jié)果表明,骨肽原液促UMR106細(xì)胞增殖法重復(fù)性、中間精密度和耐用性良好,實(shí)驗(yàn)中一些測(cè)定條件的微小變化不會(huì)影響細(xì)胞增殖率,此方法可靠。且該方法操作簡(jiǎn)單,實(shí)驗(yàn)測(cè)定結(jié)果穩(wěn)定,測(cè)定指標(biāo)與骨肽類制劑藥物的治療作用密切相關(guān),可作為骨肽原液的質(zhì)量評(píng)價(jià)方法。
結(jié)合3.3實(shí)驗(yàn)結(jié)果得出骨肽原液致UMR106細(xì)胞增殖實(shí)驗(yàn)的結(jié)論,以1.0 g·L-1骨肽原液藥物濃度作為限值劑量,增殖率≥150%作為符合規(guī)定的判定標(biāo)準(zhǔn),樣品合格率>60%,限值劑量及判斷標(biāo)準(zhǔn)制定較合理,其中E、F兩個(gè)廠家促UMR106細(xì)胞增殖率接近150%,屬于邊緣產(chǎn)品。13個(gè)生產(chǎn)廠家骨肽原液不同批次間實(shí)驗(yàn)結(jié)果一致,表明實(shí)驗(yàn)方法適用性較好,故可作為骨肽原液生物活性測(cè)定方法,以更好的控制產(chǎn)品質(zhì)量。
3.2 骨形成的階段骨形成的過(guò)程主要涉及四個(gè)階段:骨形成初期成骨細(xì)胞數(shù)量明顯增加,而后進(jìn)入成骨細(xì)胞分化階段,細(xì)胞外基質(zhì)成熟,骨特征性蛋白表達(dá),促進(jìn)并參與基質(zhì)礦化,最終完成骨形成。 成骨細(xì)胞的數(shù)量決定骨形成的最初速度,大鼠骨肉瘤細(xì)胞UMR106在形態(tài)和性質(zhì)上保留有成骨細(xì)胞的特征,在骨肽類制劑成骨研究中具有代表性[7-9]。骨肽類制劑的臨床藥理作用有刺激成骨細(xì)胞增殖,促進(jìn)新骨形成,調(diào)節(jié)鈣磷代謝,增加骨鈣沉淀及抗炎、鎮(zhèn)痛等。臨床上主要用于骨質(zhì)疏松癥、骨質(zhì)增生性疾病、骨折及類風(fēng)濕性關(guān)節(jié)炎等治療。成分復(fù)雜、活性成分不明確的骨肽類制劑生物活性評(píng)價(jià)方法的建立應(yīng)以其最主要的臨床治療功效作為靶點(diǎn),進(jìn)行方法學(xué)研究,因此筆者選擇骨形成中成骨作用進(jìn)行了上述研究。
Glu是細(xì)胞培養(yǎng)基中常用的添加物,但在UMR106 細(xì)胞增殖實(shí)驗(yàn)中,Glu的存在對(duì)結(jié)果存在影響。因此在使用該法對(duì)同類多組分藥物進(jìn)行生物活性評(píng)價(jià)研究時(shí),筆者建議應(yīng)考慮樣品中的Glu含量對(duì)實(shí)驗(yàn)的干擾作用。
- 中國(guó)藥理學(xué)通報(bào)的其它文章
- 基于網(wǎng)絡(luò)藥理學(xué)和分子對(duì)接法探索麻杏甘石湯治療新型冠狀病毒肺炎(COVID-19)活性化合物的研究
- 奧曲肽治療TNBS致大鼠潰瘍性結(jié)腸炎及其機(jī)制研究
- 黑骨藤提取物中3種活性成分在AA模型大鼠體內(nèi)的藥代動(dòng)力學(xué)研究
- 5-Aza-CdR促進(jìn)小鼠海馬神經(jīng)細(xì)胞HT22自噬增加通過(guò)啟動(dòng)TSC1/mTOR通路
- 3-取代吲哚酮類抗癌藥物對(duì)抗神經(jīng)退行性疾病之進(jìn)展
- 性別差異對(duì)大鼠佐劑性關(guān)節(jié)炎模型的影響

