三種植物線粒體基因低溫差異表達比較分析
王賽賽 李錦 祝建波

摘 要:線粒體作為植物細胞的能量代謝中心,在植物響應逆境脅迫中有重要的作用。該研究基于雪蓮(Saussurea involucrata)、番茄(Lycopersicon esculentum)和擬南芥(Arabidopsis thaliana)三種不同低溫耐受性植物的低溫轉錄組。通過blast比對和數據庫檢索篩選相關物種的線粒體基因,使用PlantCARE在線網站分析啟動子,使用mega7軟件對系統發育樹構建分析。結果表明:通過差異表達基因篩選,分別在雪蓮、擬南芥、番茄中篩選出2、24、15個顯著差異表達基因,主要包括線粒體核糖體亞基和電子傳遞鏈各復合體亞基,其中部分基因的低溫差異表達情況如NAD1和NAD5,可能與植物的低溫適應性有關;通過表達模式的聚類分析,雪蓮與擬南芥在基因的表達模式上相對于番茄更為相近,且不同類別的基因表達模式在不同物種間差異較大;雪蓮與其他菊科植物的呼吸鏈相關基因的蛋白序列具有很大差異,與萬年蘚(Climacium dendroides)、牛舌蘚(Anomodon minor)等高山植物的進化距離較近。在整體上擬南芥、番茄和雪蓮三種植物線粒體基因在低溫響應上具有很大差異,表明線粒體基因及其表達調控與植物的低溫耐受性之間存在一定的關聯性。
關鍵詞:低溫耐受性, 植物, 線粒體基因, 表達模式
中圖分類號:Q943
文獻標識碼:A
文章編號:1000-3142(2020)08-1140-11
Abstract:As the energy metabolism center of plant cells, mitochondria play an important role in plant response to stress. To analyze difference in expression mode of mitochdria gene from the Arabidopsis thaliana, Lycopersicon esculentum and Saussurea involucrata, the differential expression genes (DEGs) was filtered in the three low temperature transcriptomes and comparison analysis was performed on the DEGs from three plants. All the mitochondria genes were filtered through blast against the mitochondria genomes that was downloaded from the NCBI database. Promoter analysis was performed through PlantCARE online website and the mega software was used to phylogenetic tree construction. The results were as follows:In total, there were 2, 24 and 15 DEGs were found in Saussurea involucrata, Arabidopsis thaliana and Lycopersicon esculentum, and these genes were mainly focused on mitochondrial ribosomal and electron transfer chain complex subunits; A few genes were seemed to relate to the cold adaptation that the expression level was positive to the ability of cold tolerance of the three plants, especially for the NAD1 and NAD5 gene; Through cluster analysis of expression patterns, Saussurea involucrata and Arabidopsis thaliana were more similar in genes expression mode than Lycopersicon esculentum, and the expression mode of different genes had a quite difference between different plants; Further analysis on the conserved motif sequence of these genes, the sequences of Saussurea involucrata showed more close relationship with the alpine plants such as Climacium dendroides and Anomodon minor than the other compositae plants. In general, the mitochondrial genes had a quite difference on the sequence of conserved motif and expression mode under the cold condition between the Arabidopsis thaliana, Lycopersicon esculentum and Saussurea involucrata. It was concluded that the mitochondria genes and its expressional regulation could be implicated in the cold adaptation of plants.
Key words:low temperature tolerance, plants, mitochondrial gene, expression mode
植物線粒體通過氧化磷酸化提供生命活動所需的各種能量,在光呼吸代謝、C4植物的光合作用和景天酸代謝(Picault et al., 2004)等途徑中發揮著重要作用。線粒體的主要功能是進行三羧酸循環,通過電子傳遞鏈及氧化磷酸化合成ATP,這里是物質徹底氧化分解的場所,為細胞內的各種生命活動提供能量。此外,線粒體還與細胞內眾多代謝過程相關,如參與細胞內信號轉導,調節細胞內氧化還原電位,調控基因表達、細胞凋亡等(Millar et al., 2011)。線粒體在植物響應逆境脅迫中有重要作用,在逆境脅迫下它們的形態結構和生理功能會發生明顯的變化,在一定程度上可作為表征植物對逆境條件耐受性的依據(周宇飛等, 2013)。逆境脅迫會引起呼吸代謝的紊亂(Vanhoudt et al., 2011; Tulah & Birch-Machin, 2013),造成活性氧的積累,過剩的ROS會誘導或加劇膜脂過氧化程度,導致脂質過氧化物水平迅速提高(Sairam & Srivastava, 2002),主要體現在線粒體膜和膜蛋白的損傷、線粒體蛋白質損傷、線粒體DNA損傷等(Rachel et al., 2005; Foyer & Noctor, 2010; 馬曉蕾等, 2013)。通過對冷脅迫下植物線粒體蛋白組的研究發現,一些線粒體蛋白如線粒體電子傳遞鏈(mitochondrial electron transport chain, mETC)復合物I-V、交替氧化酶(alternative oxidase, AOX)、解偶聯蛋白(uncoupling protein, UCP)等的表達水平受到冷或熱脅迫的影響,預示著這些蛋白可能參與了植物對溫度脅迫的響應過程(Yin et al., 2009; Qin et al., 2009; Tan et al., 2012)。但是,植物線粒體中存在有多條電子傳遞途徑,低溫脅迫對不同植物線粒體呼吸鏈的具體傷害位點也會不同(劉美君等, 2014)。如在對半耐寒植物豌豆(Pisum sativum)的蛋白組研究中,低溫對其電子傳遞鏈復合物的影響較小,主要影響的是線粒體中AOX和UCP的豐度(Taylor et al., 2009);在對耐寒植物高山離子芥(Chorispora bungeana)研究中,低溫對其線粒體的影響又出現不同,其線粒體中AOX和UCP含量變化較小,但呼吸鏈復合體的變化較高(常建鋒, 2007)。這表明不同植物線粒體在應對低溫脅迫時的響應機制有所不同,其響應機制可能與其低溫耐受性之間存在某種關聯。
本研究主要根據雪蓮、擬南芥和番茄三種不同低溫耐受性植物的低溫轉錄組,篩選并比較其線粒體基因表達差異,來探索植物線粒體低溫表達模式與低溫耐受性之間的關系。通過對低溫條件下,三種不同低溫耐受性植物線粒體基因表達差異比較和不同低溫耐受性植物間線粒體基因進化關系的對比,來分析不同低溫耐受性植物間低溫響應機制和代謝水平的差異,以及通過響應冷脅迫的關鍵節點基因的序列差異,來探索不同低溫耐受性植物間線粒體的低溫表達模式的差別,為進一步研究植物線粒體冷脅迫響應機制和相關基因功能奠定理論基礎。
1 材料與方法
1.1 雪蓮、番茄、擬南芥線粒體低溫差異表達基因的抽取
雪蓮轉錄本源數據(李錦等, 2017)的下載,以向日葵、菊花等菊科線粒體基因參照,與轉錄本進行比對,參照雪蓮轉錄組注釋文件,篩選出雪蓮線粒體基因的低溫差異表達量數據,編寫python腳本并篩選其基因序列。番茄低溫轉錄本數據(Barrero-Gil et al., 2016)的下載,以NCBI數據庫中的番茄線粒體基因組為參考,從源數據中篩選出其線粒體基因的低溫表達量數據。擬南芥低溫轉錄組源數據(Vogel et al., 2005)下載,以擬南芥線粒體基因組(Sloan et al., 2018)為參考,篩選出擬南芥線粒體的低溫差異表達量數據。
1.2 三種植物線粒體基因低溫差異表達對比
根據三種植物的低溫差異表達的線粒體基因表達量數據,使用R語言中的pheatmap包進行聚類分析,比較其低溫線粒體基因表達差異,并分析差異表達基因分屬的不同代謝通路,分析其代謝通路差異與低溫脅迫之間的關系,主要從代謝通路的關鍵節點基因入手。
1.3 三種植物線粒體低溫差異表達基因的驗證
對以上篩選的部分線粒體低溫差異表達基因進行實時熒光定量實驗驗證,檢測其轉錄組數據的準確性。根據三種植物低溫轉錄本的測定條件,分別對其進行低溫處理,雪蓮組培苗低溫處理組為4 ℃冷馴化7 d,-2 ℃再處理48 h,參照組為4 ℃冷馴化7 d,所用雪蓮為生長2個月的組培苗;擬南芥低溫處理組條件為4 ℃處理24 h,參照組條件為18 ℃培養基中正常生長2周的擬南芥;番茄低溫處理組條件為10 ℃處理48 h,參照組條件為25 ℃正常生長3周的番茄栽培苗。分別提取其RNA并反轉錄為cDNA,根據篩選出的三種植物主要的低溫差異表達基因序列,設計實時熒光定量檢測引物(各基因的引物序列與內參基因引物表1),進行RT-qPCR實驗。分析三種植物的線粒體基因低溫差異表達情況,是否與轉錄組中篩選的低溫差異表達趨勢一致。
1.4 三種植物的線粒體呼吸鏈基因的啟動子分析
從篩選出的低溫差異表達基因中,找到與呼吸鏈組成密切相關的基因,并獲得其啟動子序列(雪蓮基因組由祝建波研究員提供,未發表),使用PlantCARE (Lescot et al., 2002)在線網站分析其順式作用原件,統計并分析呼吸鏈相關基因啟動子中的順式作用元件功能與數量。對含有低溫響應元件的線粒體基因表達差異進行分析。
1.5 多種植物線粒體低溫差異表達基因的進化關系分析
下載了17種擁有不同低溫耐受性植物線粒體基因組序列,抗寒植物包括尖葉牛舌蘚(Anomodon attenuates)、萬年蘚(Climacium americanum)、歐洲山楊(Populus tremula)、人參(Panax ginseng),耐寒植物有柴胡(Bupleurum falcatum)、蠶豆(Vicia faba)、沙冬青(Ammopiptanthus mongolicus),較耐寒植物有甘藍(Brassica oleracea)、菊花(Chrysanthemum boreale)、向日葵(Helianthus annuus),以及不耐寒的天仙子(Hyoscyamus niger)、煙草(Nicotiana attenuate)、丹參(Salvia miltiorrhiza)、巨桉(Eucalyptus grandis)、辣椒(Capsicum annuum)、葡萄藻(Botryococcus braunii)、共球藻(Trebouxiophyceae sp.)。通過對不同適應溫度的植物線粒體基因蛋白保守序列的比對與進化關系分析,來探索和討論不同植物間在低溫脅迫下的線粒體基因的作用與響應機制。首先使用DNAMAN對線粒體基因中響應低溫的蛋白序列進行多序列比對,并使用mega7分析它們之間的進化關系與距離。主要探究其低溫耐受性與線粒體差異表達基因序列相似性的關系。
2 結果與分析
2.1 三種植物低溫差異表達線粒體基因篩選
從三種植物的轉錄本中共篩選出32個線粒體差異表達基因, 雪蓮2個, 番茄15個, 擬南芥24個。從表2可以看出,線粒體中低溫差異表達基因主要為組成各呼吸鏈復合體的亞基和核糖體蛋白大小亞基基因,包括NAD、COB、COX、CCB、ATP6、RPS和RPL等。擬南芥低溫差異表達基因有24個,主要包括呼吸鏈復合體I亞基基因8個,復合體Ⅲ亞基基因5個,復合物Ⅳ亞基基因2個,核糖體亞基基因8個,1個線粒體mRNA成熟酶R基因; 番茄低溫差異表達基因有15個, 主要包括呼吸鏈復合體I亞基基因2個,復合體Ⅲ亞基基因1個,核糖體亞基基因13個;雪蓮低溫差異表達基因2個,均在呼吸鏈復合體上,其中復合體Ⅲ亞基1個,復合體Ⅳ亞基基因1個。其中,低溫差異表達上調基因中擬南芥主要為電子傳遞鏈復合體亞基基因,番茄為核糖體亞基基因,雪蓮無上調表達基因。其中,雪蓮線粒體下調基因CCB206和COB下調幅度較大,在擬南芥和番茄中均上調的線粒體基因,上調幅度均是番茄大于擬南芥。
2.2 三種植物線粒體低溫差異基因相對表達量分析
通過三種植物低溫差異表達熱圖,雪蓮與擬南芥相對于番茄在基因的表達模式上更為相近。在基因的表達聚類上,所有差異表達基因可分為6大類,從上到下分別為6類(圖1)。其中第一類和第二類主要是線粒體核糖體亞基基因,低溫差異表達模式大致相似,按雪蓮、擬南芥到番茄依次遞增。第一類中雪蓮不變,擬南芥上調較小,番茄上調程度最大;第二類中除核糖體亞基外,還有兩個呼吸鏈復合體亞基基因ATP6和CCB206,其低溫差異表達與第一類相似,但擬南芥與番茄的低溫差異表達程度差異不大,雪蓮不變或顯著下調,擬南芥和番茄均上調,且上調幅度一致。第五類也是由核糖體亞基基因組成,表達模式與第一類和第二類有一定的相似性,其低溫差異表達模式番茄同樣是顯著上調表達,雪蓮與擬南芥不變或下調幅度較小。第三類、第四類和第六類主要為呼吸鏈復合體亞基基因。第三類低溫差異表達為雪蓮和番茄差異較小或不變,擬南芥上調程度最大;第四類低溫差異表達按番茄、雪蓮、擬南芥依次遞增,番茄差異表達下調程度大,雪蓮不變,擬南芥差異表達上調或不變;第六類低溫差異表達為雪蓮和番茄不變,擬南芥下調幅度較小。其中第一類、第二類和第四類的部分核糖體亞基基因的差異表達情況與其低溫耐受性呈負相關。三種植物線粒體在低溫表達模式均有差異,整體上雪蓮與擬南芥相較于番茄的低溫表達模式更為相近,表明其耐受性與線粒體低溫表達模式可能存在某種關聯性。
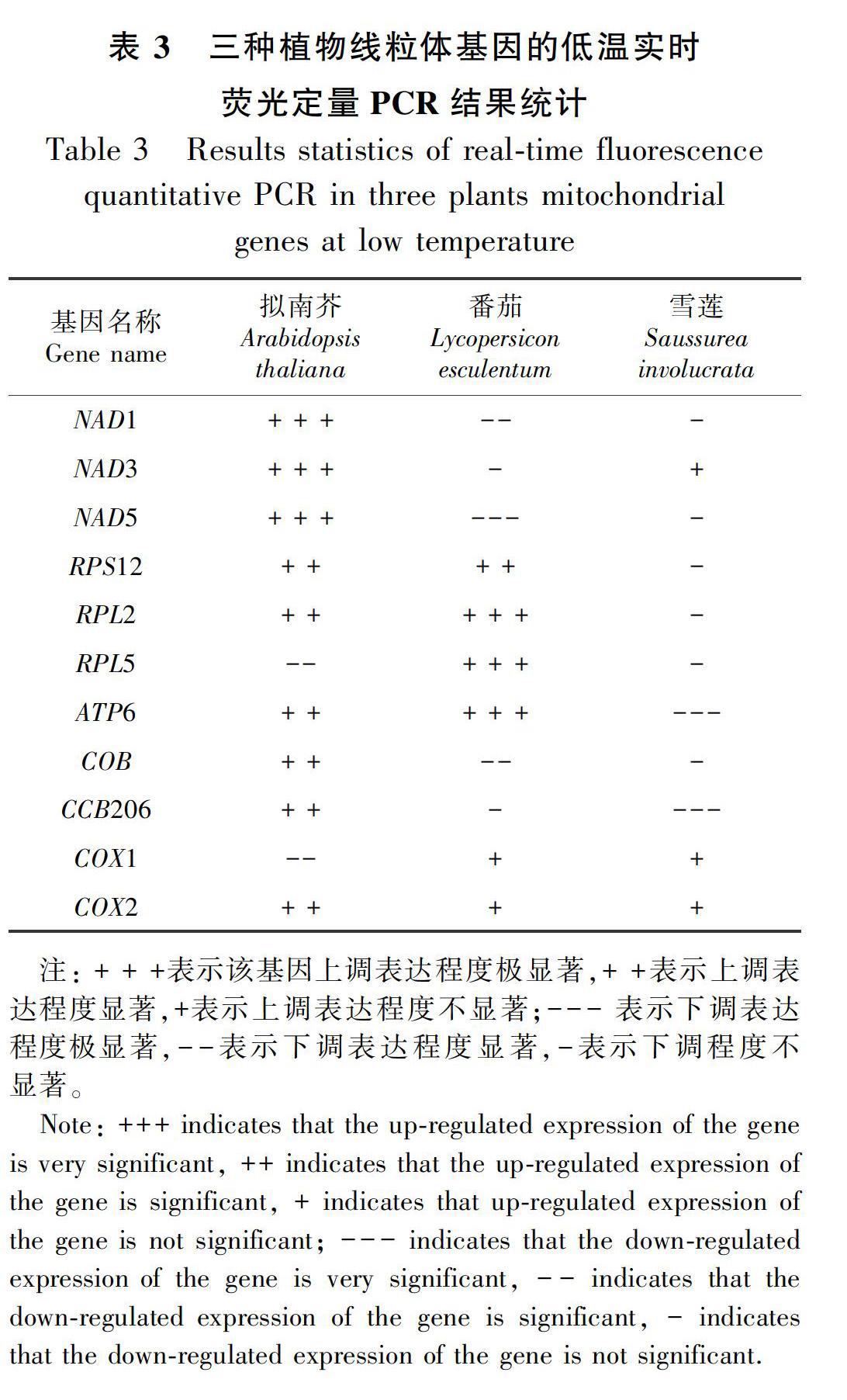
2.3 三種植物的線粒體基因低溫差異表達情況的驗證
選取NAD1、NAD3、NAD5、RPS12、RPL2、RPL5、ATP6、COB、CCB206、COX1和COX2等11個線粒體基因進行低溫表達差異檢測,熒光定量PCR結果如表3所示,表中數據為根據各基因低溫相對表達量(即2-ΔΔCT)的差異程度分為不同的等級。雪蓮線粒體基因低溫處理后的差異表達基因數比低溫轉錄組中的較多,但大部分基因表達量與轉錄組數據一致。在轉錄組數據中沒有篩選
出變化的基因,在熒光定量驗證中出現了變化,但變化量不大,且重復實驗中數據變化量不一致,使用數據較好的一組,求平均值進行計算,會存在一定的實驗誤差,當然也可能是由于轉錄組誤差所致,但其表達量變化不顯著,仍可以進行相關分析。但總體上三種植物的低溫差異表達基因與轉錄組數據一致,少數基因的相對表達量大小可能有所出入,但表達量變化趨勢沒有變化。
2.4 三種植物的線粒體呼吸鏈基因的啟動子分析
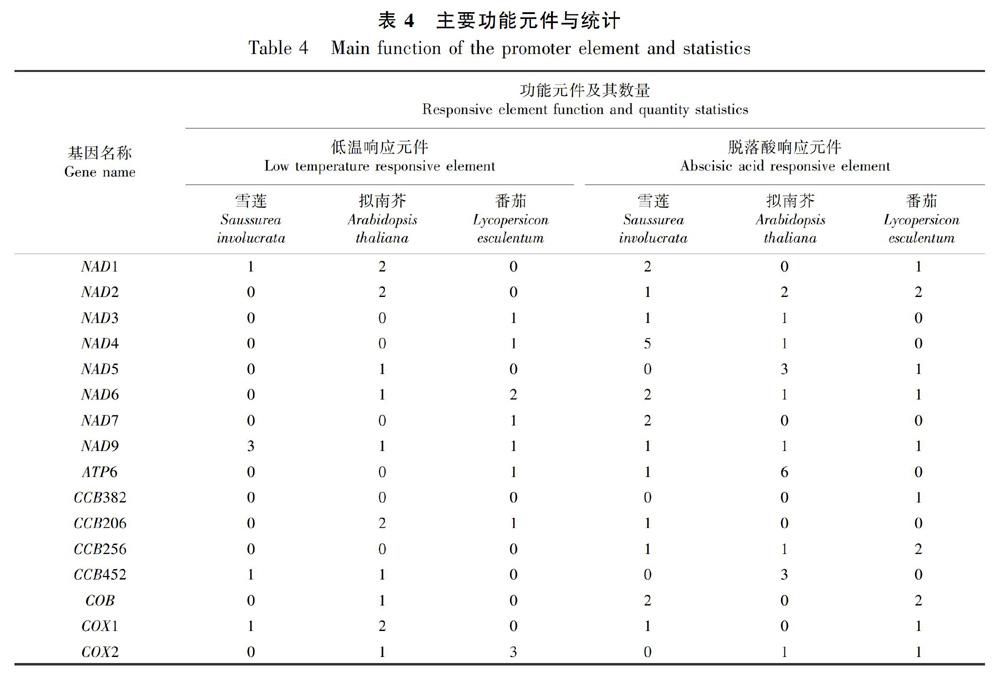
通過對三種低溫差異表達基因的篩選,其中與呼吸鏈相關的基因主要有NAD1、NAD2、NAD4、NAD5、NAD6、NAD7、NAD9、ATP6、CCB382、CCB206、CCB256、CCB452、COB、COX1和COX2,分別分析其啟動子, 啟動子中的順式作用元件種類主要有光響應元件、缺氧與厭氧誘導響應元件、茉莉酸甲酯響應元件、赤霉素響應元件、生長素響應元件、脫落酸響應元件、水楊酸響應元件、防御與脅迫響應元件、低溫響應元件、細胞周期調節響應元件,啟動子和增強子區域中常見的響應元件CAAT-box、GC-motif,核心啟動子元件TATA-box,參與晝夜控制元件circadian等具有不同功能的順式作用原件。圖2列出了呼吸鏈相關線粒體基因的元件類型與數量。
由表4可知,低溫響應元件LTRE和脫落酸響應元件ABRE是基因低溫誘導調控中的關鍵元件。在雪蓮中顯著下調的ATP6和CCB206基因的啟動子中均包含1個ABRE和0個LTRE元件,說明該ABA響應元件可能與其他逆境誘導有關。擬南芥中低溫顯著上調的大多數基因均可發現其啟動子中包含LTRE或ABRE,如NAD1、NAD5和NAD9等。但在擬南芥中NAD7作為顯著低溫上調基因,其基因啟動子區域卻均未發現LTRE和ABRE,說明該基因的低溫誘導表達與其他誘導信號關聯。番茄中的NAD1和NAD5基因類似與雪蓮的ATP6和CCB206基因,均可發現ABRE元件的存在。整體上,大多低溫上調表達的基因均可在其表達調控區域發現LTRE或ABRE,說明線粒體基因的表達受低溫信號或相關激素信號的調控,但這種調控模式在不同植物間具有很大差異。
2.5 不同溫度適應性植物線粒體基因序列分析與對比
通過NCBI根據不同適應溫度,下載17種不同溫度適應性植物線粒體編碼蛋白序列,進行多序列分析,并構建系統發育進化樹。由于植物線粒體基因組主要編碼部分呼吸鏈復合體Ⅰ-Ⅵ亞基基因,這些復合體亞基基因不僅序列上高度保守,而且在數量上基本相同。所以各植物選擇的線粒體編碼基因序列主要是由NAD1、NAD3、NAD5、NAD7、NAD9、COB、CCB、COX1、RPS3、RPS5和RPL5等具有較高保守結構域的基因序列構成。由圖3可知,雪蓮與菊花和向日葵雖同屬一科,但其序列相似度卻不高,與其序列相似度較高的為擬南芥、牛舌蘚、萬年蘚、甘藍和歐洲山楊。與雪蓮保守序列相似性較高的,除擬南芥與甘藍外,其他均分布在寒溫帶針葉林,且都具有抗寒特性, 表明雪蓮與其他植物的線粒體序列差異不僅體現在種屬差異,還與其生長環境差異有關。高度保守的蛋白序列之間存在的差異,一定程度上與其所處環境壓力有關。雖然雪蓮、菊花、向日葵等同屬菊科植物,但在進化關系上距離較遠,與萬年蘚、牛舌蘚、歐洲山楊等高山植物的進化距離較近,說明雪蓮線粒體在高寒環境影響下,進化出自身適應該環境的機制,基因結構也與其他菊科植物產生較大差異。
3 討論與結論
三種植物在低溫下差異表達基因,主要集中在電子傳遞鏈各復合物亞基和核糖體蛋白亞基基因。由于植物的低溫響應機制特別復雜,本文只針對呼吸鏈相關基因低溫表達差異與低溫耐受性之間的關系。通過對呼吸鏈相關基因分析發現,其中番茄和擬南芥中NADH脫氫酶亞基基因差異表達最多,即擬南芥與番茄冷脅迫的影響主要是依賴于NADH的呼吸受抑制程度較大,而依賴于琥珀酸的呼吸受抑制較輕,冷脅迫主要破壞呼吸鏈中復合體Ⅰ的活性,復合體Ⅰ低溫下差異表達情況,對其低溫耐受性有重要作用(Daniela et al., 2007)。擬南芥與番茄在調節依賴于NADH的電子傳遞途徑時的差異,如NAD1、NAD5擬南芥中顯著上調,而番茄顯著下調,反映出擬南芥與番茄在冷脅迫上的耐受性差異。兩種植物的電子傳遞鏈復合體Ⅲ、IV亞基基因在冷脅迫下也具有不同的表達模式,該復合體同樣在植物低溫脅迫下具有重要作用,其表達上調有助于呼吸電子鏈的電子傳遞,有助于氧自由基的消耗,減少活性氧對細胞的損傷(Verrier et al., 2008; Rayapuram et al., 2008; Gaudet et al., 2011)。擬南芥和番茄該復合體亞基基因的低溫差異表達模式同樣有區別,擬南芥中該復合體亞基基因大多顯著上調表達,番茄中下調表達或不變,如CCB、COX等基因在兩種植物中的低溫表達差異,這種表達差別同樣是其低溫耐受性差異的原因。雪蓮的呼吸鏈相關基因的差異表達模式不同于其他兩種植物,由于其較強的低溫耐受性,復合體Ⅰ-Ⅳ的大部分亞基基因均未受到低溫傷害,只有復合體Ⅳ、Ⅴ中的CCB和ATP6出現顯著下調,冷脅迫主要影響的是其電子傳遞鏈的最后部分,通過控制能量代謝速率降低機體能量消耗和呼吸效率,來應對低溫脅迫(Jacoby et al., 2011)。三種植物在低溫脅迫下表達模式和調控機制的差異,可能是形成其低溫耐受性差異的一個原因。通過對呼吸鏈相關基因蛋白序列分析得出,雖然雪蓮、菊花、向日葵等同屬菊科植物,但在進化關系上距離較遠,與萬年蘚、牛舌蘚、歐洲山楊等高山植物的進化距離較近,雪蓮與其他植物的線粒體序列差異不僅體現在種屬差異,還與其生長環境差異有關。
通過以上對三種植物的線粒體差異表達基因模式和基因表達聚類分析得出,雪蓮與擬南芥相對于番茄在基因的表達模式上更為相近;不同冷耐受性植物線粒體之間的線粒體保守序列分析得出,雖然雪蓮和菊花、向日葵等同屬菊科植物,但在進化關系上距離較遠,卻與萬年蘚、牛舌蘚和歐洲山楊等高山植物的進化距離較近,這一現象同樣驗證了一部分線粒體基因的低溫差異表達與其自身冷耐受性相關聯這一結論。
參考文獻:
BARRERO-GIL J, HUERTAS R, RAMBLA JL, et al., 2016. Tomato plants increase their tolerance to low temperature in a chilling acclimation process entailing comprehensive transcriptional and metabolic adjustments [J]. Plant Cell & Environ, 39(10):2303-2318.
CHANG JF, 2007. Characteristics of mitochondrial alternative electron transfer pathways in Chorispora bungeana under chilling stress [D]. Lanzhou:Lanzhou University. ?[常建鋒,2007. 高山離子芥線粒體交替途徑介導的抗寒特征研究 [D]. 蘭州:蘭州大學.]
DANIELA V, ROSA ANNA V, MARIA CONCETTA DP, et al., 2007. In the early phase of programmed cell death in Tobacco Bright Yellow 2 cells the mitochondrial adenine nucleotide translocator, adenylate kinase and nucleoside diphosphate kinase are impaired in a reactive oxygen species-dependent manner [J].Biochim Biophys Acta, 1767(1):66-78.
FOYER CH, NOCTOR G, 2010. Redox sensing and signalling associated with reactive oxygen in chloroplasts, peroxisomes and mitochondria [J]. Physiol Plant, 119(3):355-364
GAUDET P, LIVSTONE MS, THOMAS PD, et al., 2011. Phylogenetic-based propagation of functional annotations within the gene ontology consortium [J]. Brief Bioinform, 12(5):449-462.
JACOBY RP, TAYLOR NL, HARVEY M, 2011. The role of mitochondrial respiration in salinity tolerance [J].Trends Plant Sci, 16(11):614-623.
LESCOT M, DHAIS P,THIJS G, et al., 2002. PlantCARE:a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences [J]. Nucl Acids Res, Database issue, 30(1):325-327.
LI J, YAN PY, QIAN FJ, et al., 2017. Sasussured involucrata transcriptome knowledge base [J]. Chin Bull Bot, 52(4):530-538. ?[李錦,嚴潘瑤,錢飛箭,等,2017. 新疆天山雪蓮轉錄組注解知識庫 [J]. 植物學報,52(4):530-538.]
LIU MJ, SUN XJ, ZHANG ZS, et al., 2014. Quantitative research of plant mitochondrial respiration state and its application in plant biology [J]. J Plant Physiol, 50(1):111-116. ?[劉美君,孫學娟,張子山,等,2014. 植物線粒體呼吸狀態的研究方法及其在植物生物學中的應用 [J]. 植物生理學報,50(1):111-116.]
MA XL, ZHOU LJ, SUN MC, et al., 2013. Research advance on plant mitochondria complexes and its regulation on active oxygen species [J]. J Anhui Agric Sci, 41(19):8095-8096. ?[馬曉蕾,周麗娟,孫孟超,等,2013. 線粒體復合體及其對活性氧的調控研究進展 [J]. 安徽農業科學,41(19):8095-8096.]
MILLAR AH, WHELAN J, SOOLE KL, et al., 2011. Organization and regulation of mitochondrial respiration in plants [J].Ann Rev Plant Biol, 62(1):79-104.
PICAULT N, HODGES M, PALMIERI L, et al., 2004. The growing family of mitochondrial carriers in Arabidopsis [J]. Trends Plant Sci, 9(3):138-146.
QIN GZ, MENG XH, WANG Q, et al., 2009. Oxidative damage of mitochondrial proteins contributes to fruit senescence:A redox proteomics analysis [J]. J Proteome Res, 8(5): 2449-2462.
RACHEL C, RYAN L, PARKER KL, et al., 2005. Stress-induced co-expression of alternative respiratory chain components in Arabidopsis thaliana [J]. ?Plant Mol Biol, 58(2):193-212.
RAYAPURAM N, HAGENMULLER J, GRIENENBERGER JM, et al., 2008. The three mitochondrial encoded CcmF proteins form a complex that interacts with CCMH and c-type apocytochromes in ?Arabidopsis [J]. J Biol Chem, 283(37):25200-25208.
SAIRAM RK, SRIVASTAVA GC, 2002. Changes in antioxidant activity in sub-cellular fractions of tolerant and susceptible wheat genotypes in response to long term salt stress [J]. Plant Sci, 162(6):897-904.
SLOAN DB, WU Z, SHARBROUGH J, 2018. Correction of persistent errors in Arabidopsis reference mitochondrial genomes [J]. Plant Cell, 30(3):525-527.
TAN YF, MILLAR AH, TAYLOR NL, 2012. Components of mitochondrial oxidative phosphorylation vary in abundance following exposure to cold and chemical stresses [J]. J Proteome Res, 11(7):3860-3879.
TAYLOR NL, TAN YF, JACOBY RP, et al., 2009. Abiotic environmental stress induced changes in the Arabidopsis thaliana chloroplast, mitochondria and peroxisome proteomes [J]. J Proteomics, 72(3):367-378.
TULAH AS, BIRCH-MACHIN MA, 2013. Stressed out mitochondria:the role of mitochondria in ageing and cancer focussing on strategies and opportunities in human skin [J]. Mitochondrion, 13(5):444-453.
VANHOUDT N, VANDENHOVE H, HOREMANS N, et al., 2011. Unraveling uranium induced oxidative stress related responses in Arabidopsis thaliana seedlings, Part I:responses in the roots [J]. J Environ Radioactiv, 102(6):630-637.
VERRIER PJ, BIRD D, BO B, et al., 2008. Plant ABC proteins—A unified nomenclature and updated inventory [J]. Trends Plant Sci, 13(4):151-159.
VOGEL JT, ZARKA DG, THOMASHOW MF, et al., 2005. Roles of CBF2 and ZAT12 transcription factors in configuring the low temperature transcriptome of Arabidopsis [J]. Plant J, 41(2):195-211.
YIN GK, SUN HM, XIN X, et al., 2009. Mitochondrial damage in the soybean seed axis during imbibition at chilling temperatures [J]. Plant Cell Physiol, 50(7):1305-1318.
ZHOU YF, WANG DQ, LU ZB, et al., 2013. Impacts of drought stress on leaf osmotic adjustment andchoroplast ultrastructure of stay green sorghum [J]. Chin J Appl Ecol, 24(9):2545-2550. ?[周宇飛,王德權,陸樟鑣,等,2013. 干旱脅迫對持綠性高粱葉片滲透調節及葉綠體超微結構的影響 [J]. 應用生態學報,24(9):2545-2550.]
(責任編輯 何永艷)

