鱟素Tachyplesin Ⅰ在大腸桿菌中的重組表達及其抑菌活性
王若誠,辛 瑜,張 梁
(江南大學糧食發酵工藝與技術國家工程實驗室,江南大學生物工程學院,江蘇無錫 214122)
抗生素的廣泛應用拯救了無數生命,然而過度依賴抗生素導致藥物殘留與細菌耐藥性問題日益嚴重[1-2],傳統大分子抗生素開發逐漸停滯[3]。因此,尋找抗生素替代品成為社會發展與科技進步的必要方向。抗菌肽(antimicrobial peptide,AMPs)作為生物先天免疫的第一道重要防線[4-5]逐漸進入大家的視野。作為小分子抗菌物質[6],抗菌肽作用機制多樣[7],可以參與細胞信號傳導[8],具有抗氧化[9]與降血壓[10]作用。
鱟是一種生活在海洋中的大型節肢動物,從奧陶紀出現至今已有4億多年的歷史[11]。鱟素作為鱟血細胞中的陽離子抗菌肽[12],對細菌與真菌均具有抑菌活性[13-14]。此外,研究表明鱟素還可以抗病毒[15]、抑制腫瘤細胞增殖[16]和誘導癌細胞分化[17]。鱟素Tachyplesin Ⅰ(TP1)由17個氨基酸殘基組成,兩個β-折疊通過β-轉角連接在一起,疏水的氨基酸殘基定位于平面一側,分子中6個陽離子氨基酸殘基主要分布在分子的尾部[18]。Edwards利用氨基酸殘基修飾調節重組肽所帶電荷和疏水性,以評估鱟素及其類似物對于耐藥菌的抑菌活性[19];Woodbum等將RP557與鱟素抗菌肽共同使用,降低傷口感染風險[20];Vernen等研究發現鱟素與癌細胞具有很強的結合能力,可以幫助化療藥物靶向針對癌細胞[21]。這些研究說明鱟素在醫學領域具有廣闊的應用前景與巨大經濟價值。目前,抗菌肽主要通過生物提取、化學合成和基因工程3種方法獲取。從生物體內分離純化抗菌肽,公眾接受度高但步驟繁瑣,產率較低。鱟作為珍貴的海洋生物,數量稀少,從鱟血細胞中直接提取不能滿足大量制備的需求[22]。而利用化學方法固相合成,產物純度可得到保障,但價格極其昂貴,無法滿足工業化應用。利用基因工程技術來生產鱟素,能夠減少環境負擔,大幅降低鱟素獲取成本[23],為鱟素的理論研究與工業化應用創造良好環境。
本研究選用大腸桿菌作為宿主細胞,為降低目的抗菌肽對宿主菌的殺傷作用,將鱟素抗菌肽與硫氧還蛋白標簽以可溶形式進行融合表達。并對經過蛋白純化和羥胺切割獲得的重組TP1蛋白進行質譜鑒定和抑菌活性表征,為鱟素工業化應用提供參考。
1 材料與方法
1.1 材料與儀器
質粒pET-32a(+)、大腸桿菌(Escherichiacoli)JM109、大腸桿菌BL21(DE3)、枯草芽孢桿菌(Bacillussubtilis)、金黃色葡萄球菌(Staphylococcusaureus) 本實驗室保藏;限制性內切酶BamH Ⅰ/HindⅢ、預染蛋白Marker Page Ruler Prestained Protein Ladder 美國Thermo公司;T4DNA連接酶 大連Takara公司;2×TaqMaster Mix、2×PfuMaster Mix 杭州寶賽生物科技有限公司;質粒DNA小量提取、DNA片段純化、DNA凝膠回收試劑盒 美國Axygen公司;氨芐青霉素(Ampicillin,Amp) 美國INALCO公司;異丙基硫代-β-D-半乳糖苷(Isopropylβ-D-thiogalactoside,IPTG) 上海生工生物工程有限公司;蛋白胨、酵母提取物 英國OXOID公司;其他試劑 均為國產分析純。
S100D型PCR儀、Chemi Doc凝膠成像儀 美國Bio-Rad公司;DYY-6C 核酸電泳儀 北京六一儀器廠;Pico17高速離心機 美國Thermo Fisher Scientific公司;MLS-3750型全自動高壓蒸汽滅菌鍋 日本SANYO公司;HYL-C 型組合式搖床 太倉市實驗設備廠;UV-3200型紫外可見分光光度計 上海美譜達儀器有限公司;Sonic VCX-750型超聲波細胞破碎儀 南京新辰生物科技有限公司;SCG蛋白純化系統 蘇州賽譜儀器有限公司;MALDI SYNAPT MS超高效液相色譜串聯四極桿飛行時間質譜聯用儀 美國Waters公司;HH-2數顯恒溫水浴鍋 金壇市榮華儀器制造有限公司。
1.2 實驗方法
1.2.1 目的基因的獲得 參考NCBI數據庫中鱟素抗菌肽Tachyplesin Ⅰ(TP1)的全長cDNA序列(GenBank登錄號:P14213.2),根據大腸桿菌的密碼子偏好性對編碼其成熟肽進行密碼子優化,交由上海生工生物工程有限公司合成。將TP1基因序列克隆在pUC57質粒上,命名為pUC57-TP1。以質粒pUC57-TP1為模板,設計正向引物F1:5′-CGGGATCC AACGGCAAATGGTGCTTTCGCG-3′,反向引物R1:5′-CCAAGCTTTCATTAGCCGTTGCGGCA GCGGCGATA-3′,下劃線依次BamH Ⅰ、羥胺切割位點和HindⅢ限制性內切酶位點。利用PfuDNA高保真聚合酶擴增TP1基因片段。
1.2.2 原核表達質粒的構建和鑒定 擴增得到的PCR產物純化后使用BamH I與Hind Ⅲ進行雙酶切,酶切產物經過純化后與同樣雙酶切純化后的pET-32a片段按摩爾比(5∶1)用 T4DNA連接酶16 ℃連接過夜,連接產物即pET-32a-TP1。表達設計框架為:TrxA+羥胺切割位點(aacggc)+TP1目的抗菌肽。連接產物轉化E.coliJM109感受態細胞并過夜培養,挑取菌落為模板,以F1和R1為引物,通過菌落PCR與酶切驗證目的片段是否連接到目的載體上,將篩選得到的陽性轉化子送至上海生工生物工程有限公司測序。
1.2.3 融合蛋白的誘導表達 將鑒定正確的pET32a-TP1質粒轉化到大腸桿菌BL21感受態細胞中,在含有100 μg/mL氨芐的LB培養基中,分別在37、30、25 ℃下,200 r/min轉速下培養至對數生長期時(OD600=0.6),加入終濃度1 mmol/L的IPTG進行誘導表達,發酵結束后12000 r/min,4 ℃離心10 min收集菌體重懸于磷酸鹽緩沖液中,洗滌3次在冰浴中進行超聲破碎,功率為400 W,共15 min(工作1 s,間隔2 s)。然后在4 ℃下12000 r/min離心20 min,分別收集上清與沉淀,通過15% SDS-PAGE分析蛋白表達情況。
1.2.4 目的蛋白純化 將誘導后離心收集的菌體經PBS緩沖液洗滌2次,超聲破碎后離心收集上清,將樣品通過HisTrap FF親和層析凝膠柱進行純化。進樣前,利用50 mL平衡緩沖液(500 mmol/L NaCl、20 mmol/L Na2HPO4、20 mmol/L 咪唑,pH7.4)平衡柱子。進樣后,用5~10倍體積的洗脫緩沖液(500 mmol/L NaCl、20 mmol/L Na2HPO4、500 mmol/L咪唑,pH7.4)洗脫,收集洗脫峰的洗脫液。
1.2.5 羥胺切割與產物質譜鑒定 將1.2.4中收集到的洗脫液注入透析袋中,用磷酸鹽緩沖液(pH7.4)透析過夜以除去高濃度咪唑。透析后樣品12000 r/min離心20 min收集得到的上清液凍干后,加入羥胺切割液(200 mmol/L Tris,2 mol/L鹽酸羥胺,pH9.0)中,在45 ℃條件下反應4 h[24]。切割獲得的產物利用透析袋進行脫鹽處理。然后將樣品利用冷凍干燥儀進行濃縮。使用LC-MS TOF超高效液相色譜串聯質譜聯用儀對濃縮樣品進行質譜檢測,以鑒定切割產物成分。
色譜條件:液相系統:Waters ACQUITY UPLC;色譜柱:ACQUITY UPLC BEH C18色譜柱(2.1×150 mm,1.7 μm);柱溫:45 ℃;流動相A:乙腈;流動相B:0.1%甲酸;流速0.30 mL/min;總分析時間15.00 min;進樣體積:5.0 μL。
質譜條件:質譜系統:Waters SYNAPT MS檢測儀;軟件:Waters Masslynx V4.1質譜工作站;離子源:ESI電離源;電離模式:ESI+;掃描m/z范圍:20~2000;毛細管電壓:3.5 kV;錐孔電壓:20 V;離子源溫度:100 ℃;脫溶劑氣溫度:400 ℃;脫溶劑氣流量:700 L/h;錐孔氣流量:50 L/h。
1.2.6 重組TP-1的抑菌活性檢測 用瓊脂孔擴散實驗對重組表達的鱟素抗菌肽TP1檢測抑菌活性。將金黃色葡萄球菌和枯草芽孢桿菌分別培養至對數期(OD600=0.4~0.6),利用滅菌后的PBS溶液,將菌液濃度稀釋至5×105CFU/mL。將無菌LB固體培養基冷卻至50 ℃,按照1%的比例接種指示菌,混勻后傾注平板。等平板凝固后用打孔器進行打孔,分別標記數字1、2、3、4、5。1號孔加入化學合成的TP1(40 mg/L),2號孔加入Trxa-TP1融合蛋白(40 mg/L),3號孔切割后的TP1重組蛋白(40 mg/L),4號孔加入10 mg/mL氨芐青霉素,5號孔加入滅菌后的PBS溶液。每孔上樣50 μL液體,37 ℃靜置培養過夜,觀察抑菌圈情況。
最小抑菌濃度的測定:將處于對數期的金黃色葡萄球菌和枯草芽孢桿菌稀釋至104~105CFU/mL,取1 mL菌液和10 μl不同濃度的重組TP1加入到EP管中,以PBS緩沖液作陰性對照,37 ℃、200 r/min振蕩培養3 h,測菌液的OD600,以吸光度值無變化處所對應的TP1濃度為最小抑菌濃度(MIC)。
1.3 數據處理
本研究中涉及的實驗內容均重復3次;應用Waters Masslynx V4.1軟件分析質譜數據與Adobe Illustrator CC2018軟件作圖。
2 結果與分析
2.1 目的抗菌肽TP1基因獲得
TP1基因的開放閱讀框編碼的氨基酸序列為KWCFRVCYRGICYRRCR,該基因編碼的抗菌肽長度為17個氨基酸殘基。以重組質粒pUC57-TP1為模板,通過PCR擴增獲得目的基因,其凝膠電泳結果如圖1所示,在3%瓊脂糖凝膠電泳上可以看到大小約為80 bp的清晰條帶,與目的片段大小一致。
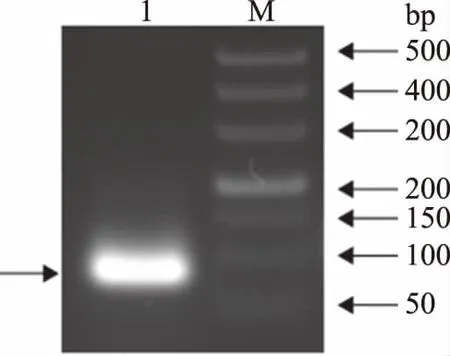
圖1 TP1基因的克隆
2.2 鱟素TP1原核表達載體的構建與鑒定
對構建的pET32a-TP1表達載體進行雙酶切驗證,雙酶切后出現兩條特異性條帶,其中小片段與TP1大小一致,另一條帶與雙酶切后的pET-32a大小相同,結果如圖2所示,表明基因TP1已經成功連接到pET-32a載體上。提取重組質粒轉化大腸桿菌BL21感受態細胞,篩選獲得重組菌。由于目的抗菌肽TP1對于宿主大腸桿菌可能存在一定的殺傷作用,為提高目的抗菌肽的產量,利用TrxA蛋白融合標簽與目的抗菌肽融合表達,以此降低TP1的毒性,保護宿主菌生長。后期再通過羥胺裂解液分離TrxA蛋白與目的抗菌肽,釋放TP1的抑菌活性。

圖2 pET32a-TP1重組質粒的雙酶切鑒定
2.3 融合蛋白的誘導表達
結果如圖2顯示,在37 ℃培養條件下的菌體破碎上清中,20 kDa左右處有明顯特異表達的蛋白條帶,與預期的TrxA-TP1融合蛋白的大小基本一致,表明融合蛋白成功表達并以可溶形式存在。
2.4 融合蛋白TrxA-TP1的純化
收集菌體超聲破碎后的上清,使用HisTrap FF柱進行分離純化。將洗脫緩沖液洗脫后獲得后的樣品進行SDS-PAGE電泳檢測,結果如圖3所示,進樣流出部分無目的蛋白析出,說明目的蛋白與鎳柱有效結合;當洗脫液中咪唑濃度為100 mmol/L時,剩余雜蛋白充分洗脫;當洗脫液中咪唑濃度為200 mmol/L時,大量目的蛋白析出,SDS-PAGE分析顯示為單一條帶,大小約為20 kDa。結果表明利用鎳柱純化后能夠獲得純度較高的TrxA-TP1融合蛋白。
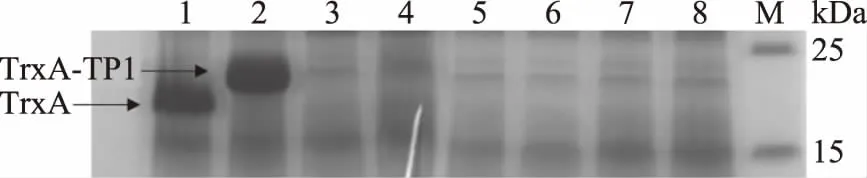
圖3 TrxA-TP1融合蛋白的SDS-PAGE分析
2.5 融合蛋白的切割與質譜鑒定
將純化后的TrxA-TP1融合蛋白進行羥胺切割,經過除鹽與濃縮處理后利用LC-MS TOF對切割產物進行分析。結果如圖4所示,切割產物分子質量為2330.55 u,與預測結果一致。根據上述結果以及SDS-PAGE分析,表明了重組菌BL21-pET32a-TP1能夠成功表達TrxA-TP1融合蛋白,且可以利用羥胺切割的方法將TrxA蛋白與目的抗菌肽TP1分開,從而能夠獲得單一的TP1重組蛋白。

圖4 純化后的融合蛋白TrxA-TP1的SDS-PAGE分析
2.6 重組TP1的抑菌活性檢測
為了檢測羥胺切割后重組TP1的抗菌活性,以氨芐青霉素為陽性對照,滅菌后的PBS溶液為陰性對照,使用金黃色葡萄球菌和枯草芽孢桿菌作為實驗菌,利用瓊脂糖孔擴散法對獲得的重組TP1蛋白的抗菌活性進行測定。結果如圖5所示,通過對抑菌圈大小與透明程度進行比較,表明TrxA-TP1融合蛋白對金黃色葡萄球菌與枯草芽孢桿菌均不具有抑菌活性,而切割后獲得的重組蛋白TP1對這兩種菌均具有抑菌活性。由此表明了TP1蛋白與TrxA蛋白融合表達后,利用羥胺切割可以獲得具有抗菌活性的單一TP1重組蛋白。通過液體抑制測定法確定了重組TP1對金黃色葡萄球菌和枯草芽孢桿菌的最小抑菌濃度分別為6和10 mg/L。
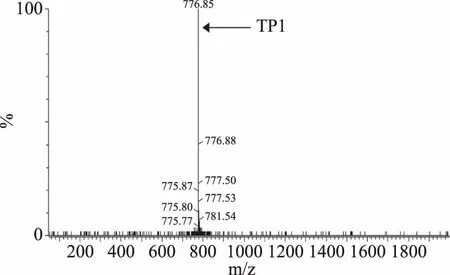
圖5 重組TP1的質譜分析

圖6 重組TP1的抑菌效果檢測
3 討論與結論
本研究成功利用大腸桿菌表達系統對鱟素TP1進行了高效表達。在菌體破碎液上清中,檢測到重組融合蛋白的條帶大小約為20 kDa,表明TrxA-TP1融合蛋白在大腸桿菌中以可溶形式進行了融合表達。融合蛋白經過鎳柱純化,能夠獲得條帶較為單一的融合蛋白,純化后的樣品利用羥胺裂解液進行切割后,質譜分析證明了羥胺切割后能夠成功的將TrxA蛋白標簽與鱟素TP1抗菌肽分開,從而獲得單一的TP1抗菌肽。后期抑菌活性實驗表明,融合蛋白TrxA-TP1對金黃色葡萄球菌和枯草芽孢桿菌沒有明顯的殺傷作用,而裂解后獲得的單一的重組TP1單體蛋白對這兩種菌均具有明顯抑菌活性。
迄今為止,已有許多研究人員在不同宿主中成功表達抗菌肽[25]。大腸桿菌作為目前應用最為廣泛的表達系統[26],具有在短時間內表達水平高和成本低廉等優點,非常適用于規模化生產,有望使抗菌肽成為幫助人類抵御疾病的新型藥物。許多利用大腸桿菌重組表達的抗菌肽,如擬穴青蟹抗菌肽[27]與PlnF抗菌肽[28]都以包涵體形式存在。然而包涵體后續處理繁瑣且復性后目的蛋白可能喪失活性[29]。本文選取TrxA蛋白標簽與鱟素TP1抗菌肽進行融合表達,不僅促進融合蛋白的可溶性表達,更降低了重組TP1對于宿主大腸桿菌的殺傷作用,提高了融合蛋白的表達量,為鱟素抗菌肽的大規模生產與其他抗菌肽的重組表達提供了一定理論依據。

