酶解法制備牡丹籽ACE抑制肽及其穩定性
陳秋鑾,陳雪芹,馬 倩,謝李玲,薛婉茹,孟 春,洪 晶
(福州大學生物科學與工程學院,福建福州 350000)
高血壓是一種心血管綜合征,高血壓患者是我國患病人群中最大的一個群體。腎素-血管緊張素系統(RAS)是人體內重要的體液調節系統,在血壓的調節中發揮直接作用。在RAS系統中,體內腎素作用于血管緊張素原將其轉換為血管緊張素Ⅰ,血管緊張素Ⅰ在血管緊張素酶(ACE)催化作用下轉為為血管收縮因子——血管緊張素Ⅱ,最終導致機體血壓升高。ACE抑制劑(ACEI)能夠抑制ACE酶活性,起到調節血壓作用,是第五種最常見的處方藥,ACE抑制劑可使心血管病人的5年死亡率降低近五分之一,也是臨床首選的藥物之一[1-2]。常見的ACE 抑制劑藥物有卡托普利、苯那普利、依那普利、培哚普利等,但是臨床上顯示長期服用降壓藥,會有咳嗽、血管性水腫、頭痛等不良反應[3]。目前植物蛋白質源的生物活性肽研究得到被重視,特別是降壓肽,因其具有天然、安全性高、易吸收、無副作用的特點而備受關注[4]。ACE抑制肽是一種小分子活性肽,能夠抑制血管緊張素轉化酶,起到降血壓的作用。
現已從多種食物蛋白源中發現不同ACE抑制肽,包括從乳源蛋白[5]、植物蛋白(比如油棕櫚、核桃、葵花籽、花生、大豆、藻類等)[6-11]、魚類[12]等天然蛋白源發現ACE抑制肽,說明ACE抑制肽來源豐富,得到了廣泛地研究。
牡丹籽經榨油后的籽粕大多丟棄或者作為動物飼料,其生物利用率低。有研究表明牡丹籽蛋白含量為18%~35%[13-14],其蛋白中必需氨基酸含量與大豆分離蛋白的相似[15],具有很高的營養價值,可作為天然植物蛋白的重要來源,也可作為生物活性肽的很好來源。但目前關于牡丹籽活性肽的研究較少,顏輝等[16]采用超聲酶法制備降血糖肽,Zhang等[17]從牡丹籽中分離鑒定了一種新型的抗氧化肽SMRKPPG,說明牡丹籽粕蛋白并未得到很好的研究利用,因此有必要對牡丹籽粕蛋白來源的活性肽進一步研究。本研究探索牡丹籽粕ACE抑制肽的制備工藝,以及牡丹籽ACE抑制肽在高溫及酸、堿條件下的穩定性和經過胃腸道蛋白酶消化后的ACE抑制活性變化,為牡丹籽多肽生產和保存提供理論基礎,達到牡丹籽粕蛋白的有效利用,提高牡丹籽的附加價值,實現資源的綜合利用,具有重要的意義。
1 材料與方法
1.1 材料與儀器
牡丹籽粕 購于山東菏澤市場;中性蛋白酶(105000 U/g)、堿性蛋白酶(82000 U/g)、風味蛋白酶(18000 U/g)、胃蛋白酶(5700 U/g)、胰蛋白酶(97000 U/g) Notlas生物科技有限公司;血管緊張素轉化酶(ACE)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG) 美國Sigma公司;茚三酮 上海源葉生物科技有限公司;BCA蛋白濃度測定試劑盒 碧云天生物技術有限公司。
HH-4數顯恒溫水浴搖床 國華電器有限公司;Z323K低溫離心機 德國赫默公司;T6新世紀紫外分光光度計 北京普析通用儀器有限責任公司;pH700 pH計 美國Eutech公司;SpectraMax i3酶標儀 美國美谷分子儀器有限公司。
1.2 實驗方法
1.2.1 牡丹籽粕蛋白的提取 參考宋艷秋等[14]報道的方法從牡丹籽粕中提取蛋白,提取工藝條件為:料液比1∶25,浸提pH9. 25,提取溫度53 ℃,提取時間70 min。4 ℃條件下10000 r/min離心15 min,獲得上清液,測定蛋白濃度,計算蛋白提取率。調節上清液pH3.5進行酸沉,于4 ℃條件下10000 r/min離心15 min,沉淀用水復溶,調節pH為中性,冷凍干燥備用。采用凱氏定氮法(GB 5009.5-2016)測定提取蛋白的蛋白含量。
式(1)
式(1)中:c:上清液蛋白濃度,mg/mL;V:上清液體積,mL;m:原料牡丹籽粕的量,g;p:原料牡丹籽粕的蛋白含量,%。
1.2.2 牡丹籽ACE抑制肽的制備 牡丹籽粕ACE抑制肽的酶解工藝流程為:牡丹籽粕蛋白→酶解→滅酶→離心取上清液,操作要點:將牡丹籽粕蛋白配制為一定濃度的蛋白質溶液,100 ℃預處理10 min,調pH,加入一定量的酶,恒溫水浴搖床酶解,酶解后于沸水浴滅酶10 min,冷卻至室溫,調pH至中性后于4 ℃條件下10000 r/min離心15 min,取上清測定ACE抑制活性。
1.2.3 蛋白酶的篩選 以牡丹籽粕蛋白為原料,選取5種蛋白酶并在其最適的條件下進行酶解,分別為中性蛋白酶(pH7.0,50 ℃)、胃蛋白酶(pH3.0,37 ℃)、胰蛋白酶(pH8.0,37 ℃)、風味蛋白酶(pH6,50 ℃)和堿性蛋白酶(pH8.5,60 ℃)。在底物濃度為2%,加酶量6000 U/g,酶解3 h,滅酶,離心,取酶解液冷凍干燥,將凍干粉配制為2 mg/mL的多肽溶液,測定ACE的抑制率,選擇合適的蛋白酶。
1.2.4 單因素實驗
1.2.4.1 pH對酶解液ACE抑制率及水解度的影響 配制濃度為2%(w/v)的蛋白溶液,分別調節pH為6.0、6.5、7.0、7.5、8.0,加酶量為6000 U/g,在50 ℃條件下水解3 h,探究pH對酶解液ACE抑制率和水解度的影響。
1.2.4.2 加酶量對酶解液ACE抑制率及水解度的影響 配制濃度為2%(w/v)的蛋白溶液,調節pH為7.0,加酶量分別為2000、4000、6000、8000、10000 U/g,在50 ℃條件下水解3 h,探究加酶量對酶解液ACE抑制率和水解度的影響。
1.2.4.3 底物濃度對酶解液ACE抑制率及水解度的影響 分別配制濃度為0.5%、1%、2%、3%、4%、5%(w/v)的蛋白溶液,調節pH為7.0,加酶量為6000 U/g,在50 ℃條件下水解3 h,探究底物濃度對酶解液ACE抑制率和水解度的影響。
1.2.4.4 時間對酶解液ACE抑制率及水解度的影響 配制濃度為2%(w/v)的蛋白溶液,調節pH為7.0,加酶量為6000 U/g,在50 ℃下分別酶解1、2、3、4、5 h,探究時間對酶解液ACE抑制率和水解度的影響。
1.2.4.5 溫度對酶解液ACE抑制率及水解度的影響 配制濃度為2%(w/v)的蛋白溶液,調節pH為7.0,加酶量為6000 U/g,分別在40、45、50、55、60、65 ℃下酶解2 h,探究溫度對酶解液ACE抑制率和水解度的影響。
1.2.5 牡丹籽ACE抑制肽制備條件的響應面優化 根據單因素的實驗結果,選定底物濃度為2%(w/v),酶解時間2 h,選擇pH、加酶量(U/g)和溫度(℃)這三個因素為響應變量,ACE抑制率(%)為響應值,設計響應面分析實驗。因素水平及編碼表見表1。

表1 響應面試驗的因素水平
1.2.6 ACE抑制活性的檢測 ACE抑制率的檢測參考駱琳等[18],以FAPGG為底物,在酶標板中按照表2添加反應物,借助酶標儀在340 nm下,測定反應前的吸光度A1,而后在37 ℃下孵育30 min后測定吸光值A2,計算ΔA,ΔA=A1-A2,以單位時間內吸光度值的變化表示ACE酶活性,ACE抑制率的計算為式(2):
表2 ACE抑制活性的測定
式(2)
式(2)中:ΔAb為加入緩沖液時吸光度在30 min內的變化;ΔAa為加入抑制劑時吸光度在30 min內的變化。
1.2.7 水解度DH的測定 采用茚三酮法[19],水解度的計算為式(3):
式(3)
式(3)中:htot:每克原料蛋白的肽鍵毫摩爾數,mmoL/g;c:水解液游離氨基濃度,μmoL/mL;p:水解液蛋白濃度,mg/mL;m:每克原料蛋白的游離氨基的毫摩爾數,mmoL/g。
1.2.8 牡丹籽ACE抑制肽的穩定性 分析根據最佳條件制備ACE抑制酶解液,并凍干即得牡丹籽ACE抑制肽粗肽粉,配制濃度為3 mg/mL的多肽溶液,以ACE抑制率為指標,分別考察溫度、pH以及體外模擬胃腸道酶系對牡丹籽ACE抑制肽穩定性的影響。
1.2.8.1 溫度對牡丹籽ACE抑制肽的穩定性影響 將ACE抑制肽溶液(pH為7.0)分別置于20、40、60、80和100 ℃水浴中保溫2 h,冰水浴冷卻,測定ACE抑制率。
1.2.8.2 pH對牡丹籽ACE抑制肽的穩定性影響 將牡丹籽ACE抑制肽的pH分別調至2.0、4.0、6.0、8.0和10.0,在4 ℃條件下冷藏保存24 h后,調節pH為7.0,測定ACE抑制率。
1.2.8.3 模擬胃消化道對牡丹籽ACE抑制肽活性的影響 將牡丹籽ACE抑制肽溶解于0.1 mol/L的HCl緩沖液(pH2.0)并加入4%(w/w)的胃蛋白酶。在37 ℃水浴條件下水解3 h,然后沸水浴滅酶10 min,冷卻后用NaOH調pH至7.0。8000 r/min離心10 min,測定上清液的ACE抑制率。
1.2.8.4 模擬腸消化道對牡丹籽ACE抑制肽活性的影響 取1.2.8.3中離心前pH為7.0的溶液,加入4%(w/w)的胰蛋白酶,37 ℃水浴條件下繼續水解3 h,然后沸水浴滅酶10 min,冷卻后,8000 r/min離心10 min,測定上清液的ACE抑制率。
1.3 數據處理
采用Graph Pad Prism 7作圖與方差分析、顯著性分析。
2 結果與分析
2.1 牡丹籽粕蛋白的提取
牡丹籽粕蛋白的提取率為65.28%±0.67%,提取的牡丹籽粕蛋白中蛋白含量為77.80%±1.15%。
2.2 水解蛋白酶的篩選
將上述五種酶在各自的最適條件下酶解牡丹籽粕蛋白,以ACE抑制率為指標,同時與未酶解的蛋白進行對比,篩選出制備ACE抑制肽最優的蛋白酶,結果見圖1。

圖1 五種蛋白酶水解對牡丹籽蛋白的ACE抑制率的影響
由圖1可得,牡丹籽蛋白經五種蛋白酶水解作用后,ACE抑制率顯著提高(P<0.05),采用中性蛋白酶得到的酶解液的ACE抑制率最高,堿性蛋白酶次之,且由中性蛋白酶解得到的酶解液的ACE抑制活性顯著高于胃蛋白酶、胰蛋白酶和風味蛋白酶的酶解液(P<0.05)。姜莉等[20]采用木瓜蛋白酶酶解核桃蛋白制備ACE抑制肽,抑制率達88.86%,拉升·再尼西等[21]采用堿性蛋白酶酶解葵花籽粕制備ACE抑制肽,其抑制率為85.49%,宋亮等[22]采用中性蛋白酶酶解玉米蛋白制備ACE抑制肽,得到的最大ACE抑制率為85.65%,周曉晴等[23]采用胃蛋白酶優化酶解鯽魚加工下腳料制備ACE抑制肽,優化后的抑制率可達75.79%。可見在制備ACE抑制肽的過程中,選擇的最佳水解酶不全相同,造成最佳酶制備ACE抑制肽的選擇差異可能與蛋白酶的酶切位點與底物特性相關。研究表明,當多肽C端為Tyr、Pro、Trp、Phe和Leu能表現出較高的ACE抑制活性[22,24],而中性蛋白酶主要酶切位點為Tyr-、Phe-、Trp-,同時在牡丹籽蛋白的氨基酸分析結果顯示,苯丙氨酸與酪氨酸的含量較多[15],所以中性蛋白酶酶切位點較多。綜上,本實驗采用中性蛋白酶為牡丹籽ACE抑制肽制備酶。
2.3 中性蛋白酶酶解制備ACE肽的工藝研究
2.3.1 單因素實驗
2.3.1.1 pH對酶解液ACE抑制率及水解度的影響 由圖2可得,在pH為7.0的條件下,ACE抑制率和水解度達到最大,同時ACE抑制率在pH=7.0時差異顯著(P<0.05),這主要是pH為7.0時是中性蛋白酶的最適pH。在偏離中性蛋白酶的最適pH時,ACE抑制率與水解度同時降低,因為此時中性蛋白酶酶活受到抑制,酶的活性基團的解離狀態發生改變,酶和底物的結合力降低,因而酶反應速率降低,酶解效率也降低,進而使得ACE抑制率和水解度降低。因此選擇最佳酶解pH為7.0。

圖2 pH對水解度和酶解液ACE抑制活性的影響
2.3.1.2 加酶量對酶解液ACE抑制率及水解度的影響 由圖3可得,ACE抑制率隨著加酶量的增加呈先增大后降低的趨勢,加酶量從2000 U/g增加到6000 U/g時,ACE抑制率和水解度顯著增加(P<0.05),且ACE抑制率在加酶量為6000 U/g達到最大。而后繼續增大加酶量,水解度繼續升高,而ACE抑制率降低,主要可能是ACE抑制肽被水解更多不具有ACE抑制活性的片段小肽,以致于活性降低[25]。故選擇最佳加酶量為6000 U/g。
圖3 加酶量對水解度和酶解液ACE抑制活性的影響
2.3.1.3 底物濃度對酶解液ACE抑制率及水解度的影響 由圖4可得,在底物濃度為0.5%~2%(w/v)的范圍內,ACE抑制率和水解度隨著底物濃度的增加而增加,且變化顯著(P<0.05);當底物濃度為2%(w/v)時,ACE的抑制率與水解度達到最高值,在底物濃度達到2%(w/v)后繼續增大底物濃度,ACE抑制率與水解度變化不顯著(P<0.05)。原因可能是底物濃度加大,液體黏度變大,底物流動性變差,與酶的接觸碰撞機會少,導致酶解效率下降[26],同時水解度也達到飽和狀態。故選擇最佳底物濃度為2%(w/v)。
圖4 底物濃度對水解度和酶解液ACE抑制活性的影響
2.3.1.4 時間對酶解液ACE抑制率及水解度的影響 由圖5可得,選取的時間對于酶解液ACE抑制率的影響較小,可能在1 h前迅速水解,在2 h時酶解液ACE抑制率達到最大,在大于2 h后,水解度繼續顯著增加,但ACE抑制率下降,可能部分ACE抑制肽繼續被水解成活性低的小肽。故選擇最佳水解時間為2 h。

圖5 時間對水解度和酶解液ACE抑制活性的影響
2.3.1.5 溫度對酶解液ACE抑制率及水解度的影響 由圖6可得,隨著溫度的增加,酶解液ACE抑制率與水解度都不斷增大,當達到50 ℃時,ACE抑制率和水解度達到最大值,但溫度繼續增大時,ACE抑制率與水解度都明顯下降,可能是由于溫度高使得中性蛋白酶結構發生改變,蛋白酶失活[27],使得水解得到ACE抑制肽較少,水解度也降低。故選擇最佳水解溫度為50 ℃。
圖6 溫度對水解度和酶解液ACE抑制活性的影響
2.3.2 牡丹籽粕酶解制備ACE抑制肽的響應面優化
2.3.2.1 響應面回歸模型的建立與分析 基于單因素實驗結果分析,由于在pH和溫度的單因素實驗中,ACE抑制率和水解度的變化趨勢同步,但在加酶量與時間的單因素實驗中,ACE抑制率和水解度的變化趨勢不同步,可見ACE抑制率并不總是與水解度呈正相關關系。因此本實驗只采用ACE抑制率(R)為響應值,選擇pH(A)、加酶量(B)和溫度(C)這三個因素為自變量,進行三因素三水平的響應面試驗,并選定底物濃度為2%(w/v),酶解時間為2 h,試驗設計因素編碼及水平見表1。具體響應面試驗方案及結果見表3,利用Design-Expert 10.0.4 對響應結果進行方差分析(見表4)。

表3 響應面試驗結果
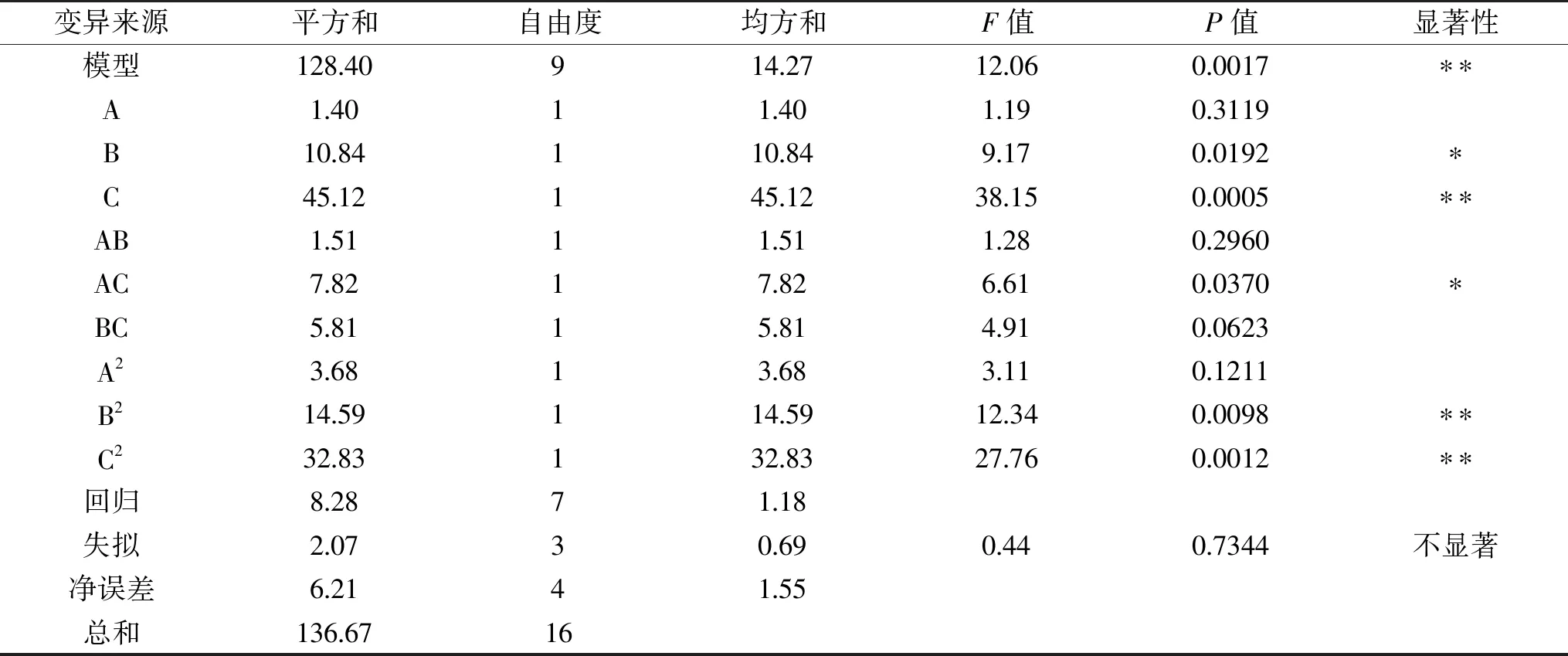
表4 響應面模型回歸方程方差分析
利用Design-Expert 10.0.4對表3中的實驗數據進行多元回歸擬合,得到二次多項回歸方程:Y=85.46-0.42A+1.16B-2.37C+0.16AB-1.4AC-1.2BC-0.93A2-1.86B2-2.79C2。模型P值極顯著(P<0.01),且失擬項不顯著(P>0.05),表明回歸模型比較穩定,模型是理想的。表 5中,決定系數R2為0.9394,這表明該模型與實際試驗擬合較好,校正后的決定系數為0.8616,與R2較接近,說明了模型具有通用性[28]。變異系數CV%<10%,表明可信度比較高。因素A一次項不顯著(P>0.05),因素B顯著(P<0.05),因素C極顯著(P<0.01),說明溫度對ACE抑制率的影響極顯著,加酶量對ACE抑制率的影響顯著,而pH對ACE抑制率影響不顯著。交互項AC偏回歸系數達到顯著水平(P<0.05),說明pH與溫度交互作用顯著(P<0.05),而其他兩項交互作用不顯著(P>0.05)。這三個因素中的二次項B2、C2對ACE抑制率影響均極顯著(P<0.01)。此外,從表4的F值可得,三個因子對酶解液ACE的抑制率的影響大小順序為:溫度>加酶量>pH。

表5 回歸方程的可信度分析
等高線圖可以直觀地反映兩變量交互作用的顯著程度,圓形表示兩因素交互作用不顯著,而橢圓形或者馬蹄形與之相反。由圖7可以看出溫度與pH的交互作用三維立體圖的等高線圖為橢圓,說明溫度與pH的交互作用顯著。
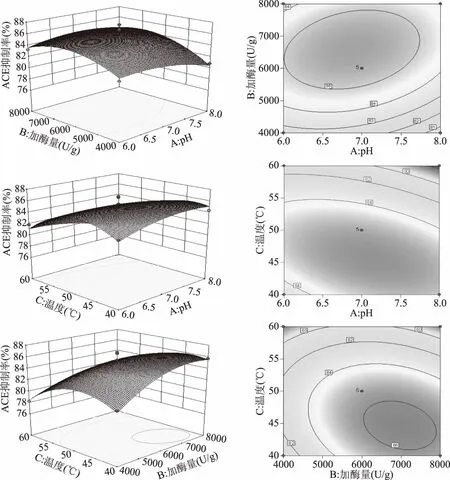
圖7 各因素交互三維曲面圖和二維等高線圖
2.3.2.2 驗證實驗 利用Design-Expert 10.0.4 軟件進行工藝參數的優化組合,得到中性蛋白酶酶解牡丹籽蛋白制備ACE抑制肽的最佳工藝為:底物濃度為2%(w/v),pH7.48,加酶量7222 U/g,酶解溫度43.22 ℃,酶解時間2 h,在此條件下酶解液的ACE抑制率可達到86.52%。為了驗證回歸方程預測結果的可靠性,進行驗證實驗,又考慮到操作的可行性,采用酶解條件為:底物濃度為2%(w/v),pH7.5,加酶量7200 U/g,溫度43 ℃,酶解時間2 h,三次試驗,得到的驗證結果為86.93%±2.38%,與理論相對誤差為0.47%,說明該優化酶解工藝的模型預測值與實際情況擬合度很高,響應面分析法對最優工藝的預測準確可行。
2.4 牡丹籽ACE抑制肽的穩定性
2.4.1 溫度對牡丹籽ACE抑制肽的穩定性影響 由圖8(a)可知,當溫度條件在20~100 ℃變化時,ACE抑制率變化不顯著(P>0.05),說明牡丹籽ACE抑制肽的抑制活性受溫度的影響不大,ACE抑制肽在一定范圍內具有良好的溫度穩定性。
2.4.2 pH對牡丹籽ACE抑制肽的穩定性影響 由圖8(b)可知,當pH條件在2.0~10.0變化時,ACE抑制率變化不顯著(P>0.05),說明牡丹籽ACE抑制肽的抑制活性受酸堿的影響小,ACE抑制肽在一定范圍內具有良好的酸堿穩定性。
2.4.3 體外模擬胃腸消化道酶系對ACE抑制活性的影響 由圖8(c)可知,牡丹籽ACE抑制肽在經模擬胃、腸消化酶消化前后的ACE抑制活性分別為:87.03%±2.00%、88.67%±0.41%、85.06%±0.59%。結果顯示經過胃蛋白酶消化和經過胃蛋白酶與胰蛋白酶消化,ACE抑制率對比未消化的牡丹籽ACE抑制肽都變化不顯著(P>0.05),說明牡丹籽ACE抑制肽具有體外胃腸消化穩定性。

圖8 牡丹籽ACE抑制肽的溫度、酸堿和體外消化的穩定性
3 結論
在單因素實驗基礎上,采用響應面設計進行試驗優化,確定中性蛋白酶酶解牡丹籽粕蛋白制備ACE抑制肽的最佳工藝條件為:底物濃度為2%(w/v),pH7.5,加酶量為7200 U/g,酶解溫度43 ℃,酶解時間2 h,實際抑制率可達到86.93%±2.38%。牡丹籽ACE抑制肽具有良好的溫度穩定性、酸堿穩定性和體外胃腸道消化穩定性。本研究得到了較高的ACE抑制率和良好穩定性的牡丹籽多肽,為牡丹籽粕的開發利用提供了一定的指導方向,從而為進一步拓寬牡丹籽產業提供思路。

