完全腹腔鏡與開腹手術治療復發性肝癌的療效及外周血SDF-1/CXCR4的動態變化
黃致遠,梅洪亮,胡逸林,金煒東
(中國人民解放軍中部戰區總醫院普通外科,湖北 武漢,430071)
肝癌是臨床常見的惡性腫瘤之一,具有高復發傾向,目前暫無有效方法能將其阻斷。肝癌復發的原因在于腫瘤的同源性及術中可能引起的擴散轉移等[1]。手術切除是目前治療復發性肝癌最有效的方法,遠期治療效果佳。開腹手術具有手術切口大、操作復雜、術后康復慢等缺點;完全腹腔鏡下切除肝癌組織已得到一定應用,具有切口小、出血少等優點[2-3]。為進一步明確兩種手術的治療效果,對70例復發性肝癌患者分別行開腹切除術與完全腹腔鏡手術,觀察近、遠期臨床療效及外周血基質細胞衍生因子1(stromal cell derived factor-1,SDF-1)及其受體CXCR4的動態變化。現將體會報道如下。
1 資料與方法
1.1 臨床資料 選取2014年2月至2018年1月我科收治的70例復發性肝癌患者,隨機分為兩組,每組35例,兩組患者性別、年齡、肝功能Child分級等臨床資料差異無統計學意義(P>0.05),見表1。納入標準:(1)接受原發性肝癌根治性治療;(2)經細胞學及組織學病理診斷為肝癌復發;(3)無明顯的手術禁忌證;(4)無大血管、膽管侵犯及轉移;(5)肝功能評級[4]:A級或B級;(6)經醫院倫理委員會審批,患者自愿參與本研究。排除標準:(1)腫瘤已侵犯大血管與膽管;(2)明顯的手術禁忌證;(3)肝功能C級;(4)基礎合并癥急性期。
表1 兩組患者臨床資料的比較(±s)
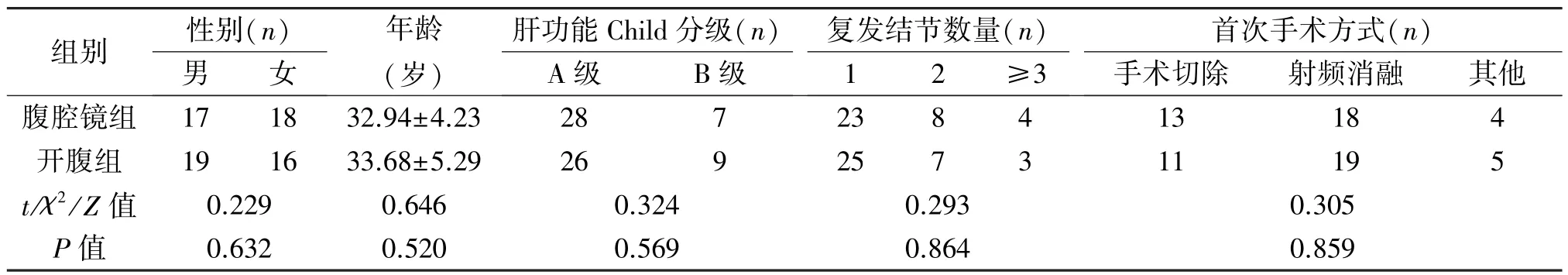
表1 兩組患者臨床資料的比較(±s)
組別 性別(n)復發結節數量(n)肝功能Child分級(n)首次手術方式(n)男 女年齡(歲)A級 B級1 2 ≥3手術切除 射頻消融 其他腹腔鏡組 17 18 32.94±4.23 28 7 23 8 4 13 18 4開腹組 19 16 33.68±5.29 26 9 25 7 3 11 19 5 t/χ2/Z 值 0.229 0.646 0.324 0.293 0.305 P值 0.632 0.520 0.569 0.864 0.859
1.2 手術方法 采用全身插管麻醉。腹腔鏡組[5]:常規五孔法施術,首先于臍上緣做1.5 cm小切口,穿刺氣腹針建立氣腹,壓力維持在8~12 mmHg,如果腫瘤位于 S2、S3段,則采取4孔法施術,左側肋緣下做0.5 cm輔助操作孔即可。打開肝胃韌帶,暴露網膜孔,阻斷肝門(圖1),切除肝癌病灶時用超聲刀分離術野粘連,見圖2,上述操作孔位置盡量避開粘連;如無法避開腹腔粘連,可先行腹腔鏡下粘連分離。分離完成后采用LigaSure電凝止血,如仍不能止血,可用連發鈦夾止血。超聲刀(確保切緣距腫瘤大于2 cm)沿肝表面的切線分離肝實質(圖3)。如術野仍有少量滲血,可使用明膠海綿止血。檢查創面無活動性出血后,于臍側緣擴大切口,取出標本。常規不放置腹腔引流管。開腹組[6]:根據腫瘤位置,可采用腹壁正中或肋緣下斜切口,開腹后分離術野粘連,腫瘤位于S2、S3段,行開腹肝左外葉切除,常規放置腹腔引流管。
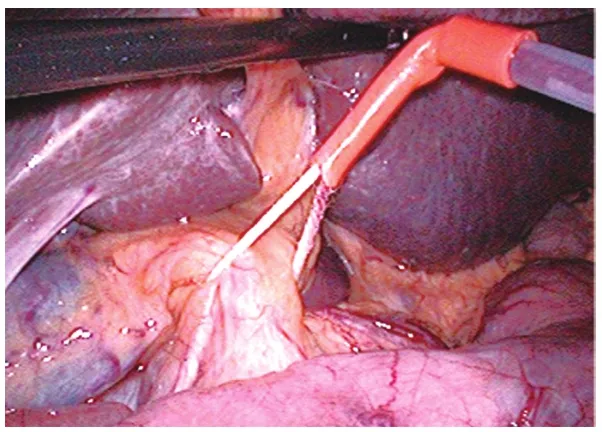
圖1 肝門阻斷
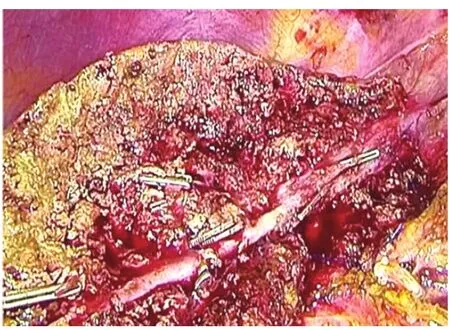
圖2 游離并預處理左靜脈

圖3 左半肝切除斷面
1.3 隨訪情況 手術結束后通過門診及電話隨訪一年,每3個月隨訪1次,主要通過體格檢查、血常規、胸片、結腸鏡檢查確定患者腫瘤復發、轉移情況及生存情況。
1.4 評價標準 比較兩組治療情況、術后疼痛評分、SDF-1/CXCR4的動態變化及預后情況。(1)兩組治療情況:包括手術出血量、住院時間、術后使用鎮痛藥物及進食時間。(2)兩組術后疼痛評分:采用視覺模擬評分法進行評估,采用0~10分評價疼痛程度,分數越高疼痛越劇烈。(3)兩組外周血SDF-1/CXCR4的動態變化:分別于術前、術后第3天取患者空腹靜脈血3 mL,用BCA試劑盒測定蛋白含量,并以10 μg為上樣量進行SDS-PAGE凝膠電泳,將不同相對分子質量的蛋白分離為清晰條帶,轉印至NC膜。5%的脫脂牛奶封閉90 min,進行一抗孵育SDF-1、CXCR4及GAPDH的抗體稀釋濃度分別為 1∶1500、1∶1000、1∶2500,4℃ 孵育過夜。 清洗,進行二抗孵育,SDF-1、CXCR4及GAPDH的抗體稀釋濃度均為1∶1500,暗室顯影。(4)兩組預后:包括術后肝癌轉移、復發情況及術后一年生存率,于術后定期復查項目包括甲胎蛋白、癌胚抗原、肝功能指標等,數值異常者進行肝臟強化CT檢查,新發癌灶與手術切緣相連或位于肝臟其他部位均為肝癌復發,出現在肝外視為肝癌轉移。
1.5 統計學處理 采用SPSS 18.0軟件進行數據分析,計數資料以率表示,采用χ2檢驗,計量資料以(±s)表示,采用t檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 兩組治療情況的比較 腹腔鏡組手術出血量、住院時間、術后使用鎮痛藥物、進食時間均優于開腹組,差異有統計學意義(P<0.05)。見表2。
2.2 兩組術后疼痛情況 術后第1天、第3天,腹腔鏡組疼痛評分較術前升高;術后第1天、第3天、第5天、第7天,開腹組疼痛評分較術前升高(P<0.05),腹腔鏡組疼痛評分均低于開腹組,差異有統計學意義(P<0.05)。見表3。
2.3 兩組外周血SDF-1、CXCR4的動態變化 術后,兩組SDF-1、CXCR4均低于術前,差異有統計學意義(P<0.05),其中腹腔鏡組低于開腹組,差異有統計學意義(P<0.05)。見表4。
表2 兩組治療情況的比較(±s)
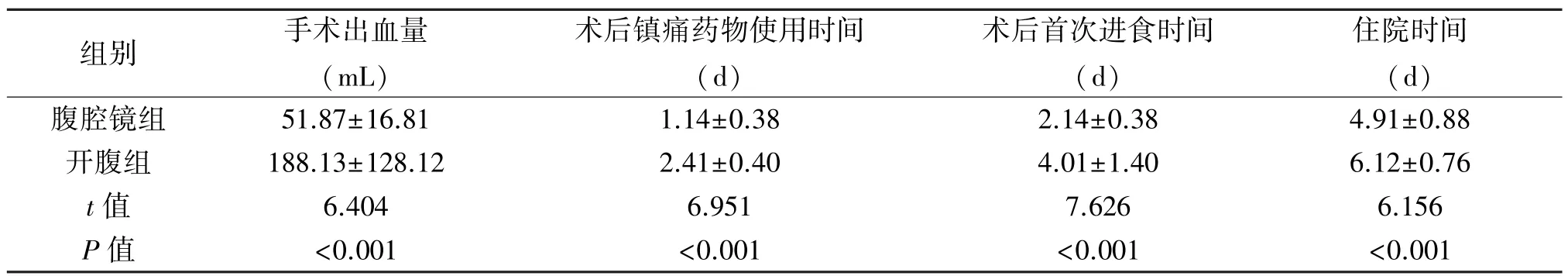
表2 兩組治療情況的比較(±s)
手術出血量 術后鎮組別 (mL)痛藥物使用時間(d)術后首次進食時間(d)住院時間(d)腹腔鏡組 51.87±16.81 1.14±0.38 2.14±0.38 4.91±0.88開腹組 188.13±128.12 2.41±0.40 4.01±1.40 6.12±0.76 t值 6.404 6.951 7.626 6.156 P 值 <0.001 <0.001 <0.001 <0.001
表3 兩組患者術后疼痛情況的比較[(±s),分]

表3 兩組患者術后疼痛情況的比較[(±s),分]
?P<0.05 vs.術前 1 d
組別 術前1 d 術后第1天 術后第3天 術后第5天 術后第7天腹腔鏡組 1.52±0.60 2.32±0.60? 2.09±0.71? 1.92±0.87 1.73±0.66開腹組 1.48±0.72 3.19±0.81? 2.90±0.86? 2.72±0.78? 2.29±0.82?t值 0.252 5.106 4.297 4.051 3.147 P值 0.801 <0.001 <0.001 <0.001 0.002
表4 兩組患者外周血SDF-1、CXCR4動態變化的比較[(±s),分]

表4 兩組患者外周血SDF-1、CXCR4動態變化的比較[(±s),分]
組別 SDF-1 CXCR4術前 術后 P值 術前 術后 P值腹腔鏡組 0.97±0.10 0.34±0.08 <0.001 0.78±0.08 0.06±0.02 <0.001開腹組 0.98±0.12 0.56±0.05 <0.001 0.81±0.07 0.16±0.11 <0.001 t值 0.379 13.796 1.670 5.292 P值 0.706 <0.001 0.100 <0.001
2.4 兩組預后情況的比較 兩組肝癌轉移、復發、1年死亡率差異無統計學意義(P>0.05)。見表5。
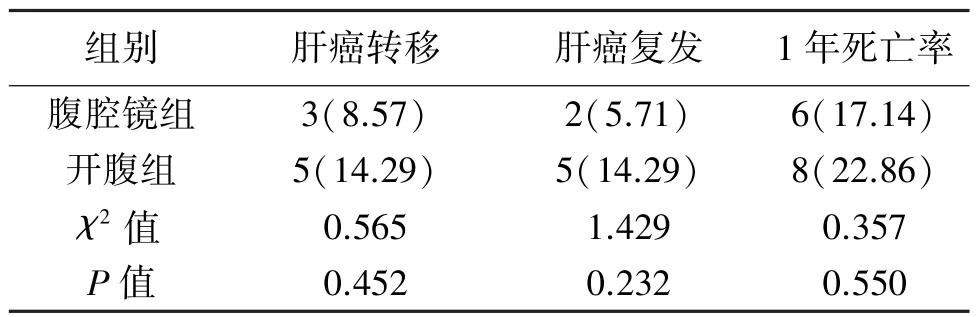
表5 兩組患者預后情況的比較[n(%)]
3 討 論
原發性肝癌經過手術切除后,術后3年復發率高于50%,直接影響肝癌患者的遠期療效[7]。復發性肝癌的治療方法有多種,如再手術切除、經皮穿刺腫瘤內無水酒精注射、射頻治療、氬氦刀冷凍治療等,其中常用的還是手術切除[8]。肝癌再手術切除尤其面對復發灶的再手術,機體對手術的耐受力有限,加大了手術難度與風險。近年完全腹腔鏡手術治療復發性肝癌由于具有切口小、手術出血量少、利于術后康復等優點,得到了更多應用[9]。
目前,手術切除治療肝癌已得到廣泛認可,靳和平等[10]對比了開腹切除術與射頻消融術治療原發性肝癌的療效,發現開腹切除術后患者康復較慢,對其免疫功能指標的影響較大。近年完全腹腔鏡手術已廣泛應用于臨床,周兵等[11]比較了腹腔鏡與開腹手術治療小肝癌的療效,發現腹腔鏡組住院時間明顯縮短,患者恢復速度加快,但隨訪5年后,兩組生存率差異并無統計學意義,表明手術方式對患者預后的影響較小。張杰等[12]評價了完全腹腔鏡手術治療復發性肝癌的效果,發現完全腹腔鏡手術可明顯改善復發性肝癌患者的圍手術期指標,降低住院費用。
本研究中,腹腔鏡組手術出血量、住院時間、術后使用鎮痛藥物及進食時間均低于開腹組(P<0.05);術后第1天、第3天、第5天、第7天,開腹組疼痛評分均高于術前1 d,高于相同時點腹腔鏡組(P<0.05),提示與開腹切除術相比,完全腹腔鏡手術不僅可有效控制手術出血、縮短住院時間,還可減輕術后疼痛。完全腹腔鏡手術優化了整個切除過程,原因為:(1)腹腔鏡手術的第一步是建立氣腹,氣腹壓力的升高會使肝癌粘連處的張力增大,更利于分離;(2)完全腹腔鏡手術的術野較大,利于分離粘連,對于部分非手術區的粘連,也可通過器械避開;(3)通過LigaSure電凝止血、其他直線切割閉合器的輔助,可進一步減少手術出血;(4)手術切口小,手術風險明顯降低,減輕了患者恢復期的痛苦。完全腹腔鏡手術也存在一定局限,主要在于:(1)不易控制術中出血情況,如肝癌伴肝硬化患者,術中易滲血,如不能及時控制會影響手術效果;(2)不適于體積較大的肝癌切除,因為完全腹腔鏡的技術限制,發展較緩慢,在腔鏡下切割肝實質、阻斷肝門等基本操作較困難;(3)不適于病灶位置深、多發、合并多臟器功能不全的患者。術前應對患者的病史、體質、病灶進行嚴格評估,謹慎選擇手術方案;術中評估腫瘤情況,利用超聲刀判斷腫瘤與四周血管的情況,減少手術出血,提高手術安全性;此外,腔鏡手術可探查腫瘤周圍、肝膽血管的行徑及關系,對肝切除具有一定的指導作用。
SDF-1最初發現于小鼠骨髓基質細胞分泌的細胞因子,后經證實主要由基質細胞分泌[13]。目前,發現的SDF-1受體主要有CXCR4、CXCR7兩種,因CXCR7發現較晚,醫學界對SDF-1/CXCR7生物軸的認識尚處于初期階段,SDF-1/CXCR4軸則已被證實參與了多種腫瘤的病灶轉移過程[14]。孫小英等[15]的研究建立了結直腸癌肝臟轉移瘤的裸鼠模型,發現SDF-1及其受體CXCR4可能參與了結腸癌肝轉移過程,其機制可能與SDF-1誘導細胞增殖及定向遷移有關。陳民佳等[16]的研究發現低濃度H2O2通過活化干細胞SDF-1/CXCR4信號軸,活化其下游PI3K/AKT/mTOR信號通路,促進干細胞增殖與遷移。因此,SDF-1/CXCR4信號軸與癌細胞的增殖、轉移均有一定聯系。本研究中,兩組SDF-1、CXCR4均低于術前水平,腹腔鏡組術后SDF-1、CXCR4水平低于開腹組(P<0.05),提示手術切除肝癌病灶后,腫瘤細胞轉移、侵襲能力均出現降低;而完全腹腔鏡手術可進一步減弱術后癌細胞增殖與轉移的危險性,與既往研究結論相似[17-18]。手術結束后,兩組肝癌轉移、復發、1年死亡率差異無統計學意義(P>0.05),推測可能由于肝癌本身轉移率與復發率較高,經過再切除也不能完全根除病灶,因此降低肝癌患者復發率、提高遠期療效的方法仍需進一步研究。
綜上所述,相較開腹切除術,完全腹腔鏡手術治療復發性肝癌在手術出血量、住院時間、術后疼痛方面優于開腹切除術,同時可更快地降低患者體內外周血SDF-1/CXCR4水平,治療有效率較高。

