蘋果樹腐爛病菌VmSom1 基因克隆與序列分析
王怡霖,趙 濤,孫庚午,刁雨菲,馮軍利,于 濤,何邦令*,劉會香*
1.山東農業大學植物保護學院/山東省林業有害生物防控工程技術研究中心,山東 泰安 271018
2.泰安市徂徠山林場,山東 泰安 271027
3.淄博市淄川林業局,山東 淄博 255100
蘋果樹腐爛病(Valsa canker of apple)是由蘋果黑腐皮殼菌(Valsa mali)引起的一種嚴重枝干病害,分布廣,危害嚴重[1]。開展蘋果樹腐爛病菌致病相關機制的研究對于科學防控病害具有重要意義。目前蘋果樹腐爛病菌致病相關因子主要包括降解酶類物質、毒性次生代謝物、分泌蛋白、轉錄因子等[2-5]。降解酶類物質主要包括果膠酶和根皮苷降解酶等[6],毒性次生代謝物包括聚酮合成酶、二甲基丙烯基色氨酸合成酶、非核糖體多肽合成酶和異香豆素類物質等[6],分泌蛋白、轉錄調控因子如HMG[8]、VmSeb1[9]、VmPacC[10]、VmPxE1[11]、天鵝絨蛋白(Velvet protein)家族中的VmVe[12]以及VmPoDs[6]、VmXyl1[7]、VmPmk1[13]、VmE02[14]、VMAGO2[6]和編碼異源三聚體G蛋白α亞基的基因Gvm2和Gvm3[15]等,上述致病相關因子在病菌的生長發育和致病過程中均發揮重要作用。
Som1(cAMP-dependent protein kinase pathway protein)是位于環化腺苷酸信號途徑(cAMP-PKA)下游的重要轉錄因子。目前,對于Som1基因在酵母(Saccharomyces cerevisiae)中的同源基因flo8的研究較為深入,flo8可與轉錄抑制子Sfl1 共同調控酵母細胞間的粘附力,使酵母牢固附著并穿透培養基[16]。在絲狀真菌中構巢曲霉(Aspergillus nidulans),Som1的同源基因SomA調控真菌菌絲形態建成和致病性,煙曲霉中SomA基因的缺失導致生長緩慢和無性發育的阻滯,只能形成沒有進一步分化的氣生菌絲,且SomA是生物膜形成所必需的[17]。在Magnaporthe oryzae中,MoSom1在孢子和附著物的發育是必需的,并且在孢子形成期間在細胞壁分化,調節黑色素沉著和細胞表面疏水性中起作用,對于亞細胞定位和生物學功能是必需的[18,19]。大麗輪枝菌(Verticillium dahliae)中,Som1調控真菌粘附和根部穿透、控制隔膜定位和空泡的大小,隨后控制菌絲形成,包括氣生菌絲形成和正常菌絲分支,致病性所需的發育遺傳網絡[20]。在模式昆蟲病原真菌(Metarhizium acridum)中,Som1的同源基因MaSom1的缺失降低了分生孢子產量,延遲了分生孢子萌發,并削弱了對熱和UV-B的真菌耐受性,降低了真菌的毒力。此外,MaSom1對于細胞壁完整性和分生孢子表面結構也有重要作用[21]。
在實驗室前期已構建的Valsa maliATMT(Agrobacterium tumefaciensmediated transformation,ATMT)突變體庫基礎上[22],通過轉化子表型篩選,獲得了一突變株V23。應用hiTAIL-PCR方法分離克隆了側翼序列,獲得了VmSom1突變基因。本研究分析了基因序列和編碼蛋白功能域特征,研究結果為進一步明確該基因功能奠定了基礎。
1 材料與方法
1.1 實驗材料
蘋果樹腐爛病菌菌株sdau11-175由本實驗室分離保存;隨機挑選pKO1-HPH載體所構建的ATMT轉化子50個[22],所有轉化子均由本實驗室獲得并在20%甘油4 ℃低溫保存;引物合成及序列測定由北京華大基因科技有限公司完成;大腸桿菌(Escherichia coli)DH5α感受態細胞、pMD18-T載體購自寶生物工程(大連)有限公司、克隆載體pEASY-T1購自北京全式金生物有限責任公司。
1.2 突變體篩選
篩選以轉化子菌落生長速率、培養學特性和致病性差異顯著性為評價指標。以野生型菌株sdau11-175為參照菌株,在25 ℃PDA培養基上培養,十字交叉法測定5 d的菌落生長直徑,計算菌落生長速率,實驗重復5次;同時記錄菌落形狀、顏色和氣生菌絲發達程度;準備成熟度和大小一致紅富士蘋果,采用五點刺傷接種法,每個蘋果接種4個點,每個轉化子共接種12個點,接種后使用保鮮膜保濕,置于25 ℃黑暗培養,重復3次,7 d后測定病斑直徑,數據處理采用SPSS方法(P<0.05)[8]。
1.3 突變體側翼序列克隆
以上述篩選出的突變體為目標菌株進行基因組總DNA提取,突變體T-DNA插入位點左右的側翼序列擴增采用hiTAIL-PCR方法[23]。L(R)B2不添加5’端接頭。在一級反應中,使用的模板是突變體菌株的基因組總DNA,在二級和三級反應中,使用模板則分別為上一級反應產物稀釋1000倍。產物在1.5%瓊脂糖凝膠中電泳,以1 kb Maker為參照,將PCR特異性產物經回收、連接、大腸桿菌轉化,菌落PCR檢測和華大基因測序后得到的側翼序列進行NCBI Blastx在線分析,使用BioEdit軟件結合G enbankValsa mali03-8基因組序列進行本地分析[4],獲得兩端側翼序列全長。引物序列見表1,反應程序見[24]。

表1 本研究hiTAIL-PCR 引物Table 1 Primers of hiTAIL-PCR in this research
1.4 突變基因全長序列克隆
依據上述兩端側翼序列設計引物(F1-ATGAATAACGTCA ACATGGCCAATATGGA,R1-TCAC CGGACCCTAAGTCTCTATCTCCG),分別以野生型菌株sdau11-175和突變株基因組總DNA為模板進行PCR擴增,獲取突變基因和含有T-DNA的突變基因全長序列。同時與已報道的V.mali03-8菌株的基因組序列進行比對分析,以確定T-DNA的插入位點及方式。
1.5 突變基因序列分析
使用NCBI的在線工具ORF FINDER和Graphics分別確定VmSom1的開放閱讀框和內含子;在Genbank下載Neurospora crassa、Aspergillus nidulans、Magnaporthe oryzae、Aspergillus fumigatus、V.mali03-8、Candida albicans、Saccharomyces cerevisiae、Phaeoacremonium minimum、Diaporthe ampelina、Colletotrichum orbiculare、Colletotrichum gloeosporioides、Colletotrichum salicis、Eutypa lata、Verticillium alfalfae、Madurella mycetomatis、Ophiocordyceps sinensis、Ustilaginoidea virens、Fusarium fujikuroi、Metarhizium guizhouense以及Valsa malivar.Pyri中與sdau11-175VmSom1基因同源性高的序列,用MEGA 6采用Neighbor-Joining method方法對突變基因進行1000次置信度自展系統進化分析;使用ExPASy-ProtParam在線工具對突變基因編碼蛋白質的理化性質進行分析;使用ExPASy-ProtScale在線工具對突變基因編碼蛋白質的疏水性進行分析;使用在線SOPMA和Phyre2對突變基因編碼蛋白的二級結構進行分析。應用在線軟件CDD-search (https://www.ncbi.nlm.nih.gov)和http://smart.emblheidelberg.de/index2.cgi對蛋白功能域進行預測。
2 結果與分析
2.1 突變體篩選
與野生型菌株sdau11-175相比,隨機挑選的50個蘋果樹腐爛病ATMT轉化子中有49個生長速率、菌落特征與致病力差異不顯著。轉化子V23表現出生長速率顯著減慢和致病力完全喪失的特征(圖1)。同時V23菌落表面比較濕潤,氣生菌絲生長弱、不產生子實體(圖2)。說明突變體V23調控的基因對蘋果樹腐爛病菌的生長發育及致病性有重要作用。
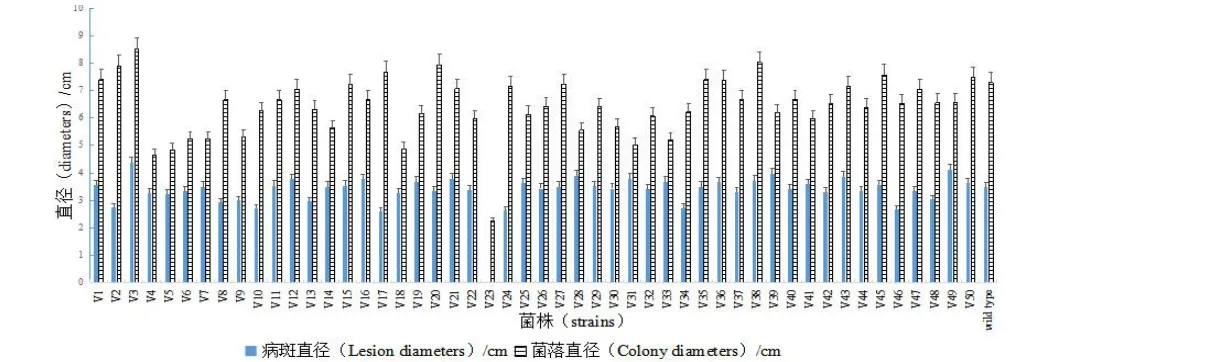
圖1 蘋果腐爛病菌轉化子的生長速率和致病性測定Fig.1 Growth rates and pathogenicity characters of transformants of pathogen
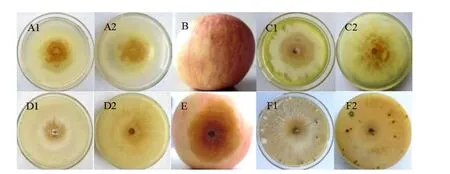
圖2 突變體V23 和野生型sdau11-175 菌落形態、子實體產生和致病性測定結果Fig.2 Colony morphology,fruiting body generation and pathogenicity of mutant V23 and wild-type SDAU11-175
2.2 突變體側翼序列及全長序列的克隆
以突變體V23基因組DNA為模板,應用hiTAIL-PCR方法進行T-DNA插入側翼序列克隆。在突變體V23的T-DNA左邊界L3得到了約1900 bp的特異性片段,在右邊界R3得到了約2200 bp的特異性片段。V23突變體側翼序列不同步驟PCR擴增結果見圖3。以V.malisdau11-175基因組DNA為模板,使用兩端側翼引物序列克隆全長突變基因,其大小為2723 bp。
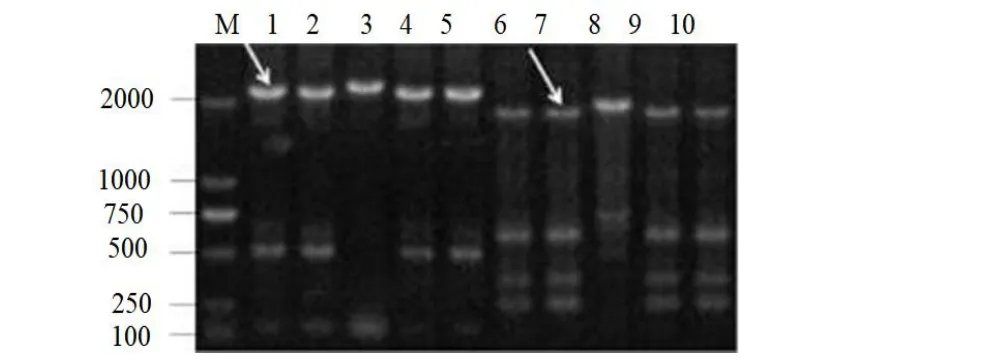
圖3 突變體V23 的側翼序列克隆Fig.3 Cloning of flanking sequences of V23 mutants
2.3 突變基因序列分析
2.3.1 突變基因核苷酸序列分析 突變基因編碼區長2475 bp,編碼824 個氨基酸,基因組DNA 含有5 個外顯子和4 個內含子。將突變基因全長序列和V.mali03-8 序列比對,并將二者的氨基酸序列比對,去除密碼子簡并性因素,二者的氨基酸完全一致,說明在同一種真菌中該突變基因編碼的蛋白相對保守。突變體V23 中的T-DNA 插入位點位于V.mali第12 號染色體(CM003109.1)的69537與69547 之間,在編碼假定蛋白的基因VMIG_09677(GenBank:KUI74346.1)的第一個外顯子中(圖4)。被注釋為編碼蛋白Adhesion defective protein 3,該基因與Som1同源,故將其命名為VmSom1,在V.mali03-8 基因組中比對發現,VmSom1為單拷貝。

圖4 突變體T-DNA 側翼序列測序及T-DNA 插入位點Fig.4 T-DNA flanking sequences and insertion position of mutants
系統進化分析發現(圖5),蘋果腐爛病菌VmSom1基因與其他20種真菌中的Som1及其同源基因的親緣關系遠近各不相同,其中與同屬真菌(梨腐爛病菌)真菌內Som1基因編碼的氨基酸序列相似性很高,同源性高達98.79%;與不同屬真菌(如稻瘟病菌、煙曲霉、構巢曲霉等)差異較大,蛋白質的特異性及功能主要取決于一級結構,推測不同屬真菌的Som1蛋白功能可能存在一定差異。
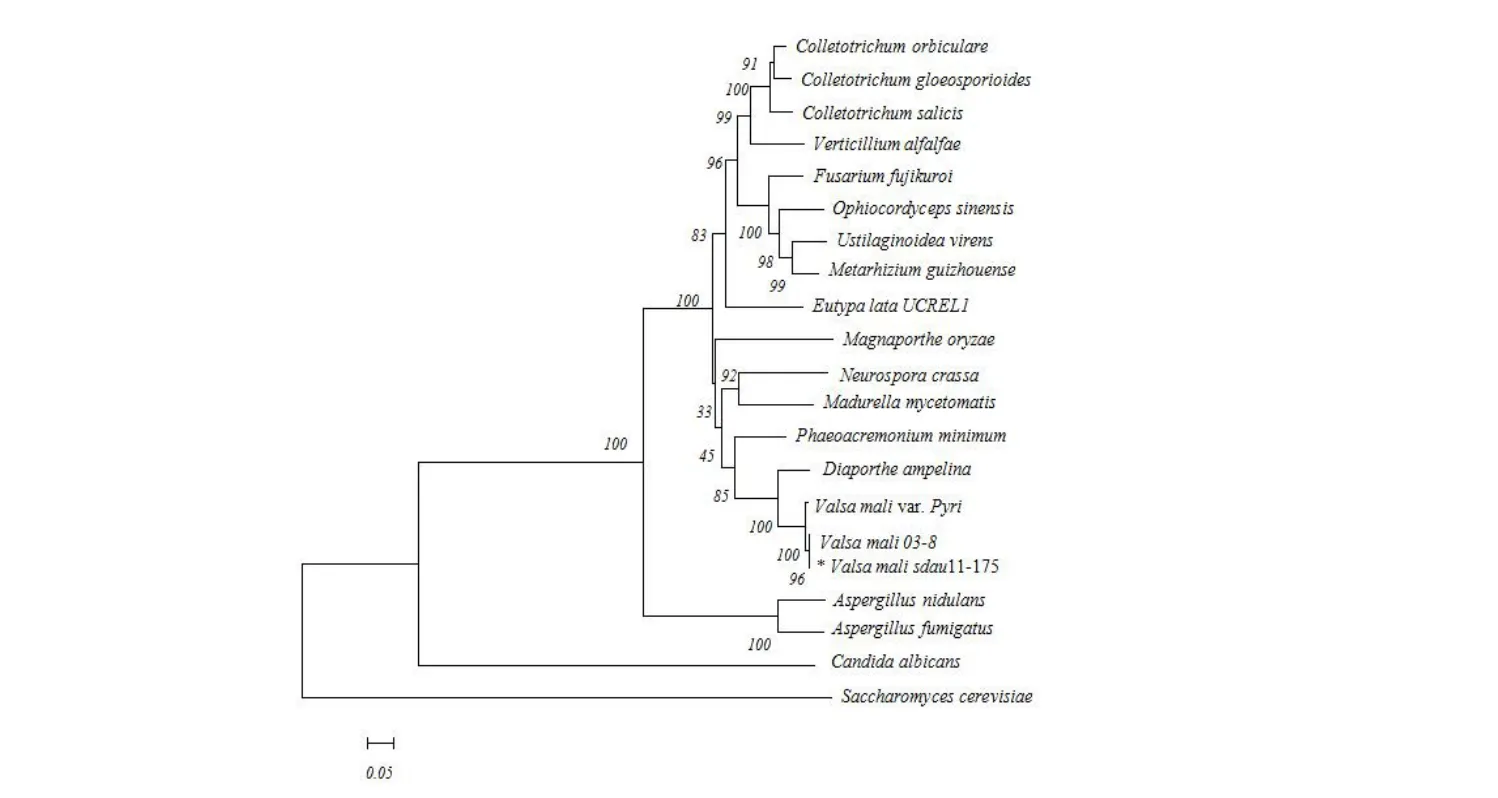
圖5 蘋果腐爛病菌VmSom1 蛋白的NJ 系統進化分析Fig.5 NJ Phylogenetic analysis of VmSom1 protein of Valsa mali
2.3.2 突變基因編碼蛋白的功能域預測Valsa mali與Magnaporthe oryzae、Aspergillus fumigatus中均存在LisH 結構域和核定位信號肽(NLS)結構域,其中VmSom1 蛋白的LisH 結構域位于N 端43-75 aa,長為33 aa,同時在259-272 aa 處存在著核定位信號肽NLS,長為14 aa(圖6)。

圖6 三種病原菌Som1 基因編碼蛋白的功能域分析Fig.6 Functional domain analysis of proteins encoded by three pathogenic Som1 genes
2.3.3 突變基因編碼的蛋白質結構和理化性質分析 利用Expasy-Protparam 在線工具對蛋白的基本理化性質進行預測后發現,蘋果腐爛病菌VmSom1基因的蛋白分子式為C3707H5808N1150O1211S60,相對分子質量(Mr)為87785.47,蛋白質等電點pI 為6.39,理論蛋白分子量約87.82 kDa,不穩定指數為61.07,脂肪指數為39.59,親水性平均指數為-0.959,親水性較強(圖7)。蛋白中存在著20 種氨基酸,其中脯氨酸(13.2%)、谷氨酰胺(13%)、丙氨酸(10%)和天門冬酰胺(9.5%)含量較高,半胱氨酸(0.2%)、色氨酸(0.4%)和酪氨酸(1.1%)含量較低。使用在線Expasy-Protscale 程序分析VmSom1 蛋白質的疏水性后發現,在第134 位氨基酸處有最大疏水值為1.422,在第85 位氨基酸處有最小疏水值為-3.067。VmSom1 蛋白的二級結構預測發現,蛋白二級結構中含有α螺旋211 AA(25.61%),延伸結構37 AA(4.49%),β轉角27 AA(3.28%)和無規則卷曲549 AA(66.63%)。
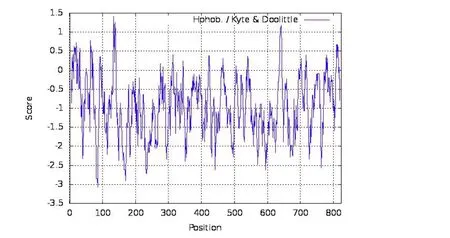
圖7 突變基因編碼的蛋白質疏水性圖Fig.7 Protein hydrophobicity map encoded by mutant gene
3 結論與討論
3.1 結論
本實驗篩選到了V23 菌株,該菌株生長速率明顯減慢,菌落表面較為濕潤,菌絲生長弱,致病性完全喪失,不產生子實體。確定了T-DNA 插入突變基因位于蘋果樹腐爛病菌第12 號染色體69537和69547 之間。該基因的氨基酸序列與Som1基因編碼的camp-dependent protein kinase pathway protein聚為一類,命名為VmSom1。基因大小為2723 bp,含有5 個外顯子和4 個內含子,為單拷貝,編碼區長2475 bp,編碼824 個氨基酸,包含LisH 結構域和NLS 結構域,蛋白分子式為C3707H5808N1150O1211S60,理論蛋白分子量約87.82 kDa,等電點pI 為6.39,親水性較強。
3.2 討論
Som1 是作用于環化腺苷酸信號途徑(cAMP-PKA)下游的轉錄因子。在絲狀真菌中僅構巢曲霉(A.nidulans,Som1)、煙曲霉(A.fumigatus,SomA)、稻瘟病菌(M.oryzae,MoSom1)、大麗輪枝菌(Verticillium dahliae)和昆蟲病原真菌綠僵菌(Metarhizium acridum,MaSom1)中有報道[17-21,25]。
本研究通過蘋果樹腐爛病菌ATMT 突變體表型篩選,獲得了一突變株V23,并發現了突變基因VmSom1。蘋果樹腐爛病菌突變株V23 與稻瘟病菌Som1 缺失突變株(ΔMoSom1)和煙曲霉缺失SomA突變株(ΔSomA)均表現出生長減慢、致病性喪失和不產孢等相似表型[17,18,22],分析發現它們含有相同的LisH 和NLS 結構域,但是系統進化分析顯示不同屬中Som1基因序列差異較大,說明VmSom1可能與MoSom1 和SomA 存在相似功能,但也可能存在不同功能,需要深入研究。
本研究從轉化子生長速率、菌落特征、子實體產生情況及致病性指標進行了突變體篩選,下一步需要找尋更多指標來評價突變體,繼而挖掘更多的突變基因。
本研究是在Liu YG[23]和Wang Z[26]方法基礎上進行,引入了接頭簡并引物,改良了hiTAIL-PCR法,有效提高了克隆效率且有效地降低了短鏈產物產生。該技術也適合于其它真菌染色體步移或側翼序列克隆,具有高通量的特點,值得推廣使用。

