鎘脅迫對蛆癥異蚤蠅幼蟲體內脂質過氧化物含量及抗氧化酶活性的影響
褚夢穎,劉廣純
遼寧省城市有害生物治理與生態安全重點實驗室;沈陽大學生命科學與工程學院,遼寧 沈陽 110044
鎘(Cadmium,Cd)是嚴重危害人類健康的污染物,主要損傷腎臟、骨胳和呼吸系統[1]。具有較高的生物富集指數,并可以通過食物鏈危及人類健康[2,3]。鎘的存在及潛在危害引起人們的廣泛關注[4]。
鎘進入昆蟲體內引起一系列的生理生化反應。鎘通過Ca2+通道穿過細胞膜進入機體,誘導產生大量自由基和活性氧(ROS),ROS 與體內脂質、蛋白質和核酸等生物大分子反應,導致脂質過氧化、細胞膜損傷,并影響多種酶活力,對生物體造成威脅[5]。家蠶五齡幼蟲隨著Cd2+處理濃度的升高,其脂肪體內丙二醛(MDA)含量增加,超氧化物歧化酶(SOD)、過氧化氫酶及谷胱甘肽過氧化物酶活性呈現規律性變化[6]。果蠅隨著鎘處理濃度的升高,體內MDA 的含量也隨之升高,SOD 與CAT活性降低[7]。棕尾別麻蠅在鎘的脅迫下,體內的SOD、CAT 酶活力均受到極顯著影響[8]。鎘的毒性作用與其能夠誘導生物體產生氧化損傷密切相關,并且氧化損傷相關指標變化可以作為機體遭受鎘等重金屬脅迫的生物指示物[9,10]。
蛆癥異蚤蠅Megaselia scalaris是世界廣泛分布的腐食性蠅類,通過取食在體內聚集各種腐敗物質,包括各種污染物,是較理想的檢測污染物生物的實驗動物[11,12]。我們前期研究表明,Cd2+對蛆癥異蚤蠅幼蟲生長、壽命、化蛹率及羽化率均有顯著抑制。但對其體內生理生化過程的影響還未見報道。本研究通過測定在不同濃度Cd2+脅迫條件下,蛆癥異蚤蠅幼蟲體內的抗氧化酶活性及MDA 含量,研究其對昆蟲生理生化過程的影響。
1 材料與方法
1.1 供試蟲源
蛆癥異蚤蠅M.scalaris為2008 年采于沈陽,并在沈陽大學城市有害生物綜合治理與生態安全遼寧省重點實驗室建立的種群。
1.2 試劑
本實驗所用試劑,均購于國內試劑公司(表1)。

表1 實驗所用試劑Table 1 The reagent used in the experiment
1.3 飼養方法
蛆癥異蚤蠅幼蟲采用酪蛋白瓊脂培養基飼養,具體配比見表2。以空白組培養基飼養的蛆癥異蚤蠅幼蟲為對照組,以Cd2+濃度為7.5 μg/g,15 μg/g,30 μg/g 和60 μg/g 培養基飼養的蛆癥異蚤蠅幼蟲為實驗組,每組設3 次重復。恒溫培養箱溫度24±1 ℃,相對濕度75%,光周期12 L:12 D。
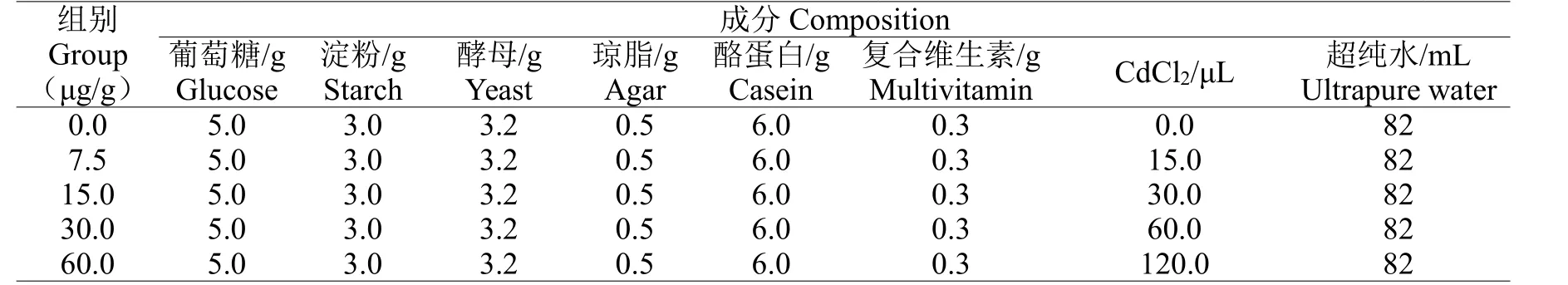
表2 不同實驗組蛆癥異蚤蠅幼蟲培養基成分配比Table 2 The composition of culture medium for the larvae of Megaselia scalaris in different experimental groups
1.4 酶液提取
將供試蛆癥異蚤蠅幼蟲按照1:9(m/v)比例與預冷生理鹽水(0.86%)混合加入到已滅菌的EP管中,冰浴條件下制備成10%的組織勻漿液,將其置于低溫離心機中4 ℃、6000 r/min 離心10 min,取上清液置于0 ℃冰浴待測。
1.5 MDA 含量和酶活力測定
蛋白質含量的測定采用考馬斯亮藍比色法;MDA 含量測定采用硫代巴比妥酸(TBA)法:SOD活性的測定采用黃嘌呤氧化酶法;CAT 活性測定采用可見光法;GSH-PX 活性的測定采用5,5’-二硫代硝基苯甲酸(DTNB)顯色法。本實驗樣品中MDA 和蛋白質含量以及SOD、CAT 和GSH-PX 酶活性均采用購自南京建成生物工程研究所的試劑盒測定。具體操作按說明書進行。
SOD 活性單位定義為1 mg 組織蛋白在1 mL 反應液中SOD 抑制率達50%時所對應的SOD 量為1 個活性單位。
CAT 活性單位定義為1 mg 組織蛋白1 s 分解1 μmol H2O2的量為1 個活性單位。
GSH-PX 活性單位定義為1 mg 組織蛋白1 min 扣除非酶促反應的作用,使反應體系中GSH 濃度降低1 μmol/L 為1 個酶活力單位。
1.6 數據處理
所得數據采用SPSS 22.0 軟件進行One-way ANOVA 分析,Duncan 多重比較方法進行顯著性分析,以P<0.05 作為差異顯著性水平,P<0.01 作為差異極顯著性水平。
2 結果與分析
2.1 Cd2+脅迫對蛆癥異蚤蠅幼蟲體內MDA 含量的影響
如圖1 所示,在空白組(0 μg/g)下,隨著時間的增加,MDA 含量具有一直上升的趨勢,蛆癥異蚤蠅幼蟲體內MDA 含量通常為3.058~3.988 nmol/mg protein。當開始取食Cd2+后,無論是同一時間下,隨著處理濃度的升高,還是相同濃度下,隨著處理時間的增加,蛆癥異蚤蠅幼蟲體內的MDA含量均是上升趨勢,上升了46.763~112.663%。其中在Cd2+處理濃度為60 μg/g,處理時間為5 d 時,MDA 含量升到最高為8.481 nmol/mg protein。在Cd2+處理濃度為7.5 μg/g,處理前期(1~2 d),幼蟲體內MDA 含量與對照組無顯著性差異(P>0.05),其余的處理濃度在各個處理時間測得體內的MDA 含量均與對照呈極顯著性差異(P<0.01)。
2.2 Cd2+脅迫對蛆癥異蚤蠅幼蟲體內SOD 酶活性的影響
從圖2 中觀察發現,較低Cd2+處理濃度下(7.5 μg/g,15 μg/g,30 μg/g),隨著處理時間的增加,體內SOD 酶活性的促進作用均呈現先上升后下降趨勢,均在處理時間3 d 時活力最強,分別對應的酶活性值為82.555 nmol/mg protein,103.610 nmol/mg protein 和88.552 nmol/mg protein,而在高Cd2+處理濃度(60 μg/g)的處理前期(1~2 d),對蛆癥異蚤蠅幼蟲體內的SOD 酶活性起促進作用,并且在處理時間1 d 時達到最大,酶活性為81.880 nmol/mg protein,較對照組差異極顯著(P<0.01),處理后期(3~5 d)對蛆癥異蚤蠅幼蟲體內的SOD 酶活性起抑制作用,并且在處理時間5 d 時,降到最低,酶活性為64.239 nmol/mg protein,較對照組差異極顯著(P<0.01)。
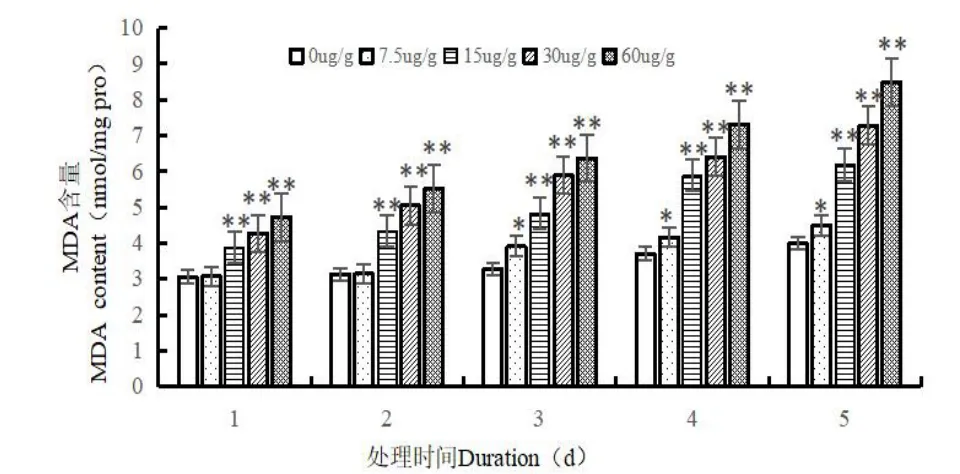
圖1 Cd2+對蛆癥異蚤蠅幼蟲體內MDA 含量的影響Fig.1 Effect of Cd2+on MDA content in the larvare of Megaselia scalaris(Loew)

圖2 Cd2+對蛆癥異蚤蠅幼蟲體內SOD 酶活性的影響Fig.2 Effect of Cd2+on SOD activity in the larvare of Megaselia scalaris(Loew)
2.3 Cd2+脅迫對蛆癥異蚤蠅幼蟲體內CAT 酶活性的影響
由圖3 可以看出,不論同一處理時間下隨著Cd2+處理濃度的升高,還是相同的Cd2+處理濃度下隨著處理時間的增加,蛆癥異蚤蠅幼蟲體內的CAT 酶活性均是先升后降的趨勢,在較低Cd2+處理濃度(7.5 μg/g,15 μg/g,30 μg/g)下,對蛆癥異蚤蠅幼蟲體內CAT 酶活性的影響與SOD 酶活性的影響大體相同,即均起到了促進作用,但不同的是在Cd2+處理濃度為60 μg/g,處理時間為5 d 時,對其CAT 酶活性起到了抑制作用,酶活性降至最低為6.561 nmol/mg protein,較對照組差異顯著(P<0.05)。在較低Cd2+處理濃度(7.5 μg/g,15 μg/g,30 μg/g)下,蛆癥異蚤蠅幼蟲體內CAT 酶活性均在處理時間為3 d 時達到最大值,分別對應的CAT 酶活性值為8.933 nmol/mg protein,10.655 nmol/mg protein,9.667 nmol/mg protein,均較對照組差異顯著(P<0.05),在高Cd2+處理濃度(60 μg/g)下,則在處理時間為4 d 時,CAT 酶活性達到最高,為8.840 nmol/mg protein,較對照組差異顯著(P<0.05)。
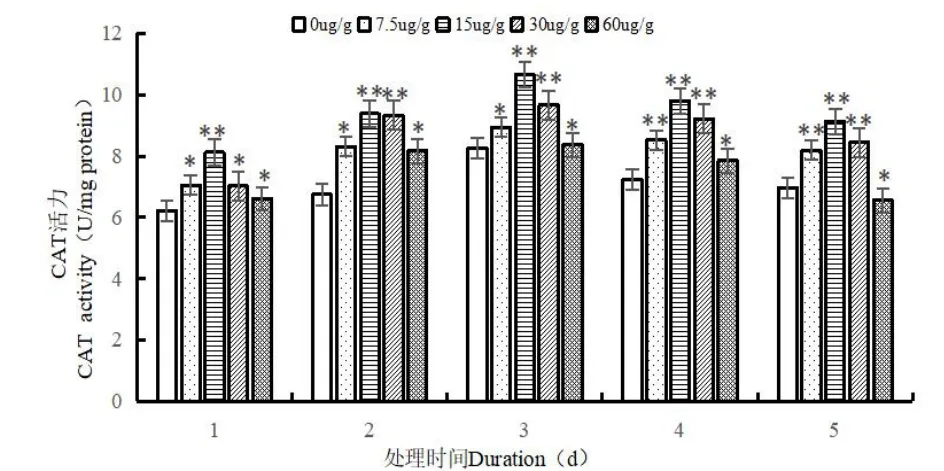
圖3 Cd2+對蛆癥異蚤蠅幼蟲體內CAT 酶活性的影響Fig.3 Effect of Cd2+on CAT activity in the larvare of Megaselia scalaris(Loew)
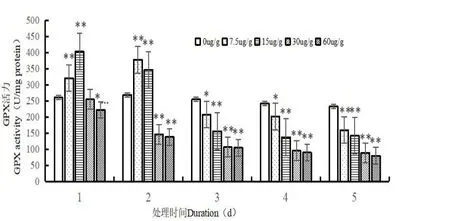
圖4 Cd2+對蛆癥異蚤蠅幼蟲體內GSH-PX 酶活性的影響Fig.4 Effect of Cd2+on GSH-PXactivity in the larvare of Megaselia scalaris(Loew)
2.4 Cd2+脅迫對蛆癥異蚤蠅幼蟲體內GSH-PX 酶活性的影響
如圖4 所示,在處理前期(1~2 d),較低Cd2+處理濃度(7.5 μg/g,15 μg/g)下,對蛆癥異蚤蠅幼蟲體內GSH-PX 酶活性起到顯著促進作用,在處理后期(3~5 d),對幼蟲體內GSH-PX 酶活性起到抑制作用,并且觀察得到在Cd2+濃度為7.5 μg/g 時,隨著處理時間的增加,幼蟲體內GSH-PX酶活性呈現先升后降的趨勢,在Cd2+處理濃度為15 μg/g,處理時間為1 d 時,幼蟲體內GSH-PX 酶活性達到最高,為403.115 nmol/mg protein,較對照組差異極顯著(P<0.01),在處理時間為3 d 時,GSH-PX 酶活性呈現極速下降趨勢,下降了35.210~61.257%,隨著處理時間的增加(4~5 d),幼蟲體內GSH-PX 酶活性依舊呈現下降的趨勢,但較為緩和。在高Cd2+處理濃度(30 μg/g,60 μg/g)下,不論是同一時間下隨著處理濃度的升高,或是相同處理濃度下隨著處理時間的增加,對蛆癥異蚤蠅幼蟲體內GSH-PX 酶活性均起到抑制作用,并且酶活性迅速下降,在Cd2+處理濃度為60 μg/g,處理時間為5 d 時,幼蟲體內GSH-PX 酶活性達到最低,為80.803 nmol/mg protein,較對照組差異極顯著(P<0.01)。
3 討論
鎘通過食物鏈可在昆蟲體內積累[13-17],并對昆蟲的生長發育產生一系列影響[18-20]。其對昆蟲的主要毒性作用之一是產生氧化應激,即細胞膜脂質過氧化[21,22]。氧化應激誘導活性氧引起的細胞損傷。另一方面,昆蟲體內SOD、CAT、GSH-PX 等酶系可以清除由于氧化應激產生的活性氧[23-26]。這些酶的活性隨著活性氧數量的變化而有所差異[21,27-30]。
MDA 是細胞間發生脂質過氧化反應的產物,其含量直接反映產生的自由基[31-34]。本研究顯示,隨著Cd2+處理濃度的升高和處理時間的增加,蛆癥異蚤蠅MDA 含量持續升高(圖1),呈現一定的濃度依賴和時間依賴效應關系。表明蛆癥異蚤蠅幼蟲體內的脂質過氧化程度不斷增加,尤其在3 種抗氧化酶受到抑制而活性降低時,體內大量ROS 無法及時清除,導致幼蟲體內細胞膜損傷。這與其他的學者研究結果一致[9,35]。
CAT 與GSH-PX 作為過氧化氫清除酶,進一步催化由SOD 歧化反應的產物H2O2為無毒的H2O和,以防止機體受到損傷,其活性受H2O2濃度的直接調控[45]。不同Cd2+處理濃度對蛆癥異蚤蠅幼蟲體內氧化應激反應的CAT 活性(圖3)與GSH-PX 活性(圖4)表明,CAT 與SOD 具有相同的變化趨勢。在較低Cd2+處理濃度(7.5 μg/g)的處理前期(1~2 d),GSH-PX 活性明顯高于CAT,表明GSH-PX 更為靈敏,相對更早發揮消除H2O2作用。隨著處理時間的增加及Cd2+處理濃度的升高,GSH-PX 無法及時清除機體內含量升高的H2O2,其活性受到抑制。而CAT 酶活性也有低濃度促進高濃度抑制現象,但變化比較平穩,在一定程度上與GSH-PX 有互補作用。這種呈現低濃度促進,高濃度抑制的變化趨勢與Cd2+對背角無齒蚌氧化損傷效應評估的研究結果類似[46]。

