CalliSpheres 載藥微球栓塞治療消化系統惡性腫瘤肝轉移的初步分析
張景嵐,劉瑞寶
肝臟是多種惡性腫瘤的血行轉移器官,由于消化系統血流主要匯入門靜脈,腫瘤細胞可隨血液入肝,因此肝臟是其血源性轉移最好發的部位[1]。 有數據顯示無法行手術切除的結直腸癌肝轉移的5年生存率接近于0[2],胃癌肝轉移5 年生存率不超過10%[3]。TACE 是目前廣泛應用于肝臟惡性腫瘤如肝癌的治療方法[4-5],其包括 cTACE 和 DEB-TACE,與cTACE 相比DEB-TACE 具有更好的載體效應,療效更好[6],理論上抗腫瘤藥物能以可控和持續的方式釋放,從而提高化療栓塞效力,同時降低全身不良反應[7]。 我院自 2017 年 11 月至 2018 年 11 月針對44 例消化系統惡性腫瘤肝轉移患者行碘油和載藥微球不同栓塞劑的TACE 治療,對其治療效果進行對比研究,現總結如下。
1 材料與方法
1.1 材料
1.1.1 一般資料 收集2017 年11 月—2018 年11 月我院收治的消化系統惡性腫瘤肝轉移患者44 例,按照治療方案分為 DEB-TACE 組和 cTACE 組。DEB-TACE 組18 例。原發腫瘤部位為結腸癌10 例,胃癌 4 例,直腸癌 2 例,食管癌、 胰腺癌各 1 例。cTACE 組26 例。 原發腫瘤部位為結腸癌 10 例,胃癌 5 例,直腸癌 6 例,胰腺癌 5 例。 見表 1。

表1 患者的基線特征
1.1.2 納入及排除標準 納入標準:①原發腫瘤有明確病理診斷;②原發腫瘤治療穩定后經影像學檢查(動態增強CT、超聲造影、動態增強MRI 等)確診肝內有轉移病灶;③肝功能 Child-Pugh 分級 A 或B 級;④ECOG 評分≤2 分;⑤白細胞≥3.5×109/L、血小板≥50×109/L、 凝血功能等指標符合介入治療適應證。 ⑥肝功能ALT、AST 在正常參考值上限的3 倍以內。
排除標準:①肝功能Child-Pagh C 級;②凝血功能障礙;③患有嚴重的心血管疾病(行TACE 治療前6 個月內),如心肌梗塞、不穩定型心絞痛、恰當藥物治療后仍無法控制的高血壓、充血性心力衰竭、需藥物治療的心律失常;④預期生存期<3 個月。
1.2 方法
1.2.1 CalliSpheres 栓塞微球加載化療藥方法 應用CalliSpheres(江蘇恒瑞醫藥有限公司,江蘇,中國)載藥微球(100-300 μm),化療藥物應用吡柔比星。 操作方法:①輕搖微球,用20 mL 注射器抽取載藥微球,將該注射器倒放靜置2~3 min,推出上清液(4~5 mL);②用10 mL 注射器抽取5%葡萄糖溶液配置化療藥(40 mg),用三通連接微球20 mL 注射器與化療藥10 mL 注射器,混合4~5 次,直至混合均勻,靜置30 min 載藥;③載藥完畢后,以10 mL 注射器抽取非離子對比劑,以1∶1 的比例混合載藥微球溶液與對比劑,混合均勻后,靜置5 min 后備用。
1.2.2 術前準備 所有患者術前均完善相關檢查,實驗室檢查:生化系列、血常規、凝血功能、尿常規、腫瘤標志物等,心、肺功能檢查,影像學檢查包括增強CT 或增強MRI,必要時行PET-CT 檢查。
1.2.3 治療過程 患者局部麻醉后,用Seldinger 技術行右側股動脈穿刺,選用5 F 導管置于肝動脈開口,高壓注入對比劑,行肝動脈造影確定腫瘤供血動脈、數目、大小、部位及側支血供等情況。 DEB-TACE組將微導管超選至腫瘤供血動脈,將負載40 mg 吡柔比星的CalliSphere 載藥微球,栓塞肝內病灶至腫瘤血管血流中斷,必要時配合明膠海綿顆粒(350~560 μm)追加栓塞效果。 cTACE 組將微導管超選至腫瘤靶血管內,將栓塞劑超液化碘油(10~20 mL)、吡柔比星40 mg 的混合劑栓塞肝內病灶,以確保已注入碘油沉積于患者腫瘤組織內,同時配合明膠海綿顆粒(350~560 μm)栓塞肝內病灶至腫瘤血管血流中斷。 術后穿刺部位加壓24 h,進行常規保肝、止痛、抗感染治療。 所有患者每次治療前后1 周及1 個月常規復查血常規、肝腎功能等,術后1 個月復查肝臟增強 CT 或 MRI。 治療間隔≥1 個月。
1.2.4 近期療效評價 ①治療4~6 周后行增強CT 或增強MRI 檢查評價 局部病灶控制情況,采用改良實體瘤療效評價標準(mRECIST),分為:完全緩解(CR),部分緩解(PR) ,疾病進展(PD),疾病穩定(SD)(詳見表 2)。 客觀緩解率(ORR) 為 CR+PR,疾病控制率(DCR)為CR+PR+SD。 ②對比患者每次治療前 1 周與治療后 1 周、1 個月肝功能:ALT、AST、白蛋白(ALB)、總膽紅素(TBIL)、直接膽紅素(DBIL)水平變化。③根據國家癌癥研究所不良事件通用術語標準5.0 版(CTCAE V5.0)評價術后不良反應及并發癥情況。

表2 實體瘤療效評價標準(mRECIST)
1.3 統計學方法
采用SPSS 22.0 統計分析軟件。 計量資料采用均數±標準差()表示,組間比較采用獨立樣本t 檢驗,組內比較采用配對樣本t 檢驗,計數資料采用百分率(%)表示,率的比較采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 近期療效比較
DEB-TACE 組 ORR 為 55.6%,高于 cTACE 組的23.1%,差異有統計學意義(P<0.05)。 疾病控制率 DEB-TACE 組 88.89%高于 cTACE 組 53.85%,差異有統計學意義(P<0.05),見表 3、圖 1。
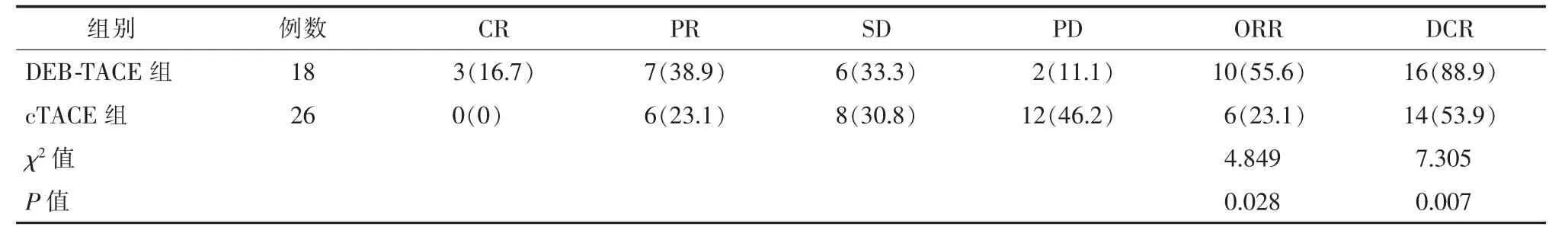
表3 近期治療效果比較

圖1 典型病例影像表現
2.2 肝功能及相關血液指標變化
術前,兩組 ALT、AST、ALB、DBIL 及 TBIL 組間比較差異無統計學意義(P>0.05);術后1 周,兩組ALT、AST、DBIL 及 TBIL 均出現不同程度的升高,且cTACE 組升高程度明顯高于DEB-TACE 組,組間比較差異有統計學意義(P<0.05),術后 1 周 ALB 出現下降,cTACE 組下降程度高于DEB-TACE 組,組間比較差異無統計學意義(P<0.05);術后 1 個月ALT、AST、ALB、DBIL 及 TBIL 恢復正常,兩組組間比較差異無統計學意義(P>0.05),見表4。
2.3 不良反應和并發癥
兩組術后(≤24 h)出現的主要不良反應為疼痛、惡心嘔吐和發熱,DEB-TACE 組的不良反應發生率低于cTACE 組,兩組組間比較差異無統計學意義(P>0.05),術后給予對癥治療后癥狀均可緩解。 兩組患者均未出現肝腎功能衰竭、 膽道損傷或感染、消化道出血、肝膿腫、腫瘤破裂出血、骨髓抑制及心臟毒性表現等嚴重并發癥。 見表5。

表4 手術前后肝功能變化比較

表5 術后常見不良反應比較 n(%)
3 討論
TACE 是近年來針對肝轉移瘤廣泛應用的介入技術。DEB-TACE 通過TACE 的方法將載藥微球和加載的化療藥注入腫瘤供養血管內,微球以可控和持續的方式釋放已經加載的化療藥物,使腫瘤內藥物濃度增加,而正常肝組織及全身藥物濃度相對較低[8]。 本研究結果顯示,DEB-TACE 組的近期療效高于 cTACE 組,與既往文獻相仿[9-11]。 cTACE 治療,主要是通過肝動脈將碘化油和化療藥物混合均勻的乳劑進行栓塞,由于肝轉移瘤血管較少血供不豐富,碘油乳劑進入腫瘤內比較困難,即使進入腫瘤內也很難沉積,且易被沖涮、流失,造成血管再通,故cTACE 治療效果不理想[12]。而載藥微球剛好可以彌補傳統栓塞劑的這些缺點。 它的主要優勢是:①微球中藥物的釋放通過聚乳酸和乳酸/羥基乙酸共聚物、 解離擴散及解吸附等方法,使微球中的藥物釋放速度變慢,成為長效制劑;②載藥微球表面光滑、大小均一,利于靶向選擇相應的血管;③載藥微球具有極好的可變彈性,可壓縮可恢復,可與血管完美嵌合,使栓塞更徹底[2]。載藥微球的這些特點使腫瘤中大量的化療藥物得以維持,導致腫瘤更顯著的壞死。
通過本次回顧性分析,可發現TACE 術后可出現肝功能一定程度的損傷,DEB-TACE 組的損傷程度低于cTACE 組,且術后的不良反應發生率,DEBTACE 組低于cTACE 組。 原因可能為液體碘油能進入肝竇和肝靜脈,同時其更容易導致返流,從而加重對周圍肝組織的損傷。 化療藥物-碘油乳化劑不穩定,乳劑的部分藥物會進入循環系統,導致藥物局部釋放的不可控制性,從而增加與化療藥物相關的不良反應[13]。 而微球粒徑較大不能到達肝竇和毛細血管網,一定程度上降低了小膽管及肝細胞損傷的風險和程度[14]。 有薈萃分析報道,DEB-TACE 在術后常見的不良反應發生率比傳統cTACE 更低[15]。有數據證實cTACE 和DEB-TACE 在毒性方面的相似性,而DEB-TACE 發生嚴重不良事件的發生率略低于cTACE[16]。 本研究所有患者術后均未出現嚴重并發癥。 可看出CalliSpheres 載藥微球作為新型TACE 栓塞劑是相對安全有效的,其對肝功能的影響及術后常見不良反應及并發癥均在可接受范圍之內,且可能在栓塞后綜合征的發生率方面低于傳統碘化油。
綜上所述,CalliSpheres 載藥微球栓塞治療消化系統惡性腫瘤肝臟轉移瘤的治療效果優于cTACE治療,且術后對肝功能的損傷及不良反應的發生率均低于cTACE 治療。 但是本研究例數較少,存在一定的局限性,需要多中心和更大樣本的隨機對照試驗證實。

